ВВЕДЕНИЕ
В конце 2019 г. в Китае произошла вспышка новой коронавирусной инфекции с эпицентром в городе Ухань (провинция Хубэй). Всемирная организация здравоохранения (ВОЗ) 11 февраля 2020 г. определила официальное название инфекции, вызванной новым коронавирусом, – COVID-19 («Coronavirus disease 2019»). Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил официальное название возбудителю инфекции – SARS-CoV-2.
SARS-CoV-2 – РНК-вирус, относящийся к царству Riboviria, отряду Nidovirales, подотряду Cornidovirineae, семейству Coronaviridae, подсемейству Orthocoronavirinae, роду Betacoronavirus, подроду Sarbecovirus, виду SARS [1, 2].
Появление COVID-19 поставило перед специалистами здравоохранения задачи, связанные с быстрой диагностикой и оказанием медицинской помощи больным. В настоящее время продолжается интенсивное изучение клинических и эпидемиологических особенностей заболевания, разработка новых средств его профилактики и лечения. Наиболее распространенным клиническим проявлением COVID-19 выступает двусторонняя пневмония (вирусное диффузное альвеолярное повреждение с микроангиопатией), у 3–4% пациентов зарегистрировано развитие острого респираторного дистресс-синдрома (ОРДС). У части больных развивается гиперкоагуляционный синдром с тромбозами и тромбоэмболиями, кроме того, поражаются центральная нервная система, миокард, почки, печень, желудочно-кишечный тракт (ЖКТ), эндокринная и иммунная системы, возможно развитие сепсиса и септического шока [3].
Для большинства представителей коронавирусов характерна способность поражать пищеварительную систему. SARS-CoV-2 в этом плане не исключение: он инфицирует эпителиоциты ЖКТ, вызывая различные гастроэнтерологические симптомы, такие как тошнота, рвота, синдром отказа от пищи [4]. При этом лихорадка, интоксикация и респираторные симптомы, доминируя в клинической картине, оттесняют на второй план гастроинтестинальные проявления, что может быть причиной потери «золотого часа» у пациентов с COVID-19, когда еще можно купировать патогенетические механизмы и предотвратить тяжелое течение заболевания.
Актуальность представленной работы обусловлена следующими моментами.
1. Эпидемиологическими показателями: очередной пик заболеваемости имел место в августе–октябре 2022 г., когда частота регистрации COVID- 19 в России достигала 40 231 случай в день.
2. Тяжелыми постковидными изменениями, имеющими тенденцию к хронизации.
3. Отсутствием знаний патофизиологических механизмов развития болезни и особенностей ответа организма на лечение, особенно в условиях коморбидности и полипрагмазии.
4. Эндоскопическими данными осложнений со стороны ЖКТ у пациентов, инфицированных SARS-CoV-2, которые были представлены стационарами, перепрофилированными в период пандемии.
Цель работы – изучить осложнения новой коронавирусной инфекции со стороны ЖКТ у пациентов в острый период COVID-19 и в постковидный период.
МАТЕРИАЛ И МЕТОДЫ
Для достижения поставленной цели был выполнен анализ мировой литературы с помощью системы поиска TripDataBase, который позволил изучить и структурировать описанные предположения о патогенетических механизмах поражения ЖКТ при COVID-19, а также проанализировать и структурировать клинические, в том числе эндоскопические, материалы, представленные учреждениями здравоохранения г. Москвы и г. Санкт-Петербурга, принимавшими непосредственное участие в борьбе с пандемией COVID-19 и проводившими обследование и лечение пациентов с постковидным синдромом. Эти учреждения – Многопрофильный медицинский центр Банка России, Московский многопрофильный клинический центр «Коммунарка» Департамента здравоохранения г. Москва, СПБ ГБУЗ «Городская Мариинская больница» (г. Санкт-Петербург), ГБУЗ «ГКБ им. С.П. Боткина» Департамента здравоохранения г. Москва, Клинический медицинский центр «Кусково» Московского государственного медико-стоматологического университета им. А.И. Евдокимова (г. Москва).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В мировой литературе наиболее полно представлены предположения о следующих патогенетических механизмах поражения ЖКТ при COVID-19.
1. Непосредственное вирусное поражение клеток ЖКТ, имеющих рецептор к антиотензинпревращающему ферменту 2 (АПФ2). АПФ2-рецепторы локализуются в легких, печени, почках и ЖКТ. При этом SARS-CoV-2 в 10–20 раз более тропен к АПФ2-рецепторам, чем SARS-COV – возбудитель тяжелого острого респираторного синдрома, вспышка которого пришлась на 2003 г. Это одно из свойств, объясняющих его высокую вирулентность [5]. Попав в организм, вирус проникает в АПФ2-позитивные клетки, где начинает реплицироваться. Однако нативный SARS-CoV-2 не может проникнуть в них, пока не произойдет расщепление его S-белка, состоящего из двух субъединиц – S1 и S2, при помощи сериновой протеазы TMPRSS2. S1-субъединица отвечает за адсорбцию к АПФ2-рецептору, а S2 – осуществляет непосредственное проникновение в клетку-хозяина. Далее все происходит по классическому механизму репликации вирусов с конечным некрозом клетки-хозяина и выходом вирионов в межклеточное пространство [6].
Данную теорию подтверждает электронная микроскопия аутопсийных образцов пациентов с COVID-19, которая также позволила выявить лимфоцитарную инфильтрацию плоского эпителия пищевода, плазматические клетки и лимфоциты с интерстициальным отеком в слизистой желудка, двенадцатиперстной и прямой кишки [7].
О вышеописанном факте свидетельствует и выделение вируса со стулом, которое обнаруживается в 48,1% случаев и может сохраняться ≥33 дней от начала заболевания, даже после отрицательной ПЦР-диагностики мазков из ротоглотки и полости носа [8]. Также доказано, что SARS-CoV-2 может легко распространяться фекально-оральным путем, особенно если вирусная нагрузка в стуле имеет высокие значения [7].
Таким образом, пациенты с поражением ЖКТ, не получающие специфическую терапию, имеют не только риск тяжелого течения заболевания, но и представляют опасность в плане инфицирования окружающих.
2. Иммунологическое поражение ЖКТ («цитокиновый шторм»). Известно, что дисфункция и изменения состава флоры кишечника непосредственно влияют на дыхательные пути посредством иммунной системы слизистых оболочек, а также в обратном направлении. Это явление получило название «ось кишечник – легкие» [9].
По клинико-лабораторным данным во время инфицирования COVID-19 отмечается увеличение количества комплексов CCR9+CD4+T-лимфоцит. CD4+ Т-лимфоциты – основные иммунообразующие клетки слизистых оболочек тонкого кишечника. При этом для их проникновения в слизистую оболочку необходим CC-хемокиновый рецептор типа 9 (CCR9). Эпителий тонкой кишки может экспрессировать CCL25 (хемокинлиганд 25), что способствует привлечению CCR9+CD4+T-лимфоцитов в тонкую кишку. Следствие этого становится нарушение гомеостаза кишечника, приводящее к поляризации T-хелперов 17 в тонком кишечнике. Т-хелперы 17 начинают секретировать большое количества интерлейкина 17А, что влечет за собой рекрутирование нейтрофилов и в конечном итоге иммунологическое повреждение кишечника с развитием диареи и других ЖКТ-симптомов [10].
Помимо этого, существует ось «кишечник – печень». Цитокины, некротизированные частицы пораженных клеток, продукты жизнедеятельности патогенных микроорганизмов вызывают нарушение гомеостаза энтерального микробиоценоза. Из кишечника цитокины с током крови переносятся через воротную вену в печень, приводя к ее дисфункции; в частности нарушается эмульгирование жиров и снижается бактерицидность сока двенадцатиперстной кишки [10]. Наряду с этим, возможно, нарушается всасывание белков, жиров, углеводов, возникает бродильная диспепсия.
3. Актуальным представляется также вопрос об особенностях течения COVID-19 у пациентов с уже имеющейся патологией ЖКТ.
С одной стороны, ряд зарубежных авторов утверждает, что у больных с имеющейся гастроэнтерологической патологией тяжелые осложнения COVID-19 со стороны органов ЖКТ встречаются реже, чем у пациентов с впервые возникшими желудочно-кишечными симптомами, так как они уже получают терапию, направленную на коррекцию гастроинтестинальных поражений [11, 12]. С другой стороны, есть основания полагать, что пациенты с хроническими заболеваниями ЖКТ, а именно воспалительными заболеваниями кишечника (ВЗК), аутоиммунной патологией, циррозом печени, гастроэзофагеальной рефлюксной болезнью (ГЭРБ), могут составлять группу риска по неблагоприятному прогнозу в случае инфицирования SARS-CoV-2 [13], так как компрометированные органы легче становятся мишенью любых поражающих факторов, в том числе вирусов.
4. Не следует забывать и таком факторе, как коморбидность. Это еще одно важное направление при изучении COVID-19.
Наиболее частыми заболеваниями в настоящее время являются сердечно-сосудистые заболевания (ССЗ) и метаболический синдром (МС), течение которых только усугубляется в условиях пандемии. По данным Denson J.L. et al. [14], МС ассоциирован с повышением риска ОРДС и смерти пациентов, госпитализированных с COVID-19. Риск при этом тем выше, чем более выражен МС.
Имеются также данные о том, что при ишемической болезни сердца (ИБС) в сочетании с ГЭРБ симптомы изжоги ассоциированы с эпизодами ишемии миокарда на электрокардиограмме (ЭКГ). Так, описана корреляционная связь патологического гастроэзофагеального рефлюкса и депрессии сегмента ST. Кроме того, доказана триггерная роль приступов стенокардии и нарушений сердечного ритма в манифестации или ухудшении течения ГЭРБ [15, 16].
В то же время у пациентов с ГЭРБ и ИБС при учащении рефлюксов отмечается бóльшая продолжительность ишемических эпизодов как болевой, так и безболевой формы. ГЭРБ также тесно ассоциирована с компонентами МС.
Таким образом, при наличии у пациента, инфицированного SARS-CoV-2, как транссиндромальной, так и транснозологической коморбидности может наблюдаться взаимное потенцирование тяжести заболеваний, вследствие чего следует ожидать более тяжелого прогноза.
5. Коморбидность практически всегда сочетается с полипрагмазией, а следовательно, не исключено негативное побочное действие назначаемых специалистами фармакопрепаратов, если не учитываются их фармакокинетика и фармакодинамика.
Например, кардиотропные лекарственные средства, особенно антикоагулянты и нестероидные противовоспалительные препараты (НПВП), а также нитраты, антагонисты кальция, бета-блокаторы и др. способны оказывать как прямое повреждающее действие на слизистую ЖКТ с последующим развитием эрозивно-язвенных поражений [17], так и опосредованное – снижение тонуса нижнего пищеводного сфинктера с дебютом ГЭРБ в условиях тяжелой инфекционной патологии [17–19].
Известно также об инактивации вируса SARS-CoV-2 при более высоком уровне рН в желудке, что может влиять и на остаточную вирусную нагрузку. Выдвинута гипотеза о том, что прием ингибиторов протонной помпы (ИПП) может повышать риск распространения SARS-CoV-2 в пищеварительной трубке. Следовательно, пациентам с ГЭРБ, которые нуждаются в длительной антисекреторной терапии, необходимо относиться к профилактике COVID-19 более тщательно.
Кроме того, при назначении кислото-супрессивной терапии пациентам с COVID-19 важно учитывать и риск потенциального взаимодействия ИПП с некоторыми лекарственными средствам, применяемыми в противовирусной терапии, в первую очередь с теми, метаболизм которых проходит через систему цитохрома Р450, особенно в условиях коморбидности.
Приводимые далее данные о поражении ЖКТ у пациентов, инфицированных SARS-CoV-2, основывались на результатах эндоскопического обследования как непосредственно в период заболевания, так и в постковидный период.
Поражение слизистой оболочки пищевода при COVID-19
SARS-CoV-2, влияя на рецепторы АПФ 2, поражает слизистую оболочку пищевода, снижает ее защитные свойства, повышает проницаемость эпителия пищевода для бактерий и токсинов [20]. Такие изменения могут провоцировать высвобождение медиаторов воспаления и, как следствие, нарушение перистальтики (прежде всего недостаточность нижнего пищеводного сфинктера) у пациентов, инфицированных вирусом SARS-CoV-2, провоцируя дебют ГЭРБ [21], которая была признана мировым медицинским сообществом болезнью XXI в.
Основной патогенетический механизм ГЭРБ – патологический рефлюкс в виде учащения и длительности эпизодов заброса гастродуоденального содержимого в пищевод при нарушении антирефлюксных защитных механизмов. При этом изменяется резистентность слизистой оболочки пищевода, что в дальнейшем приводит к повышению ее проницаемости и нарушению цитопротективного защитного механизма [12]. Вместе с тем важную роль в развитии ГЭРБ играют провоспалительные цитокины, повышенная секреция фактора некроза опухоли-альфа и цитокин-индуцированного хемоаттрактанта CINC-1, при высокой концентрации которых отмечается бóльшая выраженность эндоскопических изменений и жалоб пациентов [22].
В связи с этим на фоне COVID-19 или в «постковидный период» у пациента либо манифестирует ГЭРБ, либо усугубляется ее течение с большей выраженностью таких клинических проявлений, как изжога и регургитация, что влечет за собой выраженные изменения слизистой оболочки, выявляемые при эндоскопическом осмотре (рис.1).

Важно также отметить, что в повреждении пищевода при COVID-19 определенное значение могут иметь изменения микроциркуляторного русла и цитокиновая агрессия, при которых увеличивается проницаемость слизистой оболочки этого органа. При этом ГЭРБ у таких пациентов может протекать в более тяжелой форме – в виде выраженных эрозивно-язвенных изменений, микозного поражения, обусловленного иммунными нарушениями, а также эозинофильного эзофагита с дисфагией [23].
Поражение слизистой оболочки желудка при COVID-19
Данных о клинических симптомах поражения слизистой желудка в условиях COVID-19 практически не существует, за исключением единичных упоминаний о тошноте, рвоте, отсутствии аппетита. Однако результаты внутрипросветной эндоскопии в специализированных стационарах демонстрируют нестандартную эндоскопическую семиотику: массивные рецидивирующие кровотечения, «плачущую» или «отслаивающуюся» слизистую оболочку, «шрапнельное» поражение слизистой, массивный тромбоз видимых капилляров и некроз стенки (рис. 2) [24].
Поражение слизистой оболочки двенадцатиперстной кишки при COVID-19
Особенность поражений этого отдела ЖКТ по сравнению с другими состоит в том, что в ряде случаев у пациентов, инфицированных SARS-CoV-2, на фоне заболевания проявлялись «скрытые» опухолевые заболевания желчевыводящих путей и поджелудочной железы, которые сопровождались кровотечением на фоне проводимой терапии антикоагулянтами и НПВП (рис. 3).
Поражение слизистой оболочки тонкой кишки при COVID-19
Поражение слизистой тонкой кишки при новой коронавирусной инфекции COVID-19 не описано. В момент первого и последующих пиков было сложно проводить энтероскопические исследования, как в видеокапсульном варианте, так и с применением энтероскопов. В связи с этим данные о поражении тонкой кишки были получены в основном в ходе изучения проксимального отдела при эзофагогастродуоденоскопии или дистального отдела при колоноскопии: в ряде случаев у пациентов выявлялись эрозивные изменения слизистой.
В постковидный период сохраняющиеся энтероколитические симптомы в ряде случаев позволили получить новый эндоскопический материал, одной из находок которого являются клетки Мотта [25]. Это плазматические клетки, которые заполнены тельцами Рассела – оксифильными внутриклеточными белковыми агрегатами. Впервые эти клетки были описаны Mott F. в 1905 г. и названы в его честь. В последующих исследованиях было определено, что все клетки оснащены протетическим аппаратом, который устраняет неправильно свернутые и поврежденные белки. Протеасома 26S, основной двигатель цитоплазматического протеолиза, требует развернутых субстратов, но не эффективна при разложении агрегированных белков. Когда выработка агрегированных белков превышает способность клеток к их элиминации, возникает явление клеточного расстройства эндоплазматического ретикулума (ER). Конденсация этих иммуноглобулинов предполагает, что механизм переноса белка в ER некомпетентен и что белки не расщепляются и не секретируются, оставаясь, таким образом, в расширенных цистернах [26].
В 1983 г. Ohtsuki U. et al. [27] сообщили о случае плазмоклеточной гранулемы желудка, содержащей много плазматических клеток с поликлональными тельцами Рассела и воспалительными клетками. Хотя этот случай не идентифицирован как таковой, он, вероятно, является первым случаем плазмоклеточного гастрита, описанным в литературе.
В 1998 г. Tazawa K. et Tsutsumi U. [28] сообщили о накоплении плазматических клеток, содержащих тельца Рассела, в слизистой оболочке желудка в связи с инфекцией Helicobacter pylori. Этот случай был назван «гастритом тела Рассела». Авторы и ранее указывали на случайное появление плазматических клеток с тельцами Рассела в случаях хронического воспаления.
В 2004 г. Erbersdobler A. et al. описали второй случай гастрита тела Рассела.
Однако все эти данные являются только «информацией к размышлению»…
Поражение слизистой оболочки толстой кишки при COVID-19
Возможность вируса SARS-CoV-2 непосредственно поражать энтероциты, применение самими пациентами и медицинскими работниками обоснованной или необоснованной массивной антибактериальной терапии, антикоагулянтов, НПВП, таргетной терапии, ИПП на фоне геронтологических проблем и непосредственно связанной с ними коморбидности в период лечения новой коронавирусной инфекции создали невероятный, ранее невиданный, микст проблем, который нашел непосредственное отражение в патологии толстой кишки.
Видимые во время эндоскопического обследования пациентов в ковидный/постковидный период поражения слизистой толстой кишки сделали необходимым, помимо известной семиотики, введение новых терминов. Одним из них стало «дисциркуляторное поражение толстой кишки с признаками тромбоза сосудов и некроза слизистой», которое по сути является эрозивно-язвенным процессом в толстой кишке с наличием множественных острых язв, эрозий, участками тромбоза сосудов и ишемии. Финалом его течения становятся токсическая дилатация кишки, некроз стенки и фактически нежизнеспособная кишка (рис. 4, 5).
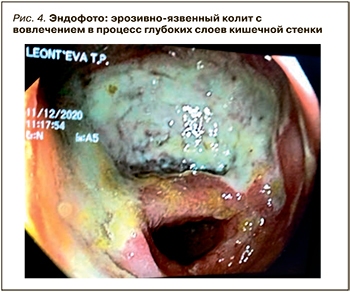
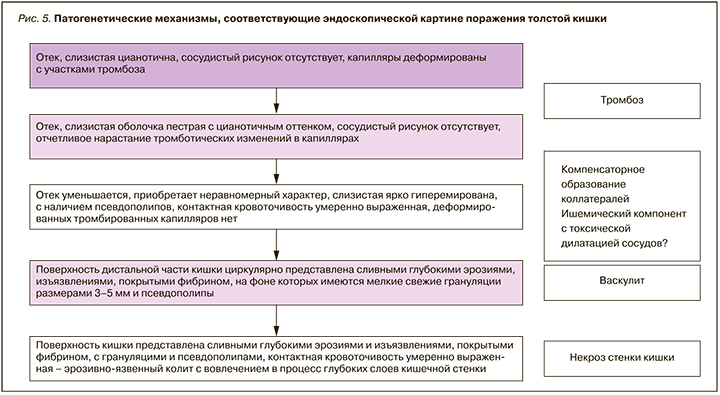
ЗАКЛЮЧЕНИЕ
Представленные данные подтверждают, что новая коронавирусная инфекция COVID-19 – крайне сложная, «коварная» патология, характеризующаяся как прямым поражающим действием, так и способностью запускать триггерные механизмы скрытой, не проявляющей себя до этого патологии, которая носит подчас системный характер. Назначение диагностических мероприятий, эндоскопических и хирургических манипуляций и операций и особенно фармакотерапии требуют от специалистов рационального подхода, знаний по патофизиологии и клинической фармакологии. При этом необходимо оценивать как свойства самого вируса, механизмы его воздействия на человеческий организм, которые до сих пор не изучены, так и особенности ответа самого организма пациента.



