ВВЕДЕНИЕ
Системные васкулиты – гетерогенная группа заболеваний, основным морфологическим признаком которых выступает воспаление сосудистой стенки, а клинические проявления определяются типом, размерами и локализацией пораженных сосудов, а также тяжестью иммуновоспалительных изменений [1]. Дифференциальный диагноз васкулитов базируется на клинике, сеpологических, гистологических и иммуногистологических исследованиях. Существует несколько вариантов классификации системных васкулитов, исходя из превалирующей клинической симптоматики, калибров пораженных сосудов и патогенетических механизмов. Одной из больших групп, объединяющих в себе ряд нозологий, являются васкулиты, ассоциированные с антителами к цитоплазме нейтрофилов (АНЦА, ANCA). ANCA – специфичные антитела к антигенам цитоплазмы, содержащиеся в гранулах нейтрофилов и лизосомах моноцитов. В зависимости от типа окрашивания выделяют цитоплазматический (c-ANCA) и перинуклеарный (p-ANCA) типы этих антител. Наиболее часто встречающиеся антигены-мишени при ANCA-ассоциированных васкулитах (ААВ) – миелопероксидаза (MPO) и протеиназа-3 (PR3). Частота выявления этих маркеров у пациентов с активным ААВ составляет от 50 до 80%. Однако у некоторых пациентов отсутствуют как MPO, так и PR3 антитела, тогда как другие клинические данные убедительно свидетельствуют о наличии системного васкулита, что затрудняет диагностику [2]. В данной статье мы представляем случай системного васкулита, при котором MPO и PR3 были отрицательными, в то время как более редкий бактерицидный увеличивающий проницаемость белок (BPI-ANCA) был положительным.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Больная Д., 79 лет, экстренно поступила в стационар с жалобами на высыпания по всему телу, язвы на голенях, периодически на зуд кожи и повышение температуры тела до 37,5 °С, жажду, частое мочеиспускание, чувство «покалывания» в кистях и стопах, слабость. Заболела в октябре 2019 г., когда возникли точечные высыпания красного цвета в области голеней.
Пациентка была консультирована хирургом, получала лечение антигистаминными препаратами, нестероидными противовоспалительными препаратами (кетопрофен перорально и местно), перевязки – без должного эффекта.
Данные анамнеза: сахарный диабет 2-го типа (СД 2) с осложнениями, гипертоническая болезнь, гипотиреоз. Ежедневно принимает метформин 1000 мг, инсулин лизпро по фиксированной схеме 8–10–8 ЕД, инсулин гларгин 42–44 ЕД, бисопролол 2,5 мг, лизиноприл 10 мг, L-тироксин 100 мкг. В сентябре 2019 г. была вакцинирована препаратом «Совигрипп Вакцина гриппозная инактивированная субъединичная». Наследственность, аллергологический анамнез не отягощены. Вредные привычки пациентка отрицала.
Данные объективного осмотра: состояние средней тяжести, пациентка активна в пределах постели, в сознании. Повышенного питания. Индекс массы тела (ИМТ) 32,35 кг/м2. Температура тела 37,3 °С. Кожные покровы сухие, на голенях язвенно-некротическая сыпь, кольцевидные высыпания, имеющие тенденцию к распространению вверх. Эритематозные пятна в области локтевых сгибов, молочных желез и живота, в поясничной области. Видимые слизистые оболочки бледные, чистые. Лимфоузлы не увеличены. Гипотрофия мышц конечностей. Дыхание в легких везикулярное, хрипов нет. Частота дыхательных движений (ЧДД) 18/мин. Тоны сердца ритмичные, приглушены. Артериальное давление (АД) 130/80 мм рт. ст., частота сердечных сокращений (ЧСС) 82 уд/мин, пульс 82 уд/мин, SpO2 98%. Живот мягкий, безболезненный. Печень и селезенка не увеличены. Пастозность голеней. Стул и мочеиспускание не нарушены.
Предварительный диагноз: М 31.9 Язвенно-некротический васкулит кожи неуточненный. Проводилась дифференциальная диагностика с лимфомой кожи, гангренозной пиодермией, кожной и системной формами красной волчанки, системными васкулитами, антифосфолипидным синдромом, саркомой Капоши, болезнью Лайма, криоглобулинемическим васкулитом, туберкулезом кожи, микотическим дерматитом.
В анализах крови: лейкоцитоз – 17,2×109/л с преобладанием гранулоцитов (12,5×109/л); лимфоцитоз – 3,5×109/л; ускорение скорости оседания эритроцитов (СОЭ) до 24 мм/ч; тромбоциты – 229×109/л. Сывороточная глюкоза – 14,15 ммоль/л; гликолизированный гемоглобин (HbA1c) – 8,5%; отклонения других биохимических параметров не выявлено. Активированное частичное тромбопластиновое время (АЧТВ) 25 с; международное нормализованное отношение (МНО) 1,18; протромбиновый индекс (ПТИ) 86,7%; тиреотропный гормон (ТТГ) – 2,7 мМЕ/л; тироксин свободный (Т4св.) – 16,2 пмоль/л. Лабораторные маркеры вирусных гепатитов В и С, ВИЧ-инфекции, сифилиса, криоглобулины, антифосфолипидные антитела IgM, Ig G не обнаружены.
В моче: глюкоза – 14 ммоль/л; белок, кетоны, цилиндры отсутствуют.
Исследованные маркеры системных заболеваний представлены в таблице.

Парапротеина, представленного Ig G, IgM, IgA, IgD, IgE, каппа/лямбда цепями, в сыворотке крови обнаружено не было.
Данные посева из раневого отделяемого: рост E. coli 10×5/ст, чувствительность к пенициллину, цефалоспоринам 3 поколения.
С целью уточнения диагноза была проведена биопсия кожи и изъязвленного участка голени. В гистологическом материале – фрагменты кожи голени, покрытые дистрофичным многослойным плоским эпителием, с очаговыми явлениями выраженного акантоза, гиперкератоза, койлоцитоза. На отдельных участках – хроническая гранулирующая язва кожи с фиброзным дном и слабой воспалительной инфильтрацией в ее краях и фиброзном дне. В толще фиброзированной дермы – рассеянные очаги и группы сосудов мелкого калибра, местами собранные в пучки, с умеренной и слабой лимфолейкоцитарной инфильтрацией в паравазальном пространстве. Окраска по Цилю–Нильсену отрицательная. Окраска по Ван Гизону – выраженная фуксинофиллия в очагах субэпителиального склероза и по периферии сосудистых пучков. Окраска по Гомори–Грокотт – очаги пылевидной импрегнации серебром в участках койлоцитоза в многослойном плоском эпителии и частично в коллагеновых волокнах.
При проведении иммуногистохимического исследования выявлена выраженная позитивная экспрессия маркеров CD4, CD8, CD34, CD45, SMA (рис.1), умеренно позитивная – CD3, CD20, Cytokeratin AE/AE3, Ki-67, S100.
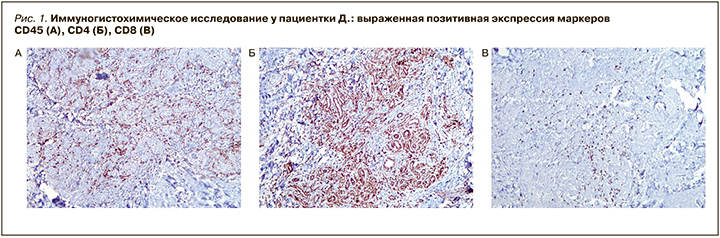
Таким образом, у пациентки наблюдались морфологическая картина и иммунофенотип хронической гранулирующей язвы кожи с явлениями неспецифического васкулита в дерме.
На рентгенограмме органов грудной клетки очаговых и инфильтративных теней в легких выявлено не было.
Клинический диагноз:
- основной: М 31.8 Язвенно-некротический васкулит, ассоциированный с антителами к BPI – АНЦА, подострое течение, активность высокая;
- сопутствующий: СД 2 (инсулинопотребный), тяжелая форма, фаза декомпенсации (целевой уровень HbA1c <7,5 %).
Проведенное лечение: инфузии дексаметазона 8 мг/сут на физрастворе № 3 с последующим переходом на преднизолон 10 мг/сут; гастропротекция (омепразол 20 мг/сут); антиагреганты (ацетилсалициловая кислота 50 мг/ сут, пентоксифиллин 2% – 5,0 мл внутривенно, капельно); гиполипидемическая терапия (аторвастатин 20 мг/сут); метаболические и нейропротективные средства (тиоктовая кислота 600 мг/сут, витамины В1, В6, В12); антибиотики (амоксициллин + клавулановая кислота 1000 мг 2 раза/сут в течение 14 дней) с учетом чувствительности флоры; пробиотики; регулярные перевязки, обработка ран порошком цинк бацитрацин (250 МЕ/г) + неомицин сульфат (5000 МЕ/г) – длительно.
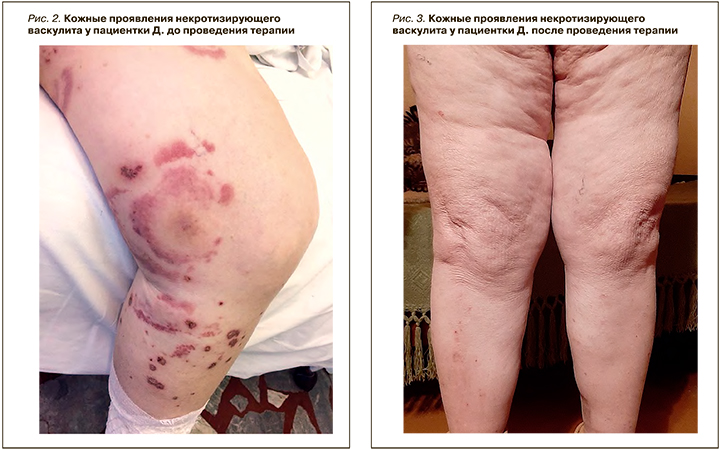
После заживления язв доза преднизолона была уменьшена до 5 мг/сут с последующей отменой. Была назначена капилляростабилизирующая терапия препаратом Аскорутин 50 мг 3 раза/сут в течение 2 мес под контролем гликемии. Местно – мазь, содержащая хлорамфеникол и метилурацил, компрессионный трикотаж. На фоне проведенного лечения выраженная положительная динамика в виде заживления язв, уменьшения интенсивности сыпи, регресса субъективной клинической симптоматики (рис. 2, 3).
ОБСУЖДЕНИЕ
Человеческие нейтрофилы содержат по крайней мере три типа гранул, включая азурофильные, вторичные и третичные гранулы, каждая из которых включает множество белков. Следовательно, могут быть получены антитела против многих компонентов этих гранул. Фактически существуют другие типы ANCA, которые не являются ни PR3-, ни MPO-ANCA. Приблизительно 80% пациентов, чья сыворотка положительна на p-ANCA или c-ANCA, но отрицательна как на PR3-, так и на MPO-ANCA, имеют положительную реакцию на другие ANCA, такие как анти-BPI, катепсин G, лактоферрин, эластаза, азуроцидин и антитела к лизоциму [2]. Они наблюдаются реже, чем MPO- и PR3-ANCA, и известны как второстепенные ANCA (x-ANCA).
Об ANCA-антителах к BPI (BPI-ANCA) впервые сообщили Zhao et al. в 1995 г. [3]. BPI – это белок, который в большом количестве содержится в азурофильных гранулах нейтрофилов и играет важную роль в антибактериальной защите от грамотрицательных бактерий. Эндотоксин и белки наружной мембраны бактерий имеют сильное сродство к BPI и образуют с ним комплексы. Эти комплексы процессируются антигенпрезентирующими клетками, что приводит к генерации BPI-ANCA [4]. BPI-ANCA был обнаружен при различных заболеваниях легких, включая муковисцидоз, диффузный панбронхиолит, бронхоэктатическую болезнь и ревматоидный артрит с поражением бронхов [5]. Остается неясным, является ли он патогенным или просто серологическим маркером заболевания. Schultz H. et al. описали возможную роль BPI-ANCA в восприимчивости к грамотрицательным бактериальным инфекциям у таких пациентов. Фактически они продемонстрировали, что BPI-ANCA-положительные сыворотки ингибируют антимикробную функцию BPI in vitro [6].
В связи с этим появляется все больше свидетельств того, что BPI-ANCA играет ключевую роль в патогенезе бактериальных инфекций. В нашем случае имело место наличие бактериального поражения голени кишечной палочкой; однако клинически преобладала картина васкулита. Комплексная терапия антибактериальными и противовоспалительными препаратами позволила достичь стойкого положительного результата.
ЗАКЛЮЧЕНИЕ
Таким образом, приведенный клинический случай позволяет сделать выводы о том, что скрининг ANCA полезен для диагностики системного васкулита, когда сыворотка пациента отрицательна на MPO- и PR3- ANCA и отражает возможную роль BPI-ANCA в патогенезе системного васкулита, ассоциированного с микробным поражением.



