ВВЕДЕНИЕ
Асептический некроз кости, или остеонекроз, – многофакторное дегенеративно-дистрофическое поражение костной ткани, возникающее в ответ на нарушение кровоснабжения, вызывающее гибель костного мозга и трабекулярной кости и впоследствии приводящее к повреждению и хрящевой ткани с развитием артроза и/или артрита прилежащего сустава [1]. Заболевание наиболее часто встречается у мужчин (8:1) молодого и среднего возрастов и составляет 1,5–2% всей ортопедической патологии [2].
Остеонекроз может быть первичным, или идиопатическим (в 5% случаев), когда нет видимой, конкретной его причины. В свою очередь, вторичный остеонекроз развивается в результате действия многих причинных факторов, таких как прием системных глюкокортикоидов и употребление алкоголя (в 90% случаев), а также травмы, аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит, системные васкулиты), лучевая и химиотерапия, коагулопатии (нарушения свертывания, связанные с дефицитом протеинов C и S, антитромбина III, антифосфолипидный синдром), эндокринные нарушения (гиперпаратиреоз, подагра), болезни накопления (болезнь Гоше), заболевания желудочно-кишечного тракта (язвенный колит, панкреатит), серповидноклеточная анемия, новая коронавирусная инфекция (COVID-19), протекающая с тяжелой дыхательной недостаточностью и др. [1, 3–5].
К настоящему времени хорошо разработаны подходы к хирургическому лечению асептических некрозов, которое наиболее эффективно и применимо в случаях далеко зашедших рентгенологических стадий остеонекроза. Вместе с тем в современных условиях широкое внедрение магнитно-резонансной томографии (МРТ) позволяет выявлять асептические некрозы на ранних стадиях, когда оперативное лечение еще не показано и пациента может наблюдать и лечить терапевт. Однако консервативные методы терапии асептических некрозов пока имеют малую доказательную базу. В то же время, исходя из данных научной литературы, можно утверждать, что существуют предпосылки к тому, чтобы рассматривать методы медикаментозного комплексного лечения как наиболее эффективные на ранних стадиях болезни. В частности, наиболее перспективным в этом плане может быть использование немедикаментозных мер с ограничением нагрузки в сочетании с назначением антикоагулянтов, липидснижающих средств (при наличии дислипидемии), терипаратида, SYSADOA и гиалуроновой кислоты.
В представленной статье приводится клинический случай комплексного лечения множественного асептического некроза у мужчины 44 лет.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Данные анамнеза: пациент М., 1975 г.р., в возрасте 10 лет после падения во второго этажа перенес компрессионный перелом грудных позвонков с прогрессирующими радикулопатиями.
В возрасте 40 лет, в 2015 г., при обследовании по поводу болей в спине механического характера у пациента был выявлен распространенный остеопороз с дегенеративно-дистрофическим заболеванием позвоночника (Z-критерий=-3,8 SD). В том же 2015 г. с учетом неэффективности медикаментозного лечения радикулопатии ему была выполнена фиксация позвоночника на уровне L4 металлоконструкцией, без клинического эффекта, с проведением локальных блокад на уровне поясничного отдела, также без клинического анальгезирующего эффекта.
Данные остеоденситометрии через 6 мес после операции (2015): поясничный отдел позвоночника – остеопороз: L5 – Z-критерий=-3,5 SD; металлоконструкции на уровне L4; L1 – Z-критерий=-3,0 SD; Th11 – Z-критерий=-4,7 SD (все перечисленные изменения соответствуют остеопорозу). Проксимальный отдел левого бедра – Z-критерий=- 0,4 SD (минеральная плотность костной ткани в норме). Правое предплечье – Z-критерий=-1,6 SD (изменение соответствует остеопении).
Данные биохимического анализа крови: витамин D3 – 68,5 ЕД (норма); хромогранин А – 12,4 мкг/л (норма); остеокальцин – 12,0 нг/мл (норма).
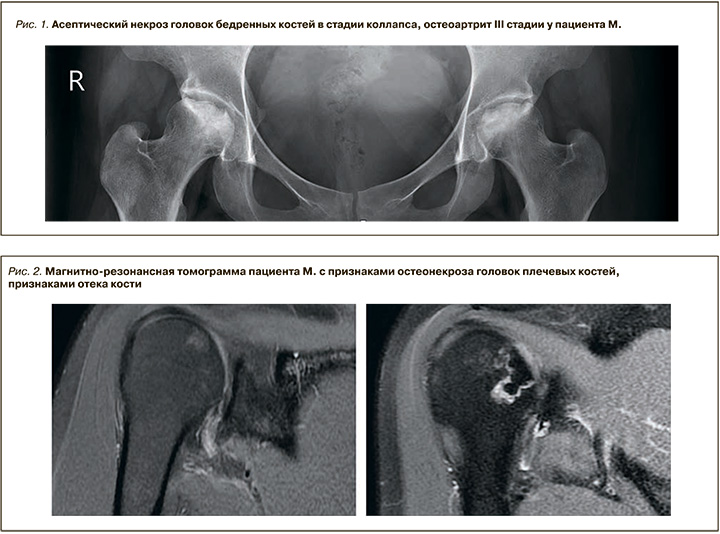
В 2016 г. у пациента были отмечены ограничение движений и боли в области тазобедренных суставов, при обследовании выявлены асептический некроз головок бедренных костей в стадии коллапса и остеоартрит III стадии по Келлгрен–Лоуренс (рис. 1). Было проведено тотальное эндопротезирование тазобедренных суставов с обеих сторон без осложнений в послеоперационном периоде с хорошим клиническим эффектом (болевой синдром разрешился полностью, подвижность восстановилась в полном объеме).
В возрасте 42 лет (2017) у пациента появились интенсивные боли в плечевых суставах смешанного воспалительного и механического характера. При повторной рентгеноденситометрии была выявлена остеопения с риском перелома в L2 (Z-критерий=-2,1 SD) и L3 (Z-критерий=-2,0 SD).
При МРТ пояснично-крестцового отдела позвоночника были установлены наличие состояния после транспедикулярной фиксации (ТПФ) по поводу пластики межпозвонкового диска L5–S1, дегенеративно-дистрофические изменения пояснично-крестцового отдела позвоночника: остеохондроз и спондилоартроз L1–S1; экструзия межпозвонкового диска L4–L5, протрузия межпозвонкового диска L5– S1.
При МРТ крестцово-подвздошных сочленений (КПС) были обнаружены признаки артроза КПС, при этом убедительных МР-данных в пользу свежих патологических изменений КПС получено не было.
С учетом отсутствия носительства HLA-B27 человеческого комплекса гистосовместимости предположение о наличии у пациента аксиального спондилита было отвергнуто. По результатам позитронно-эмиссионной компьютерной томографии (ПЭТ-КТ) всего тела признаков ФДГ-позитивного злокачественного образования в пределах разрешающей способности метода (4 мм) установлено не было.
Верифицирован остеонекроз головок плечевых костей. Пациента беспокоили интенсивные (9 и 7 баллов по числовой рейтинговой шкале) боли и ограничение подвижности плечевых суставов. На МРТ плечевых суставов было выявлено наличие очагов остеонекроза плечевых костей, окруженных зоной отека костного мозга размером 2,0×1,4 см слева и 1,7×0,9 см справа (рис. 2).
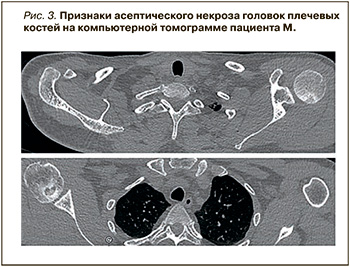
При мультиспиральной компьютерной томографии (МСКТ) была обнаружена гиподенсная зона 1,5×1,2×1,1 см с четкими склерозированными контурами и обширной зоной остеосклероза справа и 2,1×1,3×0,8 см с незначительно выраженным остеосклеротическим ободком слева (рис. 3).
Из факторов риска асептических некрозов у пациента были выявлены злоупотребление алкоголем (более 26 единиц алкоголя в неделю), курение, дислипидемия и гипергомоцистеинемия. Были предложены методы коррекции указанных факторов риска, которые были выполнены больным лишь частично. Рекомендован покой плечевых суставов с элементами лечебной гимнастики без осевых нагрузок. Из лекарственных средств были назначены эноксапарин 4 ЕД/сут, эторикоксиб 90 мг/сут, розувастатин 10 мг/сут, топические НПВП, проведено однократное введение раствора золендроновой кислоты в дозе 5 мг, начат прием фолиевой кислоты 1 мг/сут. С учетом гипертонической болезни пациенту также были рекомендованы периноприл 5 мг/сут и амлодипин 5 мг/сут.
В 2018 г. при повторной МРТ пояснично-крестцового отдела позвоночника какой-либо динамики со стороны визуализирующей картины выявлено не было. По данным повторной МРТ плечевых суставов отмечалось увеличение зоны некрозов до размеров 2,2×1,6 см слева и 1,9×1,3 см справа, усиление перифокального отека. При электронейромиографическом исследовании были установлены признаки умеренных супрасегментарных нарушений контроля мышц голеней с двух сторон, поражения периферических нервов верхних и нижних конечностей, мотонейронов и корешков спинного мозга на уровне поясничного и шейного утолщения. Первично-мышечного поражения обнаружено не было, данных в пользу полинейропатии верхних и нижних конечностей, миопатии, миелопатии на уровне поясничного утолщения и миотонии не имелось.
К жалобам на боли в плечевых суставах у пациента добавились высокоинтенсивные ежедневные головные боли по типу мигрени без ауры с улучшением после дневного сна. Отмечалась также холодовая мигрень в виде головных болей, начинающихся с области фронтальных синусов в холодную погоду.
В ходе дополнительного обследования, направленного на исключение вторичного генеза множественных асептических некрозов, признаков миеломной болезни, криоглобулинемии, антифосфолипидного синдрома у пациента найдено не было.
Для подробного обследования 15.10.2018 пациент был госпитализирован в стационар отделения гематологии и трансплантации костного мозга Всероссийского центра экстренной и радиационной медицины им. А.М. Никифорова. На основании цитологического исследования костного мозга, иммунофенотипирования на хронические миело- и лимфопролиферативные заболевания данных в пользу гематологических патологий получено не было. Изменения в агрегации тромбоцитов, показателях тромбодинамики и данных коагулограммы при обследовании не наблюдались. Отмечалось незначительное ускорение скорости формирования сгустка и увеличение его размеров при тромбодинамике без значимого отклонения от нормы.
С учетом наличия гомоцистеинемии пациентом был продолжен прием фолиевой кислоты, эноксапарин заменен на ацетилсалициловую кислоту с магния гидроксидом внутрь (75 мг/ сут). При обследовании были исключены антифосфолипидный синдром, а также группа васкулитов (антитела к кардиолипинам, волчаночный антикоагулянт, β2-гликопротеид многократно отрицательные). При контроле липидограммы сохранялось ранее выявленное незначительное повышение уровней общего холестерина (5,6 ммоль/л) и ЛПНП (3,6 ммоль/л) при нормальном уровне ЛПВП и ЛПОНП. Повторная попытка назначения статинов (последовательно розувастатин и аторвастатин) была прервана из-за выраженных головных болей и когнитивной дисфункции у пациента на фоне приема препаратов.
При выполнении МРТ в сосудистом режиме были выявлены признаки врожденных сосудистых мальформаций в виде гипоплазии А1 сегмента правой передней мозговой артерии, задней правосторонней трифуркации мозговых артерий.
С учетом проводившегося ранее лечения мигрени (с отсутствием эффективности от анальгетиков, НПВП, амитриптилина, суматриптана), пациенту были добавлены к терапии циннаризин, бисопролол, элетриптан, а также повторно даны рекомендации по исключению провоцирующих приступы мигрени факторов (алкоголь, нервно-психическое перенапряжение).
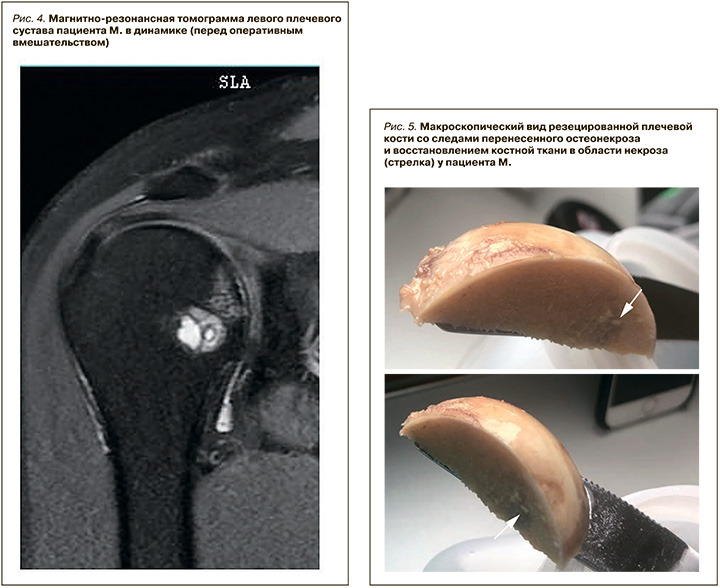
Пациент продолжил прием ацетилсалициловой кислоты с магния гидроксидом 75 мг/сут, эторикоксиба 90 мг/сут, фолиевой кислоты 1 мг/ сут. В связи с отсутствием значимой положительной динамики от лечения в состав терапии был добавлен терипаратид 20 мкг/сут подкожно. Лечение этим препаратом продолжалось 4 мес, по его итогам у пациента купировался болевой синдром, исчезли зона отека костного мозга и вторичный синовит плечевых суставов по данным МРТ, сохранились склероз в области головок плечевых костей и нормальная форма этих головок, восстановилась подвижность плечевых суставов в полном объеме (рис. 4). Боли в суставах в покое и при обычных движениях отсутствовали и отмечались пациентов лишь при максимальном отведении плеча назад (плавание). С этого момента к лечению был добавлен прием комбинированного препарата, содержащего глюкозамина сульфат и хондроитина сульфат (1500 и 1200 мг/сут соответственно).
В январе 2019 г. пациент был консультирован в клинике Германии, где, несмотря на отсутствие клинической симптоматики (сохранялся только минимальный болевой синдром механического характера интенсивностью в 2 балла в левом плечевом суставе в момент плавания) и сохранную форму головки плеча, ему была выполнена частичная секторальная резекция некротизированной головки левой плечевой кости. В ходе резекции макроскопически были выявлены следы перенесенного асептического некроза при сохранной форме головки и минимальных повреждениях хряща. Данные макроскопии: резецированный фрагмент части головки плечевой кости с двумя гладко спиленными ступенчатыми ампутированными краями 4,7×1,8×3,0 см. Хрящевая головка не повреждена, хрящевая головка толщиной 0,1–0,2 мм. На поверхности 2,0×1,7 см наблюдается неоднородное бледно-желтое окрашивание губчатой ткани. На пластинчатых порезах признаки злокачественных очаговых образований отсутствуют (рис. 5).
Данные микроскопии (4 × гематоксилин-эозин, 1 × Шифф-йодная кислота, 1 × окрашивание по Ван Гизону): резецированный фрагмент части головки плечевой кости размером 2,0 см с субхондральным некрозом кости и костномозговой полости в сопровождении резорбтивного воспаления с обильной инфильтрацией плазматическими клетками. В зоне некроза отмечается восстановление костной ткани. Прилегающий к зоне остеонекроза суставной хрящ имеет признаки общего нарушения текстуры.
Операция осложнилась адгезивным капсулитом с постоянным болевым синдромом, требующим применения наркотических анальгетиков, что привело к повторной оперативной коррекции (май 2020 г.). После нее наблюдались стойкое ограничение подвижности плечевого сустава во всех плоскостях (исходно 8°), постоянные механические боли в суставах. Лечение правого плечевого сустава было продолжено консервативными методами: пациент соблюдал двигательные режимы, постоянно принимал комбинированный препарат глюкозамина сульфата и хондроитина сульфата, в полость сустава ему вводилась 1% гиалуроновая кислота с периодичностью 1 раз в год. На фоне такой терапии в течение 2 последующих лет наблюдения объем движений в правом суставе у пациента остался сохраненным в полном объеме, боли в суставе, возникавшие после нарушения двигательных рекомендаций (физической перегрузки) 1–2 раза/мес, купировались приемом эторикоксиба 90 мг или нимесулида 100 мг. Введение раствора гиалуроновой кислоты в оперированный левый плечевой сустав в сочетании с комплексными медикаментозными и немедикаментозными мерами привело к увеличению объема движений в суставе с 8 до 34°. Болевой синдром на фоне лечения пациент расценивал в 2–3 балла.
ОБСУЖДЕНИЕ
В приведенном наблюдении у пациента мужского пола работоспособного возраста развились асептические некрозы головок бедренных и плечевых костей на фоне таких факторов риска, как употребление алкоголя, курение и гипергомоцистеинемия. Сопутствующее состояние – остеопороз. По данным литературных источников, наиболее часто асептическому некрозу подвержены головки бедренной и плечевой кости, что наблюдалось и в нашем случае. Ежегодно во всем мире остеонекроз тазобедренных, коленных, плечевых суставов и суставов других локализаций регистрируют примерно у 20 тыс. человек. При этом у одного больного могут поражаться как один, так и несколько суставов. Например, симптоматический остеонекроз головки бедра более чем в 10% случаев сопровождается вовлечением коленного и плечевого суставов, а у 3% больных встречается поражение суставов более 3 анатомических областей. В дополнение к прямым цитотоксическим факторам критическое снижение перфузии субхондрального костного пространства в конечном итоге приводит к ишемии костного мозга и костному некрозу. МРТ способна визуализировать реактивную пограничную зону некроза на ранней, уже необратимой и часто бессимптомной стадии. Позже в процессе развития остеонекроз прогрессирует с образованием змеевидных склеротических линий, охватывающих область некротизированной кости [1, 4].
Патогенез остеонекроза в представленном примере также совпадает с представленными в литературе данными: при приеме глюкокортикостероидов или алкоголя, а также влиянии других факторов развития остеонекроза происходит жировое перерождение костного мозга с последующей гипертрофией жировых клеток, которые вызывают отек и повышение давления в костном мозге. Это, в свою очередь, приводит к снижению скорости пульсовой волны в сосудах, питающих головку кости, с последующим развитием внутрисосудистой гиперкоагуляции. Если компенсаторные механизмы (ангиогенез и фибринолиз) работают в должной степени, то возникает преходящая ишемия, и остеонекроз носит характер преходящего инфаркта костного мозга. Однако если ангиогенез и фибринолиз недостаточны, то ишемия продолжается, нарастает некроз костного мозга, остеоциты погибают, и остеонекроз приобретает необратимый характер, что ведет к переломам и коллапсу костной ткани, а в дальнейшем и к развитию дегенеративного остеоартрита [3, 4].
Условно выделяют 4 категории остеонекроза.
1. Ишемический остеонекроз (синонимы – аваскулярный или асептический), развивающийся в ответ на локальное нарушение циркуляции при тромбозе основного сосуда или его ветвей, питающих кость.
2. Остеонекроз при хронических артритах, локальном и системном остеопорозе, когда патологические изменения связаны с остеитом или отеком субхондральных отделов кости. Наблюдающиеся при этом нарушения дифференцировки стромальных клеток и замещение костного мозга жировой тканью (как исход реактивного воспаления) неминуемо вызывают отек (сдавление) сосудов микроциркуляторного русла. Аналогичные изменения наблюдаются и в случае микропереломов костных трабекул при субхондральном остеопорозе.
3. Остеонекроз челюсти как нежелательная реакция терапии костных метастазов бисфосфонатами у онкологических больных.
4. Спорадический остеонекроз (болезнь Легга–Кальве–Пертеса, болезнь Хасса и др.) [1].
Стадии остеонекроза
1. Доклиническая – нет болевого синдрома, случайная находка на МРТ.
2. Дорентгенологическая – на рентгенограмме нет видимых изменений, однако при проведении МРТ наблюдается снижение сигнала в режиме T1, т.е. отек костного мозга.
3. Рентгенологическая – на рентгенограмме визуализируется остеосклероз.
4. Преколлапс – депрессия головки менее 2 мм.
5. Постколлапс – депрессия головки более 2 мм.
6. Артритическая – локальный остеоартрит в зоне случившегося остеонекроза [3, 4].
Диагностика остеонекроза: рентгенография способна выявить перелом кости и сопутствующий остеоартрит сустава, однако остеонекроз визуализируется уже на поздней стадии. Поэтому рекомендуется проводить МРТ костей, позволяющую обнаружить остеонекроз на ранней (дорентгенологической) стадии заболевания [4, 6].
Тактика ведения пациентов с остеонекрозом и остеоартритом: исходя из патогенеза можно заключить, что до развития необратимого остеонекроза могут быть эффективны комплексные терапевтические методы лечения. При случившихся переломах и коллапсе костной ткани, а также при развитии остеоартрита остеонекроз терапевтическому лечению не поддается; в этом случае необходимо применять ортопедически-травматологические методы лечения.
Итак, на ранней стадии остеонекроза необходимы разгрузка прилежащего сустава в острый период на срок не менее 3 мес, контроль массы тела, лечебная гимнастика. Фармакологические методы лечения включают:
- обезболивающие средства (НПВП);
- остеотропные препараты (препараты, содержащие кальция карбонат/остеогенон и колекальциферол/альфакальцидол);
- антирезорбтивные средства (бисфосфонаты или деносумаб), при этом в связи с отсутствием в аннотации к бисфосфонатам рекомендаций по использованию именно при остеонекрозе они могут применяться только как терапия off lable;
- анаболические препараты (терипаратид как терапия off lable);
- сосудистые средства (дипиридамол или илопрост), при этом назначение илопроста ограничено из-за возможности его использования исключительно в условиях стационара;
- гиполипидемическую, дезагрегантную терапию;
- антикоагулянты (эноксапарин);
- базисное лечение остеоартрита – симптом-модифицирующие препараты замедленного действия (SYSADOA);
- внутрисуставное введение гиалуроновой кислоты или обогащенной тромбоцитами плазмы [2–4, 6].
Терипаратид (Форстео) – рекомбинантный паратиреодный гормон человека. Это единственный зарегистрированный в России анаболический препарат для терапии остеопороза, повышающий плотность и прочность костной ткани. Терипаратид стимулирует формирование костной ткани посредством прямого влияния на остеобласты, предотвращая их апоптоз, а также опосредованно увеличивает кишечную абсорбцию и канальцевую реабсорбцию кальция и экскрецию фосфатов почками. Таким образом, на фоне терапии терипаратидом увеличивается минеральная плотности костной ткани (МПК) и, как следствие, снижаются скорость прогрессирования коллапса и риск развития переломов независимо от возраста, исходных показателей костного метаболизма или величины МПК [7–12].
Важно, что в представленном нами случае использовалась совершенно различная тактика лечения остеонекроза разной локализации. Так, для коррекции остеонекроза головок бедренных костей было выбрано единственно верное решение – тотальное эндопротезирование суставов. Выбор этого метода был связан с поздним обращением пациента, обусловившим выявление остеонекроза уже на поздней рентгенологической стадии с коллапсом головок бедра, когда какие-либо консервативные меры бесполезны. В то же время применение консервативного лечения остеонекроза головок плечевых костей с учетом обнаружения их на стадии преколлапса представляется крайне перспективным для терапевтического звена: об этом может свидетельствовать достигнутый положительный результат в виде разрешения болевого синдрома и восстановления подвижности суставов, подкрепленный фактом восстановления костной ткани в области остеонекроза по данным гистологического исследования.
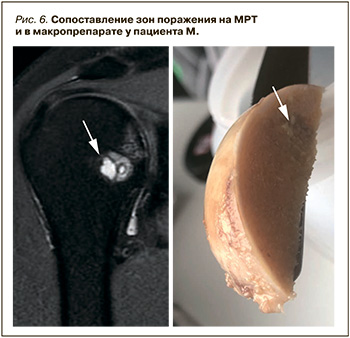
Решение же оперировать у рассмотренного пациента левый плечевой сустав в условиях наличия минимальной выраженной клиники остеоартрита, являющегося стадией развития любого ОН, следует считать ошибочным. Это подтверждают и данные сопоставления изменений на МРТ с изменениями макропрепарата (рис. 6).
Консервативная тактика ведения неоперированного правого сустава доказала, что после разрешения острой фазы остеонекроза при условии сохранения целостности головки плеча усилия врачей должны быть направлены не на оперативное лечение, а на лечение остеоартроза как исхода остеонекроза. В связи с этим перспективным может быть применение SYSADOA c базисной противовоспалительной активностью в сочетании с внутрисуставным введением гиалуроновой кислоты [14, 15].
Особое внимание следует обратить на то, что исходом любой из форм остеонекроза становится формирование остеоартрита суставов, который требует пожизненного наблюдения и лечения пациента. В нашем случае в качестве мер медикаментозного лечения остеоартрита плечевых суставов (справа – постишемический, слева – постоперационный с элементами адгезивного капсулита) было выбрано именно долгосрочное применение SYSADOA в сочетании c внутрисуставным введением гиалуроновой кислоты. Использование внутрисуставных инъекций было оправдано имеющимся опытом ее применения и доказанной клинической эффективностью как в случае остеоартрита коленных и плечевых суставов, так и при лечении пациентов после оперативного вмешательства на суставах. Показано, что своевременное введение гиалуроновой кислоты значимо уменьшает болевой синдром и уменьшает скорость структурного прогрессирования остеоартрита, что и было продемонстрировано и в представленном наблюдении [16–18].
Следует добавить, что планомерное консервативное лечение остеоартрита левого плечевого сустава позволило в определенной степени компенсировать последствия такого операционного осложнения, как адгезивный плексит, что проявилось уменьшением болевого синдрома в суставе до умеренного и постепенным увеличением объема движений в суставе.
ЗАКЛЮЧЕНИЕ
1. Тактика лечения остеонекроза определяется стадией, на которой он выявлен. Поздние стадии остеонекроза головок костей требуют оперативного лечения. Асептический некроз кости, выявленный на ранней стадии, должен лечиться консервативно с применением мер по коррекции двигательного режима, НПВП, антикоагулянтов, бисфосфонатов и/или терипаратида. Указанное лечение согласуется решением врачебной комиссии.
2. Исходом ишемической стадии остеонекроза становится остеоартрит, лечение которого проводится согласно национальным рекомендациям с применением немедикаментозных мер, SYSADOA, НПВП, локальной и внутрисуставой терапии.
3. Внутрисуставное введение раствора гиалуроновой кислоты положительно влияет на клинические и структурные изменения суставов с постишемическим или постоперационным остеоартритом, а также на объем движения в пораженных суставах.
4. Коррекции факторов риска развития ишемического поражения костей должна проводиться на всех стадиях лечения заболевания, в том числе в случаях оперативного лечения по типу тотального эндопротезирования с целью профилактики вовлечения в патологический процесс ранее не пораженных костей.



