Коронавирусная инфекция, достигшая размеров пандемии и поразившая большинство стран, остается серьезной проблемой мировой медицины [1]. Особенности патогенеза заболевания связаны с масштабными системными нарушениями, требующими оценки и обязательной коррекции [2]. Иммунные сдвиги, нарушения в системе гемостаза и в работе многих внутренних органов требуют комплексной терапии и достаточно длительной реабилитации переболевших COVID-19 пациентов [3]. В силу тропности вируса к легочной ткани, а также вовлечения системы гемостаза в патологический процесс наибольшую значимость при коронавирусной инфекции имеют респираторный дистресс-синдром и разной степени выраженности проявления гипоксии [2, 4].
Гипоксия – патологическое состояние, обусловленное несоответствием между поступлением кислорода к тканям или способностью тканей использовать кислород и потребностью в нем. По классификации И.Р. Петрова выделяют 6 основных типов гипоксии:
- экзогенную – вследствие уменьшения парциального давления кислорода в крови;
- респираторную – вследствие недостаточного поступления кислорода из атмосферного воздуха в кровь;
- циркуляторную – вследствие недостаточности функции сердца и сосудистого тонуса, что приводит к снижению количества крови, притекающей к тканям в единицу времени;
- гемическую – вследствие снижения уровня гемоглобина, способного присоединить кислород;
- тканевую – вследствие нарушения процессов биологического окисления, связанного с изменениями активности дыхательных ферментов, из-за чего ткани не могут использовать кислород, содержащийся в крови;
- смешанную.
Известно, что наиболее чувствительны к кислородной недостаточности центральная нервная система (ЦНС), миокард и почки. При острой гипоксии больше всего страдает функция высших отделов ЦНС, а при хронической – сердечно-сосудистой системы, дыхания, системы крови.
Лечение гипоксии предполагает два направления:
- этиотропное – устранение причины гипоксии;
- патогенетическое – устранение нарушений метаболизма, вызванных нехваткой кислорода.
Перспективным в этом плане представляется использование корректоров метаболизма – веществ, которые сами не являются субстратами, но корригируют отдельные метаболические процессы. «Идеальный» метаболический препарат должен препятствовать накоплению в клетках недоокисленных жирных кислот (ЖК) и тем самым предотвращать повреждение клеточных мембран, усиливать поступление пирувата в клетки либо его образование из лактата путем активации гликолиза, а также предотвращать окислительный стресс, инактивируя активные формы кислорода, т.е. оказывать антиоксидантный и метаболический эффекты одновременно.
В течение длительного времени велись поиски лекарственных препаратов, которые могли бы предотвращать отрицательное действие гипоксии на клетки (цитопротекция) и корректировать нарушения метаболизма. В 1961 г. был запатентован первый антиоксидант в кардиологии – триметазидин: хотя механизм действия этого лекарственного средства длительное время оставался не ясен, его клиническая эффективность дала возможность развиваться новому направлению в терапии. Так в клиническую практику пришли парциальные ингибиторы β-окисления жирных кислот (pFOX – partial fatty acid oxidation inhibitors), повышающие эффективность использования кислорода и переключающие метаболизм миокарда на более экономные пути утилизации глюкозы [5]. А уже в начале 70-х гг. прошлого столетия был синтезирован новый представитель группы парциальных ингибиторов β-окисления жирных кислот – Милдронат® (мельдоний), оказывающий многофакторное действие на все базисные звенья патогенеза ишемического повреждения клеток. Сегодня Милдронат® является одним из наиболее активно применяемых в клинической практике кардиометаболических препаратов.
Механизм действия препарата Милдронат® связан с конкурентным ингибированием фермента гамма-бутиробетаингидроксилазы, который катализирует процесс превращения гамма-бутиробетаина в карнитин [1]. Тем самым Милдронат® ограничивает скорость биосинтеза карнитина из его предшественника гамма-бутиробетаина. Поскольку же карнитин способствует проникновению жирных кислот (ЖК) в клетку, где происходит процесс их β-окисления, то в условиях достаточного поступления кислорода из ЖК образуются макроэргические соединения в виде аденозинтрифосфата (АТФ).
Под влиянием препарата Милдронат® в тканях увеличивается концентрация предшественника карнитина гамма-бутиробетаина и снижается концентрация карнитина, в результате чего в митохондрии поступает меньше длинноцепочечных ЖК (ДЦЖК). Другие парциальные ингибиторы окисления ЖК не способны предотвращать накопление в митохондриях активированных форм ДЦЖК – ацил-КоА и ацилкарнитина, а также предупреждать вредное влияние этих метаболитов на транспорт АТФ и клеточные мембраны [6].
Процессы окисления ЖК и глюкозы связаны между собой и находятся в реципрокной зависимости: если подавляется окисление ЖК, то увеличивается потребление глюкозы. В условиях недостатка кислорода клетке выгоднее использовать окисление глюкозы, чем ЖК, так как для этого процесса необходимо меньшее количество кислорода. Таким образом, Милдронат®, частично замедляя транспорт ЖК, уменьшает их окисление, в результате чего потребность клетки в кислороде уменьшается. Препарат предотвращает накопление токсических промежуточных продуктов обмена веществ (ацилкарнитина и ацил-КоА) и вызванные ими повреждения клеток. Уменьшение скорости окисления ЖК включает альтернативную систему производства энергии – окисление глюкозы, которая на 12% эффективнее использует кислород для синтеза АТФ. И этот механизм также определяет цитопротективное действие препарата Милдронат® на ишемизированные клетки [7, 8]. Препарат стимулирует аэробный гликолиз, что не сопровождается накоплением в тканях лактата, поскольку система пируватдегидрогеназы обеспечивает быстрое дальнейшее окисление глюкозы.
Милдронат® восстанавливает транспорт АТФ к органеллам клетки [7, 9]. Сложные эфиры мельдония и гамма-бутиробетаина являются структуральными аналогами ацетилхолина. Милдронат®, стимулируя рецепторы ацетилхолина, вызывает индукцию эндотелиальной NO-синтазы. В результате увеличивается синтез оксида азота (NO), что приводит к улучшению микроциркуляции и эндотелиальной функции [10].
Таким образом, мультимодальный механизм действия препарата Милдронат® в терапии сердечно-сосудистых (ССЗ) и цереброваскулярных заболеваний (ЦВЗ) способствует адаптации клеточного метаболизма к ишемическим нарушениям, снижению периферического сосудистого сопротивления, улучшению микроциркуляции без «синдрома обкрадывания» и реологических свойств крови, положительному влиянию на углеводный и липидный обмен, а также повышению качества жизни пациентов. Его применение позволяет снизить лекарственную нагрузку на пациента, поскольку Милдронат® обладает целым спектром эффектов, недоступных другим препаратам-цитопротекторам (например, из групп антиоксидантов, антигипоксантов или других pFOX, не обладающих мультимодальным действием) и не воздействует на активность цитохрома Р450 3А4, результатом чего является отсутствие межлекарственного взаимодействия [5].
Возвращаясь к коронавирусной инфекции, следует подчеркнуть, что в зоне риска развития ее тяжелых осложнений находятся в основном пациенты с хроническими ССЗ и ЦВЗ. При этом все последние рекомендации по ведению таких больных в условиях присоединения COVID-19 требуют строгого соблюдения режима применения всех препаратов, стабилизирующих течение кардиоваскулярных заболеваний, в том числе и метаболических цитопротекторов как элемента возможной терапевтической стратегии, предупреждающей развитие декомпенсации ССЗ [11]. В связи с этим целью настоящего исследования стала оценка эффективности применения препарата Милдронат® в комплексной терапии у пациентов с хронической сердечной недостаточностью (ХСН) в сочетании с коронавирусной пневмонией.
МАТЕРИАЛ И МЕТОДЫ
В открытое краткосрочное исследование было отобрано 80 человек, исключено 3 пациента в связи с летальным исходом. В испытуемую (основную) группу вошли 59 человек (35 женщин и 24 мужчины) с пневмонией, вызванной коронавирусной инфекцией, и с патологией сердца, которые получали в качестве метаболической поддержки Милдронат®. Препарат применялся в следующем режиме: раствор для инъекций (0,5 г/5 мл) по 1 г/ сут внутривенно струйно в течение всей госпитализации с последующим переходом на амбулаторный пероральный прием капсул в дозе 500 мг 2 раза/сут сроком до 2 нед.
 Контрольную группу составили 18 аналогичных коморбидных пациентов (12 женщин и 6 мужчин), у которых Милдронат® не применялся.
Контрольную группу составили 18 аналогичных коморбидных пациентов (12 женщин и 6 мужчин), у которых Милдронат® не применялся.
Критериями исключения из исследования служили:
- отказ пациента от дальнейшего участия в исследовании;
- плохая переносимость исследуемого препарата пациентом, требующая прекращения терапии, предусмотренной протоколом;
- появление в ходе исследования любых заболеваний или состояний, которые ухудшают прогноз пациента, а также делают невозможным дальнейшее участие больного в клиническом исследовании;
- в случаях нарушения протокола исследования:
- ошибочное включение пациента, не соответствующего критериям включения и/или соответствующего критерии невключения;
- некомплаентность пациента;
- другие нарушения протокола, которые, по мнению исследователя, являются значительными.
Исследование было выполнено в соответствии с Хельсинской декларацией, принятой в июне 1964 г. и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия). От каждого пациента было получено информированное согласие.
Клиническая характеристика пациентов основной и контрольной групп, принявших участие в исследовании, приведена в таблицах 1 и 2.
У пациентов оценивались уровни С-реактивного белка (СРБ), Д-димера, креатинина, лактатдегидрогеназы в первый день госпитализации и при выписке. Выполнялась оценка длительности госпитализации, динамики симптомов ССЗ по шкале ШОКС, выраженности астении по шкале MFI-20, качества жизни по шкале EQ-5D, удовлетворенности пациентами своим состоянием здоровья в первый, последний день госпитализации и через 3 мес.
Статистическая обработка результатов проводилась в программе Microsoft Excel 2010.
РЕЗУЛЬТАТЫ
При сравнении продолжительности госпитализации в группе препарата Милдронат® срок пребывания пациентов в стационаре составил 11,2±0,6 дня, тогда как в контрольной группе – 16,2±2,7 дня. Таким образом, Милдронат® способствовал снижению длительности госпитализации у пациентов с ССЗ и COVID- 19, осложненной пневмонией: в основной группе данный показатель был на 5 дней меньше, чем в контроле (p <0,01) (рис. 1). Вероятно, это было связано со следующими клиническими фактами, полученными нами в настоящем исследовании.
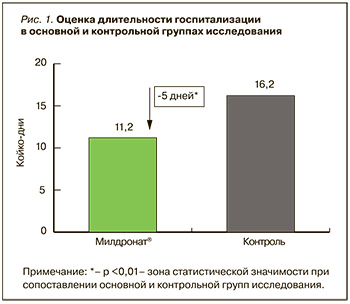 Так, при анализе результатов шкалы оценки клинического состояния больного ХСН (ШОКС) в группе препарата Милдронат® динамика баллов с момента поступления (5±0,15 баллов) до выписки (3,44±0,14 баллов) и через 3 мес составила 2 балла. В контрольной группе на момент поступления аналогичный показатель составлял 5,5±0,34 баллов, при выписке – 4±0,26 баллов, но через 3 мес показатель был равен 5,3±0,44 баллов. Таким образом, через 3 мес в группе препарата Милдронат® клинические проявления ХСН по шкале ШОКС были на 62,2% меньше, чем в контрольной группе (p ≤0,01).
Так, при анализе результатов шкалы оценки клинического состояния больного ХСН (ШОКС) в группе препарата Милдронат® динамика баллов с момента поступления (5±0,15 баллов) до выписки (3,44±0,14 баллов) и через 3 мес составила 2 балла. В контрольной группе на момент поступления аналогичный показатель составлял 5,5±0,34 баллов, при выписке – 4±0,26 баллов, но через 3 мес показатель был равен 5,3±0,44 баллов. Таким образом, через 3 мес в группе препарата Милдронат® клинические проявления ХСН по шкале ШОКС были на 62,2% меньше, чем в контрольной группе (p ≤0,01).
Следует отметить, что в проведенных на сегодня клинических исследованиях у больных ХСН было доказано, что терапия препаратом Милдронат® способствовала повышению сократимости миокарда, увеличению толерантности к физической нагрузке, снижению функционального класса ХСН, а при сочетании с ишемической болезнью сердца (ИБС) – урежению частоты приступов стенокардии, улучшению показателей липидного и углеводного обмена, а также значимому повышению качества жизни пациентов [12–14].
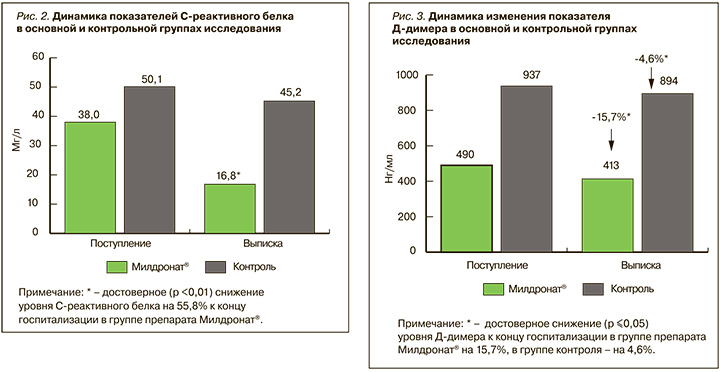
Динамика уровня СРБ представлена на рисунке 2. Нами был выявлен выраженный эффект препарата Милдронат® в плане снижения уровня воспалительного маркера СРБ у пациентов с ССЗ и коронавирусной пневмонией (-55,8% на момент выписки относительно первого дня госпитализации; p ≤0,01), который, возможно, связан сразу с несколькими направлениями действия препарата. С одной стороны, ранее в серии исследований проф. Сергиенко И.В. с соавт. уже было показано протективное действие препарата Милдронат® в дозе 1000 мг/сут у больных ИБС на состояние сосудистого воспаления, эндотелиальной функции и атерогенность липидного спектра, что подтверждалось в том числе достоверным снижением концентрации СРБ через 3 мес от начала терапии [15].
С другой стороны, было показано, что Милдронат® не только положительно влияет на параметры метаболизма, но и может оказывать иммуномодулирующее действие. Так, в ряде исследований препарат проявил свойства активного индуктора интерферона, активировал макрофаги, стимулировал реакцию розеткообразования Т- и В-лимфоцитов, а также оказывал защитное действие против вируса гриппа при его сочетании с профилактической вакциной [16, 17].
Данные свойства препарата Милдронат®, возможно, объясняют его влияние на концентрацию Д-димера, динамика которой в группах исследования представлена на рисунке 3. Известно, что СРБ, интерлейкины, Д-димер, а также другие цитокины и молекулы адгезии служат маркерами процессов воспаления и прокоагуляции, патогенетически связанных как с прогрессированием атеросклероза, так и с течением тяжелых инфекционных процессов. Так, в настоящем исследовании в группе пациентов, принимавших Милдронат®, было отмечено достоверное снижение уровня маркера тромботических осложнений у пациентов с ССЗ и COVID-19 Д-димера на 15,7% (p ≤0,05), а в группе контроля лишь на 4,6% (p ≤0,05). При этом достоверных изменений в уровнях креатинина, лактатдегидрогиназы, протромбинового времени, сывороточного ферритина в группах выявлено не было. Таким образом, можно предположить, что уменьшение уровня указанных маркеров воспаления и прокоагуляции, отмеченное как в настоящем исследовании, так и в предыдущих работах, может расцениваться как положительный эффект комплексного действия препарата Милдронат®, обладающего доказанным антиатеросклеротическим и иммуномодулирующим действием.
Учитывая полученные данные, можно с уверенностью говорить о возможном влиянии препарата Милдронат® на уменьшение сроков госпитализации у пациентов с ХСН и COVID-19, улучшение оценки ими самочувствия по показателям визуально-аналоговой шкалы (ВАШ), опроснику качества жизни и астении.
Так, проведенный нами анализ динамики баллов по ВАШ показал, что в группе пациентов, получавших Милдронат®, показатели удовлетворенности пациентами своим состоянием здоровья на момент госпитализации были выше (0,6±0,01 см) по сравнению с контрольной группой (0,44±0,22 см). Через 3 мес в группе препарата Милдронат® результат по шкале ВАШ составил 0,7±0,02 см, что было на 0,2 балла достоверно выше, чем в контроле (0,5±0,03 см; p ≤0,01) (рис. 4). Это говорит о хорошем пролонгированном эффекте препарата.
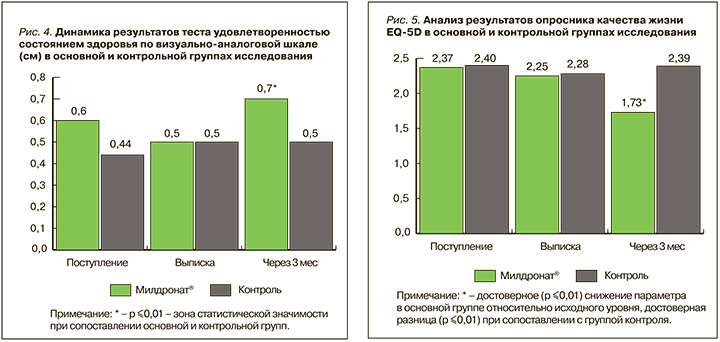
Схожий результат был получен при оценке показателей качества жизни. Через 3 мес в группе препарата Милдронат® отмечалось значительное достоверное улучшение этого параметра по опроснику EQ-5D: -0,64 балла относительно исходного уровня (p ≤0,01). Этот результат был на 0,66 баллов достоверно ниже, чем в контрольной группе (p ≤0,01), где через 3 мес значения опросника вернулись к значениям до госпитализации (рис. 5).
Результаты теста удовлетворенности пациентами состоянием своего здоровья и качеством жизни особенно ярко демонстрируют преимущество терапии с применением препарата Милдронат® через 3 мес от ее начала. Они свидетельствуют о значимом влиянии такой лечебной стратегии как на субъективные показатели самочувствия (ВАШ, показатель качества жизни), так и на объективно оцениваемые параметры сердечно-сосудистой системы в динамике. Так, в группе препарата Милдронат® проявления ХСН по шкале ШОКС снизились с 5 баллов на момент поступления до 1,73 баллов через 3 мес терапии. В контрольной группе на момент поступления соответствующий показатель был равен 5,5 баллов, и, хотя снизился к моменту выписки до 4, через 3 мес составил 5,3 баллов (рис. 6). Таким образом, через 3 мес в основной группе исследования клинические проявления ХСН по шкале ШОКС были достоверно меньше на 62,2%, чем в контроле (p ≤0,01).
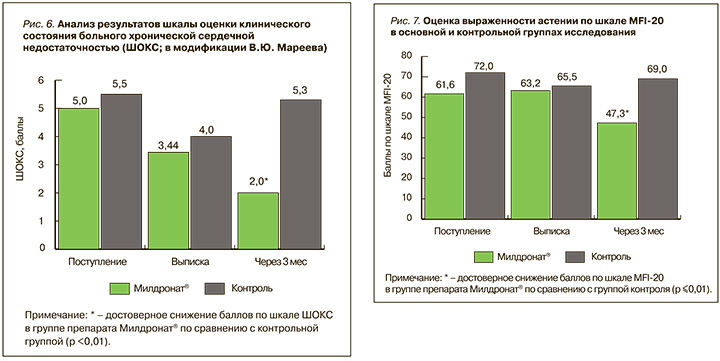
Оценка астении в группе пациентов, получавших Милдронат®, выявила следующую динамику их состояния: при поступлении результаты по шкале MFI-20 составили 61,6±1,8, при выписке – 63,2±1,4, через 3 мес – 47,3±2 баллов. В контрольной группе аналогичные показатели были равны 72±3,6; 63,2±2,77 и 69±3,47 баллам соответвенно. Таким образом, в группе препарата Милдронат® через 3 мес терапии проявления астении были значительно (на 21,7 баллов) и достоверно ниже, чем в контрольной группе (p ≤0,01) (рис. 7).
Полученные нами результаты необходимо также рассмотреть в тесной связи с вопросами этиопатогенетического лечения синдрома постинфекционной астении. Эта проблема и ранее обсуждалась в контексте сезонного роста заболеваемости острыми респираторными инфекциями, но стала особенно актуальной в связи с началом пандемии новой коронавирусной инфекции [18]. Поскольку наиболее частыми осложнениями COVID- 19 становятся обострения и декомпенсация имеющихся хронических ССЗ и ЦВЗ, развитие пневмонии, полиорганной недостаточности, а уже после выздоровления – появление тяжелой постинфекционной астении, можно считать, что момент выбора препарата метаболической цитопротекции, обладающего противоастенической активностью, будет определяющим для дальнейшей тактики ведения пациента не только в стационаре, но и в течение всего дальнейшего периода восстановления после перенесенной инфекции [19]. Учитывая, что в патогенезе астенических расстройств ведущую роль играет энергетический дисбаланс, который развивается вследствие патологического процесса, связанного с ишемией, гипоксией или инфекционной интоксикацией, логично предположить, что эффективная терапия должна быть ориентирована на компенсацию большинства из возникших нарушений. Таким образом, применение препарата Милдронат® у пациентов с хроническими ССЗ и присоединившейся коронавируной инфекцией можно считать оптимальной терапевтической стратегией, влияющей не только на улучшение показателей сердечно-сосудистой системы, но и параметры самочувствия в сочетании с профилактикой постинфекционных осложнений.
ЗАКЛЮЧЕНИЕ
Результаты представленного исследования свидетельствуют прежде всего о повышении эффективности терапии больных ХСН в сочетании с COVID-19, осложнившейся пневмонией, на фоне добавления к базовому лечению препарата Милдронат® в дозе 1000 мг/сут. Полученные данные согласуются с выводами ранее проведенных исследований. Вместе с тем в настоящей работе впервые было показано комплексное влияние препарата Милдронат® в плане улучшения не только параметров метаболизма, системы гемостаза, клинических проявлений ХСН, но и уменьшения выраженности симптомов, связанных в первую очередь с тяжелой постинфекционной астенией, которая является своего рода «визитной карточкой» коронавирусной инфекции.



