ВВЕДЕНИЕ
В развитых странах примерно 1–2% взрослого населения страдает хронической сердечной недостаточностью (ХСН), около 50% случаев которого приходится на ХСН с низкой фракцией выброса (ХСНнФВ). В России отмечается более высокая распространенность ХСН, составляющая в общей популяции 7%, а средняя годовая смертность среди больных ХСН с клинически выраженной симптоматикой достигает 12% [1, 2].
В последние два десятилетия существенно изменились подходы к лечению пациентов с ХСНнФВ: разработан алгоритм ведения больных, определены основные классы лекарственных средств для оптимальной медикаментозной терапии, уточнены показания к электрофизиологическим методам, таким как сердечная ресинхронизирующая терапия (СРТ), имплантация кардиовертеров-дефибрилляторов (ИКД), интервенционное лечение аритмий, применяемым в дополнение к фармакотерапии [1, 3].
Представляем описание клинического примера успешного ведения больного ХСНнФВ, лечение которого проводилось с применением современных возможностей медикаментозной терапии и интервенционных кардиохирургических вмешательств.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент Л., 1961 г.р., наблюдается в клинике «Медицина» с 2018 г. Из анамнеза известно, что в 1999 г. в возрасте 38 лет на фоне ожирения, артериальной гипертензии и сахарного диабета 2-го типа больной перенес инфаркт миокарда с развитием полной блокады левой ножки пучка Гиса и аневризмы передней стенки левого желудочка (ЛЖ). В 2000 г. у него была выявлена проксимальная окклюзия передней межжелудочковой артерии и выполнена резекция аневризмы ЛЖ. В последующие 10 лет пациент не отмечал симптомов со стороны сердечно-сосудистой системы. Принимал гипотензивную, сахароснижающую терапию, также под наблюдением диетолога пациенту проводилось снижение массы тела с временным эффектом.
В 2011 г. у больного впервые появились клинические проявления сердечной недостаточности (одышка и снижение переносимости физической нагрузки), зарегистрирована постоянная форма фибрилляции предсердий (ФП). В последующие годы симптомы прогрессировали, и больной неоднократно проходил стационарное лечение в связи с декомпенсацией ХСН с кратковременным улучшением.
В 2018 г. при обследовании в клинике АО «Медицина» у пациента при осмотре были выявлены ожирение 2-й степени (индекс массы тела 38 кг/ м2), цианоз губ, частота дыхания 20/мин, жесткое дыхание в легких, аритмичный пульс 58 уд/ мин, артериальное давление 130/80 мм рт. ст., асцит, увеличение печени, отеки голеней.
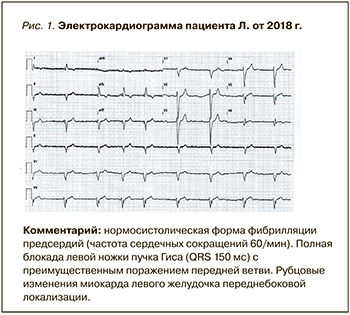
На электрокардиограмме (ЭКГ) были зарегистрированы нормосистолическая ФП со средней частотой сердечных сокращений (ЧСС) около 60/ мин, полная блокада левой ножки пучка Гиса (QRS 150 мс) с преимущественным поражением передней ветви, рубцовые изменения миокарда ЛЖ переднебоковой локализации (рис. 1).
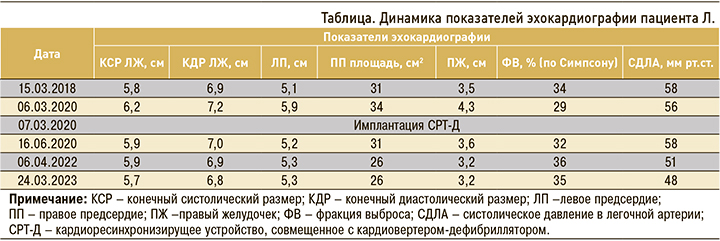
При эхокардиографии (табл.) были выявлены умеренная (2-й степени) относительная митральная и трикуспидальная недостаточность, значительная дилатация всех камер сердца: левое предсердие (ЛП) – 5,1 см; ЛЖ: конечный диастолический размер (КДР) – 7,0 см, конечный систолический размер (КСР) – 6,0 см; правое предсердие (площадь) – 31 см2; правый желудочек (ПЖ) – 3,5 см. Нижняя полая вена не коллабирует. Глобальная сократимость миокарда резко снижена (ФВ 34%). Локальная сократимость миокарда нарушена: акинез межжелудочковой перегородки и апикальных сегментов, гипокинез передних средних сегментов. Имелись признаки легочной гипертензии (систолическое давление в легочной артерии 60 мм рт.ст.), следы жидкости в перикарде.
При Холтеровском мониторировании ЭКГ (ХМ ЭКГ) была зарегистрирована постоянная форма нормосистолической ФП (средняя частота сердечных сокращений 67 уд/мин), редкая желудочковая экстрасистолия (166 за сутки), 263 эпизода асистолии свыше 2 с. (максимальный интервал R–R 2,9 с).
При проведении ультразвукового исследования (УЗИ) брюшной полости выявлены признаки асцита, выраженной гепатомегалии, диффузных изменений печени по типу жирового гепатоза.
Таким образом, в связи с резистентной, не поддающейся лечению традиционной фармакологической терапией на протяжении длительного периода времени СН III функционального класса по NYHA, а также в виду наличия морфофункциональных критериев, обнаруженных по результатам обследования пациента (низкая фракция выброса ЛЖ <35%, полная блокада левой ножки пучка Гиса, QRS=150 мс, нормосистолическая форма постоянной ФП), были определены показания 1 класса к проведению сердечной ресинхронизирующей терапии (СРТ). Однако в данную госпитализацию больной отказался от СРТ и продолжил скорригированную медикаментозную терапию ингибиторами АПФ, бета-блокаторами, сердечными гликозидами, петлевыми диуретиками, антагонистами минералокортикоидных рецепторов, антикоагулянтами, статинами, сахароснижающими препаратами – агонистами рецепторов глюкагоноподобного пептида-1 (аГПП-1).
Первый этап интервенционного лечения – имплантация кардиоресинхронизирущего устройства, совмещенного с кардиовертером-дефибриллятором (СРТ-Д), для лечения ХСН и первичной профилактики внезапной сердечной смерти (ВСС)
После выписки из стационара проведение лекарственной терапии на амбулаторном этапе продолжало оставаться малоэффективным. За период 1,5 лет больной 3 раза находился на стационарном лечении с декомпенсацией ХСН. В марте 2020 г. при эхокардиографии (ЭхоКГ) было отмечено дальнейшее расширение всех полостей сердца со снижением ФВ до 29% (см. табл.).
Наконец, в марте 2020 г. после получения согласия пациенту была проведена имплантация СРТ-Д с целью коррекции рефрактерной ХСН и профилактики ВСС. Дополнительно к проводимой терапии был добавлен амиодарон.
В течение последующих 3 мес пациент отмечал уменьшение слабости и одышки, улучшение переносимости физической нагрузки, что свидетельствовало об уменьшении функционального ХСН до второго. На ЭхоКГ в этот же период (16.06.2020) наблюдалась положительная динамика в виде уменьшения размеров левых и правых отделов сердца (см. табл.). Однако субъективно больной стал отмечать появление перебоев в области сердца, сопровождавшихся головокружением, общей слабостью, гипотензией; однократно наблюдался синкопальный эпизод. При ХМ ЭКГ была зарегистрирована мономорфная желудочковая тахикардия (ЖТ № 1; рис. 2).
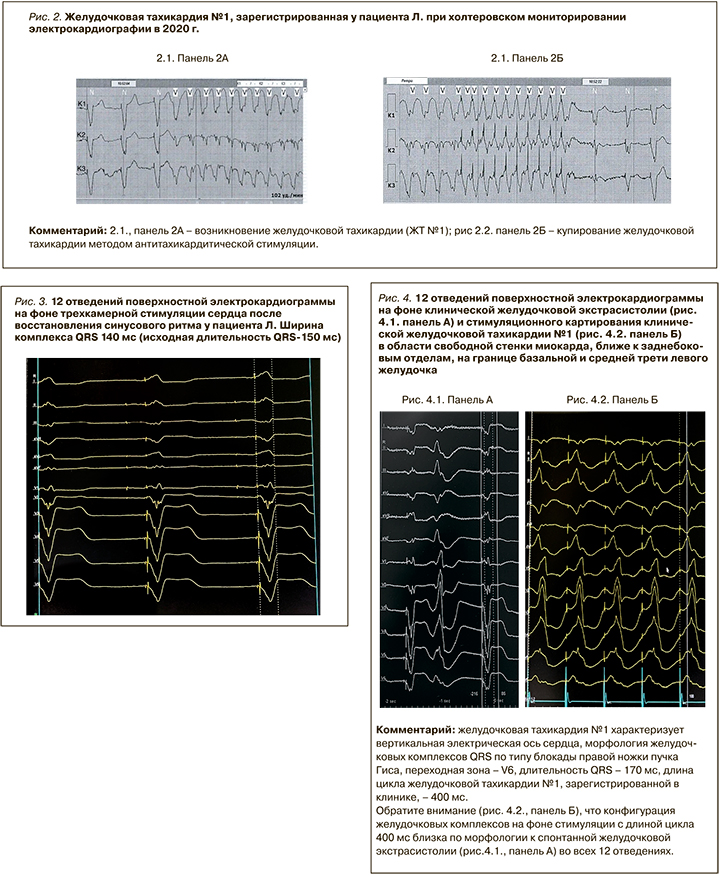
При экстренном тестировании имплантированного устройства было выявлено 83 эпизода ЖТ с длиной цикла 400 мс, соответствующих по длине цикла (ДЦ) ЖТ, зарегистрированной при ХМ ЭКГ. В 68 из 83 эпизодов ЖТ № 1 была купирована антитахикардитической стимуляцией (АТС), в 15 случаях – шоковым разрядом имплантированного кардиовертера-дефибриллятора (ИКД). При одном из эпизодов ЖТ срабатывание кардиовертера-дефибриллятора (на фоне насыщения пациента амиодароном) привело к купированию как ЖТ, так и к восстановлению синусового ритма в предсердиях (прекращение ФП) на непродолжительный срок (несколько суток; рис. 3).
Таким образом, на фоне коррекции явлений СН и улучшения функционального класса ХСН на первый план в клинике у пациента драматично вышел аритмический синдром, связанный с рецидивированием ишемической (постинфарктной) устойчивой ЖТ. Адекватное программирование параметров как АТС, так и КВ (шоковой кардиоверсии) с СРТ-Д позволило обеспечить эффективный контроль над ЖТ и предотвратить ВСС.
Второй этап интервенционного лечения – радиочастотная катетерная абляция ЖТ № 1
После дообследования пациента и исключения потенциально корригируемого характера аритмического синдрома (дестабилизация течения ишемической болезни сердца, дисфункции щитовидной железы, скрытый миокардит) в июне 2020 г. пациенту была проведена РЧА ЖТ № 1 (рис. 4). Следует отметить, что в ходе эндокардиального электрофизиологического исследования (эндоЭФИ) нам не удалось индуцировать клиническую ЖТ, что, вероятно, могло быть обусловлено хорошим эффектом на фоне продолжающегося приема амиодарона. Тем не менее нами была выполнена РЧА субстрата клинической ЖТ (ЖТ № 1) на основании данных сравнения морфологии желудочковых комплексов ЖТ № 1 в 12 отведениях поверхностной ЭКГ на фоне спонтанной клинической ЖТ с результатами стимуляционного и субстратного 3-D эндокардиального картирования.
Третий этап интервенционного лечения – РЧА хронической формы ФП
Согласно современным рекомендация по лечению ФП [4], проведение РЧА при этом заболевании относится к показаниям 2А класса. Однако, у пациентов с выраженной ХСН со сниженной сократительной функцией миокарда ЛЖ стратегия поддержания синусового ритма предпочтительна и ассоциируется со снижением общей смертности [5]. В связи с этим в июле 2020 г. пациенту была предложена и после получения согласия выполнена РЧА хронической ФП (рис. 5).

Четвертый этап интервенционного лечения – РЧА желудочковой тахикардии (№ 2 и 3)
Вплоть до ноября 2020 г. по данным амбулаторного динамического наблюдения и результатам тестирования имплантированного устройства ЖТ у пациента не рецидивировала, сохранялся стойкий синусовый ритм (СР).
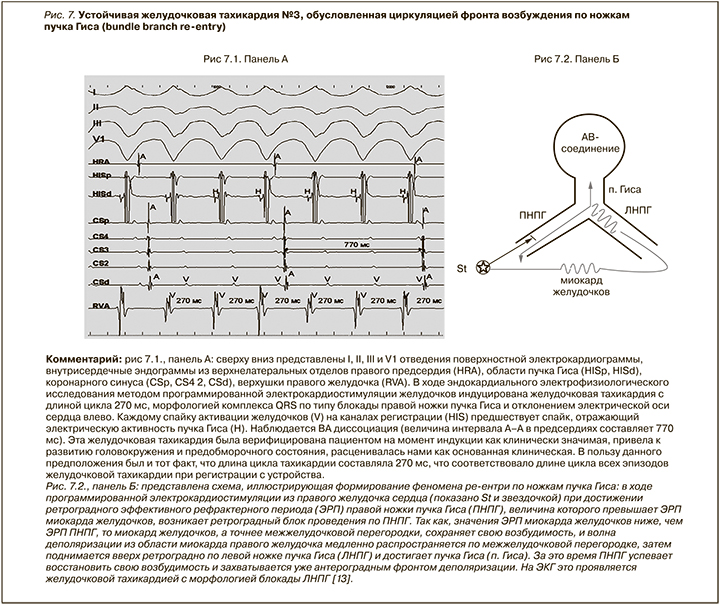
В ноябре 2020 г. пациент отметил частое шоковое срабатывание устройства. При тестировании устройства было выявлено 20 эпизодов ЖТ, различные по длине цикла: ЖТ № 2 с ДЦ 480 мс и с ДЦ 270 мс (ЖТ № 3), которые были купированы АТС (в 15 случаях) и шоковыми разрядами с устройства (в 5 случаях). Больному повторно было предложено и после получения согласия проведено эндоЭФИ, в ходе которого были выявлены желудочковые тахикардии двух морфологических классов, отличные от ЖТ № 1. Одна из них была непродолжительной (до 30 с), пациент ее субъективно не узнавал, она была субстратно-обусловлена циркуляцией цикла re-entry по периметру послеоперационного рубца ранее проведенной аневризмэктомии от 2011 г. (ЖТ № 2 с ДЦ 480 мс; рис. 6), которая ранее не выявлялась ни по данным интеррогации устройства, ни при регистрации ЭКГ или ХМ ЭКГ. Третья ЖТ – re-entry BBBR-ЖТ с вовлечением в цикл циркуляции импульса ножек пучка Гиса (т.н. Bundle Branch re-entry) (ЖТ № 3 с ДЦ 270 мс) – являлась клинически доминирующей, так как была устойчивой, приводила к воспроизведению клинической симптоматики на операционном столе (рис. 7). Пациенту была проведена успешная РЧА ЖТ № 2, а при попытке РЧА ЖТ № 3 в области правой ножки пучка Гиса произошла трансформация ЖТ № 3 в фибрилляцию желудочков, которая была купирована управляемым нами шоковым разрядом с имплантированного устройства.
В течение последующих 2,5 лет наблюдения у пациента отсутствовали эпизоды устойчивой ЖТ, сохранялся синусовый ритм, он не госпитализировался.
К весне 2022 г. самочувствие пациента значительно улучшилось и соответствовало функциональному классу 1–2 по NYHA: значительно уменьшилась одышка, улучшилась переносимость физических нагрузок. Пациент не отмечал ни головокружений, ни синкопальных состояний, не было эпизодов ни срабатывания устройства, ни шоковых разрядов СРТ-Д, лекарственную терапию принимал регулярно. Под наблюдением эндокринолога пациент соблюдал диету, продолжал принимать антидиабетические препараты (аГПП-1 с последующей заменой на ингибитор натрий-зависимого котранспортера глюкозы 2-го типа дапаглифлозин). Индекс массы тела снизился с 38 до 33 кг/м2, гликированный Hb в динамике не превышал 7,5%.
В апреле 2022 г. было проведено плановое обследование больного. При тестировании СРТ-Д был отмечен 100% уровень бивентрикулярной стимуляции в режиме DDDR. Эпизоды ФП, ЖТ не регистрировались. При проведении ЭхоКГ ФВ составляла 34–36%, систолическое давление в легочной артерии – 51 мм рт.ст. У пациента сохранялись признаки ХСН II функционального класса.
К моменту написания статьи (март 2023 г.) пациент продолжает наблюдаться в клинике. Его состояние стабильное, нарушений ритма не отмечает. Показаний для госпитализации нет. По данным ЭхоКГ (24.03.2023), ФВ составляет 35%, систолическое давление в легочной артерии – 48 мм рт. ст. (см. табл.).
ОБСУЖДЕНИЕ
Главные задачи в лечении пациентов с ХСН – улучшение прогноза жизни пациента, уменьшение симптоматики заболевания, снижение количества госпитализаций и связанное с этим улучшение качества жизни. В настоящее время определены лекарственные препараты, снижающие смертность и число госпитализаций, которые составляют основу оптимальной медикаментозной терапии при ХСНнФВ: ингибиторы АПФ/антагонисты рецепторов ангиотензина II/валсартан + сакубитрил, бета-адреноблокаторы, антагонисты альдостерона [1]. Также в последнее время доказано положительное влияние на прогноз ингибиторов натрий-глюкозного ко-транспортера 2-го типа – глифлозинов [6, 7]. При этом, однако, не всегда удается добиться желаемых результатов только с помощью лекарственных средств. Представленный вашему вниманию больной длительное время получал оптимальную фармакотерапию, но, очевидно, ее клиническая эффективность оставалась недостаточной. В связи с этим нами было принято решение дополнить медикаментозное лечение электрофизиологическими методами.
При ХСНнФВ происходит электрическая и механическая десинхронизация в работе сердца, что, в частности, отражается на ЭКГ нарушениями внутрижелудочковой проводимости. В конечном итоге это приводит к блокадам проведения по системе Гиса-Пуркинье, зачастую по системе левой ножке пучка Гиса (ЛНПГ), что сопровождается увеличением ширины комплекса QRS. Имплантирование устройств CРТ служит методом устранения сердечной десинхронизации путем нормализации внутрисердечного (как внутрижелудочкового, так и межжелудочкового) проведения, а при возможности сохранить синусовый ритм таким пациентам удается наладить и предсердно-желудочковую ресинхронизацию. Опыт применения СРТ у пациентов с СНнФВ демонстрирует улучшение целого ряда морфофункциональных характеристик работы сердца, уменьшает симптомы СН, улучшает их самочувствие, повышает качество жизни, а также снижает морбидность и смертность при соблюдении правильного отбора больных [8].
У нашего пациента имелись показания для проведения СРТ 1-го класса, а после имплантации СРТ-Д-устройства достаточно быстро было достигнуто улучшение самочувствия и уменьшение симптоматики ХСН до уровня 2 функционального класса по NYHA и, как следствие, стабилизация общего состояния.
Следует отметить, что эффективность СРТ зависит от многих факторов. Один из важнейших среди них – обеспечение стойкой бивентрикулярной стимуляции (выше 90–95% работы сердца), что относительно легко достигается на фоне пульс-урежающей терапии при синусовом ритме. У пациентов с ФП высокий процент бивентрикулярной стимуляции при СРТ достигается значительно сложнее, но такое возможно либо в случаях жесткого контроля ЧСС при катетерной деструкции АВ-соединения, либо на фоне восстановления и поддержания синусового ритма и путем контроля атриовентрикулярного проведения медикаментозными методами [3]. После непродолжительного эпизода восстановления синусового ритма (при насыщении амиодароном) на фоне кардиоверсии устройства по поводу ЖТ № 1, для нас стала очевидной возможность его стойкого возврата на синусовый ритм. Нами было выполнено дополнительное инвазивное вмешательство (РЧА ФП) для дальнейшего сохранения ритма и обеспечения более эффективной работы имплантированного устройства.
Таким образом, мы использовали все доступные нам ресурсы из перечня комбинированного лечения как с использованием медикаментозных, так и интервенционных методов.
После клинического улучшения и уменьшения функционального класса ХСН на фоне постоянной кардиоресинхронизирующей стимуляции на первый план вышли проблемы, связанные с актуализацией аритмического синдрома ввиду часто рецидивирующей ЖТ № 1, для купирования которой понадобились в том числе шоковые разряды с устройства. Подобный сценарий течения заболевания согласуется с известными представлениями о том, что пациенты с терминальной ХСН чаще всего погибают на фоне прогрессирования ХСН, в то время как желудочковые аритмии чаще становятся причиной смерти пациентов со 2–3 функциональным классом ХСН по NYHA [9]. Фактически улучшение проявлений СН у нашего пациента предсказуемо привело к трансформации варианта клинического течения заболевания на «аритмический», к чему мы были готовы, исходно отдавая себе отчет в том, что имплантируем устройство такого класса терминальному пациенту с СН.
По литературным данным, подобные, зачастую фатальные для пациентов желудочковые нарушения ритма носят название «электрический шторм». Согласно общепринятому определению, это 3 и более эпизодов ЖТ и/или фибрилляции желудочков, регистрируемых у больного за период 24 ч, верифицированных любым доступным методом. Такого рода события возникают у 10–20% пациентов с ранее имплантированными ИКД. При этом известно, что только 20% шоковых разрядов являются адекватными и в полной мере выполняют спасительную функцию для жизни пациента, а остальные – неадекватными [10]. Возникновение неадекватных/неэффективных срабатываний связано с возможными ошибками в распознавании аритмии, а также ввиду неоправданных срабатываний при нежизнеугрожающих нарушениях ритма сердца, таких как любые суправентрикулярные тахикардии (прежде всего ФП), и на фоне коротких/непродолжительных (до 30 с) эпизодов ЖТ [11]. Неоднократные шоковые разряды зачастую вызывают не только снижение качества жизни пациента, вплоть до развития депрессивных состояний, но и дальнейшее прогрессирование ХСН вследствие развития повреждения кардиомиоцитов по типу электропорации; в конечном счете это обусловливает худшие характеристики выживаемости у таких пациентов вопреки проводимому дорогостоящему лечению и увеличивает их смертность [11–13]. Уже первый подобный эпизод является прогностически неблагоприятным для жизни больного и требует жесткого контроля над аритмией всеми доступными средствами, в том числе и методом РЧА ЖТ по 2А классу показаний.
Для снижения риска подобных событий, уменьшения оправданных эпизодов срабатывания устройства и сокращения количества шоковых разрядов в особенности, применяют лекарственную антиаритмическую терапию и/или РЧА желудочковых нарушений ритма. Кроме этого, понимание и последующая верификация природы желудочковой аритмии (в нашем случае – re-entry) возможна зачастую только по результатам эндоЭФИ. Такой подход позволил нам умело использовать различные режимы АТС, что, в свою очередь, будет способствовать большей продолжительности «жизни» батареи устройства и сделает практически незаметными для пациента эпизоды срабатывания устройства в режиме АТС.
Трансформация характера течения желудочковых нарушений ритма, а именно появление ЖТ № 2 и клинически ведущей ЖТ № 3 с циркуляцией импульса по ножкам пучка Гиса (см. рис 7, панель Б), скорее, закономерно у пациента с кардиомегалией. Как известно, впервые в истории ВВВR была описана группой Akhtar M. у пациентов с дилатационной кардиомиопатией (ДКМП) [14]. На протяжении длительного времени BBBR считалась патогномоничной для таких больных, обусловливая озлокачествление течения ДКМП и их гибель на фоне высокоскоростной ЖТ. Следует отметить, что своевременная грамотная эндокардиальная диагностика такой аритмии позволила нам взять и ее под контроль, выполнив относительно несложную эндокардиальную РЧ-деструкцию ПНПГ. Ход процедуры осложнился трансформацией в фибрилляцию желудочков на фоне РЧ-воздействия, что потребовало шокового разряда с имплантируемого устройства (т.е. эндокардиальной кардиоверсии) мощностью 30 Дж в виду неэффективности предшествующих наружных попыток мощностью до 350 Дж у пациента с индексом массы тела 37 кг/м2.
Последующий продолжительный период наблюдения за пациентом доказал правильность нашей тактики комбинированного, комплексного, в том числе и неотложного подхода к лечению объективно крайне тяжелого для курации пациента с терминальной СНнФВ.
ЗАКЛЮЧЕНИЕ
В представленном клиническом случае ведения пациента с тяжелой, рефрактерной к медикаментозной терапии СНнФВ была достигнута стабилизации состояния, произошло улучшение качества жизни, значительно уменьшились проявления СН и сократилось количество госпитализаций до минимума.
Успех был достигнут за счет дополнения медикаментозной терапии имплантацией СРТ-Д-устройства и проведения трех сессий РЧА по поводу двух ведущих в разное время и разных по своей природе ЖТ и обеспечения стойкого контроля за синусовым ритмом методом РЧА длительно персистирующей/хронической ФП. После установки имплантируемого устройства удалось добиться его эффективной работы, обеспечив высокий процент бивентрикулярной стимуляции, а также безотлагательно (дважды в разные периоды времени) решить проблему возникшего электрического шторма.
Положительный клинический результат был достигнут благодаря применению современных подходов, включающих совместную работу мультидисциплинарной команды специалистов, оптимальную медикаментозную терапию в комбинации с интервенционными аритмологическими методами лечения.



