Обструктивные нарушения дыхания во сне (ОНДС) – важная проблема современного здравоохранения: ими страдают около 5–10 % мужчин в популяции [1]. Существующие данные литературы о влиянии ОНДС на процессы перекисного окисления липидов (ПОЛ) и активность факторов антиоксидантной защиты противоречивы. Согласно одним сведениям, у пациентов с ОНДС наблюдается уменьшение генерации активных форм кислорода лейкоцитами, а также увеличение уровня малонового диальдегида (МДА), свидетельствующее об активации процессов ПОЛ [2]. В других исследованиях обнаружено отсутствие различий в уровне активности процессов ПОЛ и общей антиоксидантной способности между пациентами с ОНДС и контрольной группой [3]; также в этих исследованиях установлено, что интенсивность процессов ПОЛ у больных с ОНДС связана не со степенью тяжести этого состояния, а с сопутствующим ожирением и курением [4]. В связи с этим представляет интерес уточнение характера изменений активности процессов ПОЛ при ОНДС.
Цель исследования – выявить особенности изменения интенсивности процессов ПОЛ и активности факторов антиоксидантной защиты при различной степени тяжести ОНДС.
МАТЕРИАЛ И МЕТОДЫ
Исследование одобрено Локальным этическим комитетом ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России.
Критерии включения: мужской пол, возраст 30–69 лет, наличие ОНДС, информированное добровольное согласие пациента на участие в исследовании.
Критерии исключения: заболевания, приводящие к активации процессов ПОЛ, отказ от участия в исследовании.
Согласно критериям включения были обследованы 48 пациентов с жалобами на храп и избыточную дневную сонливость. По результатам кардиореспираторного мониторинга обследуемые были разделены на 4 группы:
- 1-я (контрольная) группа – 16 пациентов без ОНДС;
- 2-я группа – 16 пациентов с ОНДС легкой степени;
- 3-я группа – 8 пациентов с ОНДС средней степени;
- 4-я группа – 8 пациентов с ОНДС тяжелой степени.
Средний возраст в 1-й группе был равен 52,0 (39,5; 60,25) годам, во 2-й – 57,5 (54,0; 60,0), в 3-й – 57,0 (54,75; 59,0), в 4-й – 53,5 (50,75; 57,0). Достоверных различий между группами выявлено не было (р=0,523).
Диагноз ОНДС устанавливался согласно The International Classification of Sleep Disorders, Third Edition, 2014. Степень тяжести ОНДС определялась по индексу апноэ/гипопноэ (ИАГ): легкая степень – 5–15 событий в час (соб./ч), средняя степень – 15–30 соб./ч, тяжелая степень – более 30 соб./ч.
Кардиореспираторный мониторинг проводился по стандартной методике с помощью скриннинговой системы ApneaLink (ResMed, Германия) с регистрацией следующих показателей: величина носового потока, сатурация кислорода крови (SpO2), частота пульса.
Состояние процессов ПОЛ оценивали по содержанию диеновых конъюгат (ДК) в плазме на основе классического метода Placer Z. [5] и по уровню МДА [6], состояние антиоксидантной защиты – по изменению активности супероксиддисмутазы (СОД) [7] и каталазы (КАТ) [8] эритроцитов. Забор крови для исследования осуществлялся утром после проведения кардиореспираторного мониторинга.
Данные, полученные в результате исследования, были обработаны с помощью программного комплекса Statistica 10 с использованием непараметрических методов статистики. Данные представлены в виде Me (Q1; Q3). Для оценки межгрупповых различий значений признаков применяли H-критерий Краскелла–Уоллиса. Анализ зависимости между признаками осуществлялся путем вычисления коэффициента корреляции Спирмена (r). Данные считали достоверными при уровне значимости р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Показатели, полученные при проведении кардиореспираторного мониторинга, представлены в таблице. Во всех группах показатели SpO2, зарегистрированной во время бодрствования (Bas SpO2), находились в пределах референсных значений и достоверно не различались. Значения минимальной SpO2 (Min SpO2) во время сна у пациентов 2-й и 3-й групп достоверно не различались между собой и значениями у пациентов контрольной группы. В то же время у пациентов 4-й группы Min SpO2 была ниже, чем в контрольной группе и 2-й группе на 11,9 (p<0,001) и на 8,8% (p=0,002) соответственно. В контрольной группе показатели степени снижения SpO2 (∆SpO2) были наименьшими.
Следует отметить, что по мере увеличения ИАГ этот показатель увеличивался, достигая наибольших значений у пациентов 4-й группы. Анализ достоверности различий между обследованными группами позволил заключить, что показатель ∆SpO2 в 4-й группе был выше на 86,9%, чем в контрольной группе (p=0,0001), и на 66,6%, чем во 2-й группе (p=0,002), однако различия значений ∆SpO2 контрольной, 2-й и 3-й групп не достоверны.
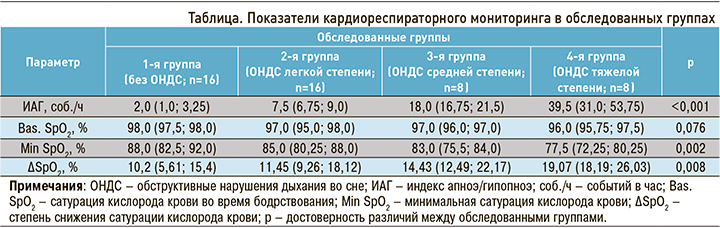
Изменение концентрации продуктов ПОЛ в зависимости от степени ОНДС представлено на рисунке 1. Концентрация ДК достоверно не различалась в обследованных группах. Увеличение ИАГ сопровождалось ростом концентрации МДА. У пациентов 3-й группы ее значения были на 25,1% выше, чем у пациентов контрольной группы (p=0,007), и на 48,4% выше по сравнению со 2-й группой (p=0,005). У пациентов 4-й группы значения этого показателя, по сравнению с контрольной и 2-й группами, были выше на 45,5 (p=0,004) и 72,5% (p=0,003) соответственно.
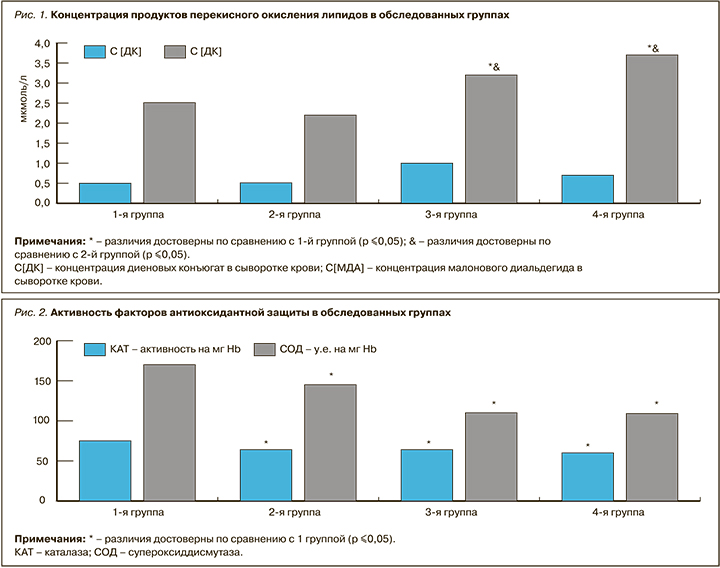
Анализ активности факторов системы антиоксидантной защиты позволил выявить следующие особенности (рис. 2). В контрольной группе наблюдались максимальные значения активности СОД и КАТ в сыворотке крови. По мере увеличения степени тяжести ОНДС происходило снижение активности факторов антиоксидантной защиты. Так, во 2-й группе по сравнению с контрольной активность КАТ и СОД была достоверно ниже на 13,6 и 13,5% соответственно, в 3-й группе – на 14,7 и 33,7% соответственно, в 4-й группе – на 19,4 и 35,9% соответственно.
Увеличение концентрации МДА свидетельствует об активации ПОЛ [2]. При этом следует отметить, что интенсивность процессов ПОЛ увеличивалась при нарастании степени тяжести дыхательных расстройств в течение ночи. Полученные в настоящем исследовании данные согласуются с результатами других исследователей, установивших, что уровень окислительного стресса зависит от степени ночной гипоксемии [9, 10, 11], гиперкапнии и тяжести ОНДС [2].
Сравнение полученных данных концентрации продуктов ПОЛ и активности факторов системы антиоксидантной защиты позволяет выявить следующие закономерности: у пациентов с ОНДС легкой степени наблюдается тенденция к снижению концентрации МДА на фоне уменьшения активности факторов антиоксидантной защиты по сравнению с пациентами без ОНДС. Однако по мере нарастания степени тяжести ОНДС наблюдается прогрессирующее увеличение концентрации МДА на фоне уменьшения активности факторов системы антиоксидантной защиты. Согласно данным литературы, полученные результаты можно объяснить возникновением адаптации к гипоксии у пациентов с ОНДС легкой степени с последующим развитием дезадаптации к прогрессирующей ночной гипоксемии [12].
ЗАКЛЮЧЕНИЕ
- Нарастающая по мере прогрессирования ОНДС гипоксия приводит к увеличению активности процессов ПОЛ за счет увеличения концентрации МДА в сыворотке крови, а также к снижению активности таких факторов антиоксидантной защиты, СОД и КАТ.
- Проведение индивидуальных лечебных мероприятий, направленных на предотвращение развития эпизодов остановок дыхания во сне и гипоксемии, могут приводить к нормализации процессов ПОЛ и системы антиоксидантной защиты.



