Helicobacter pylori (НР) – наиболее распространенная бактериальная инфекция человека, приводящая к развитию хронического активного гастрита различной тяжести у всех инфицированных лиц. Во всех руководствах последних лет признается, что хеликобактерная инфекция является этиологическим фактором развития хронического гастрита, а сам гастрит – инфекционным заболеванием [1–3]. В дальнейшем хронический поверхностный гастрит, ассоциированный с НР, способен прогрессировать в более тяжелые формы, включая атрофическую, увеличивающую риск рака желудка (РЖ).
В 2018 г. в мире зарегистрировано 1 000 000 новых случаев и 783 000 смертей от новообразований желудка. По-прежнему эта опухоль остается третьей ведущей причиной смерти от онкологических заболеваний у обоих полов во всем мире [4]. В России проблема РЖ также остается актуальной. Анализ распространенности онкологических заболеваний в России за 10 лет (с 2008 по 2018 г.) свидетельствует, что РЖ составляет 93,3–95,1 случаев на 100 000 населения, а летальность в течение года с момента установления диагноза из числа больных, впервые взятых на учет в предыдущем году, составляет 47,4–54,1% [5]. В качестве ведущего этиологического фактора в развитии РЖ признана инфекция НР (уровень доказательности (УДД) – 1а, степень рекомендации (СР) – А) [1, 2, 3].
В формировании нашего понимания о НР-индуцированном канцерогенезе желудка ведущая роль принадлежит трем патологоанатомам. Рудольф Вирхов показал возникновение любого рака в ответ на хроническое воспаление. Пелайо Корреа предложил модель канцерогенеза – последовательность развития изменений в желудке от ее физиологического состояния до появления рака через формирование поверхностного, атрофического гастрита, метаплазии и дисплазии в слизистой оболочке (СО) [6]. Робин Уоррен доказал роль инфекции HP в возникновении хронического воспаления и в дальнейшем новообразования. Благодаря своей широкой распространенности HР вызывает более 60% всех случаев РЖ, однако длительное время большинство HР-носителей остается бессимптомными.
Целью нашего исследования стал анализ распространенности НР среди жителей г. Читы, клинических и морфологических проявлений инфекции.
МАТЕРИАЛ И МЕТОДЫ
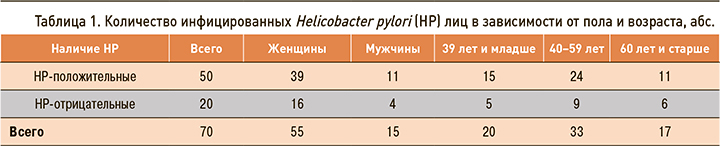
В течение 2019 г. в исследование было включено 70 человек, из них 55 женщин и 15 мужчин, среднего возраста – 47,04±12,76 лет. Лиц в возрасте 39 лет и младше было 20 человек, 40–59 лет – 33 человека, 60 лет и старше – 17 человек.
Определение инфекции НР проведено антигенным тестом в кале с помощью одностадийного иммунохроматографического метода. Для оценки симптомов и анамнеза со стороны органов ЖКТ была разработана оригинальная анкета.
Ультразвуковое исследование (УЗИ) желудка с оценкой толщины стенки в пилорическом, кардиальном отделах и в теле желудка было выполнено 47 участникам на аппарате VOLUSON E10 (GE, США-Австрия). Контрольное УЗИ исследование было проведено у 9 человек через 8 мес после успешной эрадикации НР. Эндоскопия верхних отделов ЖКТ выполнялась с помощью видеогастроскопа Pentax EG 29-i10, видеопроцессора Pentax EPK-i7010 у 35 человек. Во время исследования у 29 лиц был взят биопсийный материал СО из 5 точек желудка (2 – из антрального отдела по большой и малой кривизне, 1 – из угла желудка и 2 – из тела желудка по большой и малой кривизне) для гистологического исследования и оценки по системе OLGA.
38 участников исследования получили эрадикационное лечение в соответствии с основной или резервной схемами. В качестве ингибитора протонной помпы применялся эзомепразол в удвоенной дозе (40 мг 2 раза/сут). Все схемы были усилены добавлением препарата висмута трикалия дицитрата (240 мг 2 раза/сут) и мультиштаммовым пробиотиком, содержащим 14 штаммов микроорганизмов (Streptococcus thermophilus, бифидобактерии Infantis, Bifidum, Breve, Longum, лактобактерии Delbrueckii ssp. Bulgaricus, Helveticus, Salivarius, Fermentum, Casei, Plantarum, Rhamnosus, Acidophilus, Lactis ssp. Lactis). Продолжительность лечения всеми по всем схемам составила 14 дней. Контроль эрадикации осуществлялся через 6–8 нед после окончания терапии путем определения антигена НР в кале одностадийным иммунохроматографическим методом.
Статистическая обработка результатов проводилась методом описательной статистики, критерия Стьюдента, парного критерия Стьюдента и критерия χ2 (программное обеспечение Биостат).
РЕЗУЛЬТАТЫ
Положительный результат антигенного теста в кале зарегистрирован у 50 человек (71,4%). Мужчины были инфицированы в 73,3% случаев, женщины – в 70,9% (р >0,05). Наибольшее количество положительных результатов теста выявлено у лиц младше 39 лет – 75%. С возрастом число инфицированных снижалось: 72,7% – в возрасте 40–59 лет, 64,7% – старше 60 лет (табл. 1). Однако эта разница была статистически не достоверной (р=0,46).
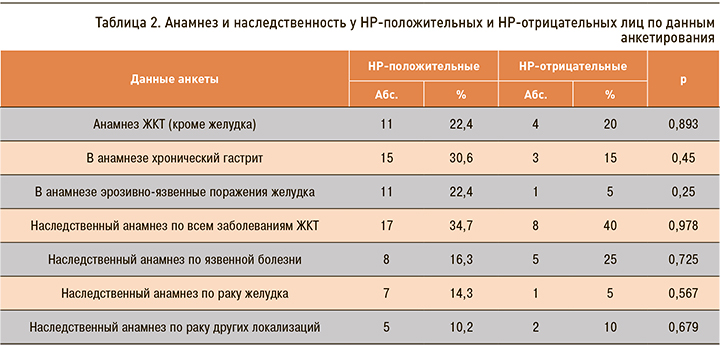
Согласно данным анкеты, анамнез заболеваний ЖКТ (кроме желудка) имели в одинаковой степени НР-положительные и НР-отрицательные респонденты (22,4 и 20% соответственно; р=0,893), однако хронический гастрит диагностировался у НР-положительных лиц в 2 раза чаще, а эрозивно-язвенные поражения желудка – в 4,48 раз чаще. Отягощенную наследственность со стороны органов пищеварения имели 75,5% инфицированных и 80% неинфицированных участников; вместе с тем РЖ в наследственном анамнезе отмечался в 3 раза чаще при наличии НР (табл. 2).
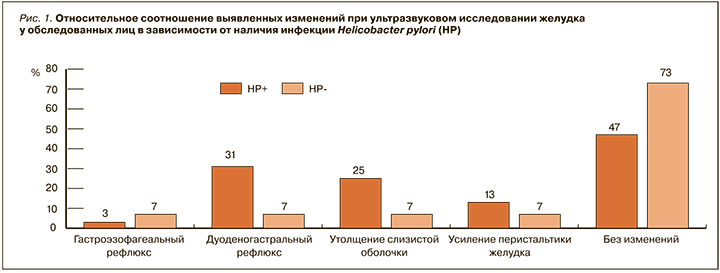
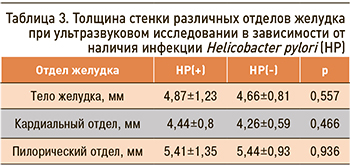 УЗИ желудка было проведено у 47 человек, в том числе у 32 НР-положительных пациентов. В группе инфицированных в 1,5 раза чаще выявлялись какие-либо изменения, включая дуоденогастральный рефлюкс (в 4,6 раза чаще), усиление перистальтики желудка (в 1,8 раз чаще) (рис. 1). При наличии бактерии отмечалась тенденция к увеличению толщины стенки в теле желудка на 0,21 мм, в кардиальном отделе – на 0,18 мм (р >0,05) (табл. 3).
УЗИ желудка было проведено у 47 человек, в том числе у 32 НР-положительных пациентов. В группе инфицированных в 1,5 раза чаще выявлялись какие-либо изменения, включая дуоденогастральный рефлюкс (в 4,6 раза чаще), усиление перистальтики желудка (в 1,8 раз чаще) (рис. 1). При наличии бактерии отмечалась тенденция к увеличению толщины стенки в теле желудка на 0,21 мм, в кардиальном отделе – на 0,18 мм (р >0,05) (табл. 3).
При проведении эндоскопии у 29 человек была выполнена биопсия СО желудка и проведено морфологическое исследование с ранжированием по системе OLGA. При гистологическом исследовании большинство обследованных имело высокую степень активности воспаления в желудке: III степень была диагностирована у 55,1% участников исследования, IV степень – у 31%, что свидетельствовало о высоком риске эрозивно-язвенных осложнений. Первая стадия атрофии обнаружена в 72,4%, вторая в 6,9% и третья в 10,3% случаев (рис. 2).
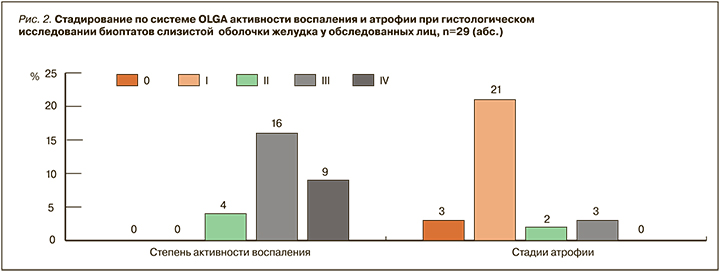
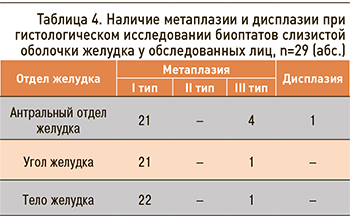 Именно группа лиц с III стадией атрофии имеет повышенный риск РЖ и требует пристального наблюдения. Все пациенты с III стадией атрофии имели инфекцию НР. Оценивая метапластические изменения в желудке, был выявлен III тип кишечной метаплазии (неполная толстокишечная) у 6 человек, что составило 20,7% от всех обследованных. У одного человека диагностирована интраэпителиальная неопределенная неоплазия (табл. 4). Всем лицам, имеющим риск неопластических изменений в желудке и инфекцию НР, было проведено антихеликобактерное лечение.
Именно группа лиц с III стадией атрофии имеет повышенный риск РЖ и требует пристального наблюдения. Все пациенты с III стадией атрофии имели инфекцию НР. Оценивая метапластические изменения в желудке, был выявлен III тип кишечной метаплазии (неполная толстокишечная) у 6 человек, что составило 20,7% от всех обследованных. У одного человека диагностирована интраэпителиальная неопределенная неоплазия (табл. 4). Всем лицам, имеющим риск неопластических изменений в желудке и инфекцию НР, было проведено антихеликобактерное лечение.
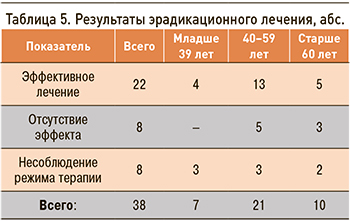 Порадовали результаты опроса, который показал, что 78% инфицированных, участвующих в исследовании, хотели бы провести эрадикацию инфекции; 38 человек прошли такую терапию. Несоблюдение режима терапии было отмечено у 8 человек, что составило 21% от начавших лечение. Нарушение эрадикационного протокола выражалось в использовании одного антибиотика, сокращении сроков лечения, использовании менее 90% необходимых лекарственных средств. Контроль эрадикации в этой группе показал исчезновение инфекции только в одном случае. В дальнейшем эти 8 человек были исключены из анализа эффективности схем антихеликобактерной терапии, и оценка производилась только у тех участников, у кого не было отклонений от протокола лечения. В итоге эффективность всех схем эрадикации составила 73,3%. Анализ эффективности лечения в зависимости от возраста показал, что успешная элиминация НР регистрировалась в 100% случаев у лиц младше 39 лет, в 72,2% – в возрасте 40–59 лет и в 62,5% – у пациентов старше 60 лет (табл. 5).
Порадовали результаты опроса, который показал, что 78% инфицированных, участвующих в исследовании, хотели бы провести эрадикацию инфекции; 38 человек прошли такую терапию. Несоблюдение режима терапии было отмечено у 8 человек, что составило 21% от начавших лечение. Нарушение эрадикационного протокола выражалось в использовании одного антибиотика, сокращении сроков лечения, использовании менее 90% необходимых лекарственных средств. Контроль эрадикации в этой группе показал исчезновение инфекции только в одном случае. В дальнейшем эти 8 человек были исключены из анализа эффективности схем антихеликобактерной терапии, и оценка производилась только у тех участников, у кого не было отклонений от протокола лечения. В итоге эффективность всех схем эрадикации составила 73,3%. Анализ эффективности лечения в зависимости от возраста показал, что успешная элиминация НР регистрировалась в 100% случаев у лиц младше 39 лет, в 72,2% – в возрасте 40–59 лет и в 62,5% – у пациентов старше 60 лет (табл. 5).
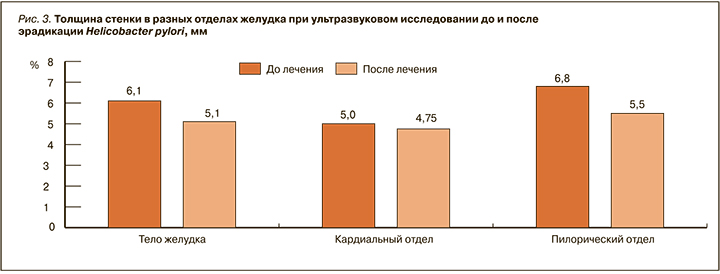
После проведенного антихеликобактерного лечения 9 лицам с утолщенной стенкой желудка было проведено повторное УЗИ. При контрольном УЗИ толщина стенки в теле желудка достоверно уменьшилась на 1 мм (р=0,05), в пилорическом отделе – на 1,3 мм (р=0,013). В кардиальном отделе уменьшение толщины оказалось несущественным – с 5 до 4,75 мм (р=0,17) (рис. 3).
ОБСУЖДЕНИЕ
Риск развития дистального РЖ при НР инфекции составляет 1–3%. На канцерогенез влияют факторы вирулентности и бактерий, и хозяина [7].
На молекулярном уровне инфекция HР вызывает множество изменений. Как указывают Kalisperati P. et al., генетическое повреждение служит главным механизмом, действующим в случаях индуцированного HР канцерогенеза. Дисрегуляция клеточного гомеостаза в СО желудка является главным результатом реакции хозяина на патоген, способствуя хроническому воспалению и повреждению ДНК. Нейтрофилы воспалительного инфильтрата, продуцирующие активные формы кислорода (АФК), индуцируют процесс перекисного окисления липидов (ПОЛ) мембран эпителиальных клеток и могут вызывать двунитевые разрывы ДНК. Окислительное повреждение ДНК коррелирует с тяжестью воспаления желудка. Помимо оксидативного стресса, непосредственно НР приводит к разрыву двойной нити ДНК через прямое взаимодействие патогена с хозяином. В дальнейшем в клетке активируется каскад ответных реакций на повреждение ДНК. Сбой репликации ДНК приводит к геномной нестабильности и селективным мутациям белка р53, что нарушает подавляющее опухолевое действие р53, клеточный цикл и процесс апоптоза клетки. Дисрегуляция апоптоза, включая его индукцию или ингибирование, может играть ключевую роль в опухолевом процессе. Индукция апоптоза приводит к атрофии желудка, гипохлоргидрии. Ингибирование апоптоза ослабляет защитные механизмы хозяина против повреждения ДНК, накапливает генетические ошибки и способствует злокачественной трансформации клеток [8]. Окислительные повреждения ДНК не могут компенсироваться ферментами репарации. НР вызывает снижение экспрессии нескольких ферментов репарации ДНК в тканях желудка. Raza Y. et al. продемонстрировали снижение активности белков ERCC1 и PMS2 на фоне НР инфекции менее чем 20 и 15% от нормы. Авторы предполагают, что снижение экспрессии этих белков – важная причина формирования РЖ [7].
Помимо оксидативного стресса, индуцируемого НР и приводящего к воспалению в желудке и повреждению ДНК, к факторам риска развития РЖ относят наследственную предрасположенность (родственники 1 и 2 линии родства), А(II)-группу крови, низкий социально-экономический уровень, злоупотребление алкоголем и курением (дефицит витамина С), избыточное потребление поваренной соли, высокое содержание нитратов в продуктах питания (например, 3,4-бензпиренов, выделяющихся при копчении мяса и рыбы) [9]. В нашем исследовании инфицированными НР оказались 71,4% человек. Из дополнительных факторов риска РЖ мы смогли оценить только наследственную предрасположенность. При наличии НР отягощенная наследственность имела место в 3 раза чаще по сравнению с НР-негативными лицами.
Международные руководства утверждают, что риск РЖ коррелирует с выраженностью и распространенностью атрофического гастрита (УДД – высокий, СР – сильный) [3]. Vohlonen I. et al. показали увеличение относительного риска развития РЖ у мужчин с атрофическим гастритом за 15-летний период наблюдения до 9,1 (95% ДИ: 2,9–30,0) по сравнению со здоровыми желудками [10].
Инфицированные участники нашего исследования в 2 раза чаще имели в анамнезе хронический гастрит и в 4,48 раз чаще эрозивно-язвенные поражения в желудке по сравнению с неинфицированными лицами. Утолщенная стенка желудка при УЗИ как показатель воспалительных изменений регистрировалась в 3,7 раз чаще на фоне инфекции. Однако для надлежащего определения стадии предраковых состояний желудка необходимо морфологическое исследование. Для этого диагностическая эндоскопия должна включать взятие биопсийных образцов (УДД – умеренный, сильная рекомендация). Международные руководства свидетельствуют, что биопсию следует выполнять как минимум на двух топографических участках (по малой и большой кривизне, в антральном отделе и в теле желудка), дополнительно – из угла желудка (УДД – умеренный, сильная рекомендация). Для выявления пациентов с гастритом на поздних стадиях могут использоваться системы гистологического определения стадии заболевания (OLGA и OLGIM). Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития РЖ (УДД – умеренный, сильная рекомендация) [11].
При морфологическом исследовании биоптатов из пяти точек желудка у обследованных лиц в результате стадирования по системе OLGA в 10,3% случаев была диагностирована 3 стадия атрофии желудка, в 20,7% обнаружена неполная толстокишечная метаплазия (III тип).
Кишечная метаплазия – это замещение желудочных желез железами кишечного типа. Выделяют два типа кишечной метаплазии – полную (тонкокишечную, I тип) и неполную (толстокишечную, III тип). Неполная кишечная метаплазия является одним из этапов желудочного канцерогенеза. Следующий этап – это формирование дисплазии. Неопределенная дисплазия была диагностирована у одного человека. Этот факт свидетельствует о повышенном риске формирования РЖ и требует дальнейшего динамического эндоскопического и морфологического наблюдения. Атрофические и метапластические изменения желез у обследованных лиц обнаружены на фоне высокой активности воспалительного процесса III–IV степени в 86% случаев у НР-инфицированных участников.
Согласно международным руководствам, при ведении пациентов с хроническим атрофическим гастритом и кишечной метаплазией развитие дисплазии высокой степени и инвазивный рак желудка следует рассматривать как исходы, которые необходимо предотвратить (УДД – умеренный, сильная рекомендация) [11]. Наиболее эффективной стратегией является полная элиминация НР. Эрадикация инфекции устраняет воспалительную реакцию (УДД – 1b, СР – B), приводит к обратному развитию атрофии в отсутствии кишечной метаплазии (УДД – 1b, СР – А) [2]. Было показано, что эрадикация НР на ранних стадиях гастрита и атрофии может привести к ослаблению повреждения ДНК и активации ответа на это повреждение. Однако кишечная метаплазия рассматривается как точка невозврата. Мутации р53 часто находят в метапластическом эпителии [8]. Эрадикация снижает риск РЖ (УДД – низкий, СР – умеренная), но при этом утверждается, что максимальный прогностический эффект достигается при ее проведении до развития атрофических процессов в СО желудка (УДД – высокий, СР – сильный) [3]. В связи с этим Киотский консенсус рекомендует скрининговое обследование на НР среди молодых людей до развития атрофического гастрита и кишечной метаплазии (УДД – умеренный, СР – сильный) [3].
Среди обследованных жителей г. Читы наиболее часто инфицированы НР были как раз молодые люди до 39 лет (75%). Эффективная эрадикация при применении всех схем была достигнута в 73,3% случаев, при этом наилучший результат был получен у лиц молодого возраста. При условии строгого соблюдения режима терапии в этой группе полная элиминация бактерии была достигнута в 100% случаев. Достоверное улучшение было зарегистрировано при динамическом УЗИ желудка. Через 8 мес после успешного лечения толщина стенки уменьшилась на 1–1,3 мм (р=0,013–0,05).
Положительную динамику в рамках канцеропревенции после успешного антихеликобактерного лечения продемонстрировали Kato M. et al. В ходе 5-летнего наблюдения за 3021 пациентом было зарегистрировано формирование РЖ в 3,6% случаев при персистенции НР и только в 1,3% после успешного лечения инфекции [12].
ЗАКЛЮЧЕНИЕ
Имеются убедительные доказательства, что НР служит причиной формирования хронического гастрита с развитием атрофии, метаплазии и возможным прогрессированием в РЖ. Для предотвращения тяжелых изменений в СО желудке должна проводиться эрадикация инфекции, которая существенно уменьшает выраженность воспаления, что было продемонстрировано в нашем исследовании.
Наилучший эффект антихеликобактерной терапии в рамках канцеропревенции следует ожидать у молодых людей. Осознание необходимости проведения такой терапии должно быть как у врача, так и у пациента.



