В 90-х гг. прошлого века была постулирована ассоциация низкого уровня тестостерона у мужчин и сахарного диабета (СД) 2 типа [1]. В исследованиях гипогонадизм был определен как предиктор развития СД 2 типа [2].
Известно, что ятрогенный гипогонадизм используется при лечении рака предстательной железы (РПЖ) – одного из самых распространенных опухолевых заболеваний у мужчин во всем мире и в России [3]. Совершенствование протоколов ведения таких пациентов способствует существенному увеличению продолжительности их жизни [4, 5]. В то же время андрогендепривационная терапия может становиться ящиком Пандоры в связи c увеличением риска развития СД 2 типа и сердечно-сосудистых рисков.
Большое количество исследований изучали кардиометаболические исходы андрогендепривационной терапии (АДТ) [6, 7]. Значительные изменения в метаболических показателях и параметрах состава тела отмечаются у пациентов даже после 1 или 3 мес такой терапии [8, 9]. По данным проспективного исследования с участием 32 мужчин, получавших в течение 12 мес агонист лютеинизирующего гормона рилизинг-гормона (аЛГРГ), у пациентов за указанный срок наблюдалось возрастание веса на 2,4%, увеличение жировых отложений на 9,4% и снижение мышечной массы на 2,7%, что сопровождалось повышением концентрации инсулина (а это предполагает снижение чувствительности к инсулину и повышение инсулинорезистентности) [10].
Еще одно перспективное исследование 25 пациентов без диабета продемонстрировало, что даже краткосрочное применение AДT в течение 12 нед вызвало снижение чувствительности к инсулину на 12,8% и повышение уровня инсулина в плазме натощак на 25,9%, а также значимое повышение уровня гликированного гемоглобина (HbA1c) и увеличение жировой массы [11].
В американском исследовании проводилось сравнение пациентов, получающих АДТ, пациентов с РПЖ, но без АДТ, и здоровых людей [12]. С поправкой на возраст и индекс массы тела (ИМТ) было показано, что мужчины в группе AДT имели значительно более высокий уровень глюкозы плазмы натощак, инсулина, лептина и индекс HOMA по сравнению с обеими группами. Выявлена значимая отрицательная корреляция между уровнем общего и свободного тестостерона с глюкозой натощак, инсулином, лептином и HOMA-IR. Это исследование продемонстрировало также независимость неблагоприятных метаболических изменений от возраста и ИМТ.
В обсервационном популяционном исследовании 73 196 мужчин в возрасте 66 лет и старше с РПЖ оценивали влияние аЛГРГ и орхиэктомии на развитие СД, ишемической болезни сердца (ИБС), инфаркта миокарда (ИМ) и внезапной сердечной смерти. Была обнаружена ассоциация использования аЛГРГ с повышенным риском развития СД, ИБС, ИМ, внезапной сердечной смерти [13].
 Немало исследований подтвердило связь АДТ с развитием СД [6, 7, 14], однако точные молекулярные механизмы влияния такой терапии на развитие инсулинорезистентности (ИР) и гипергликемии остаются малоизученными. В японском исследовании выявлено не только достоверное повышение гликемии, но и снижение функции β-клеток у пациентов с РПЖ, получающих АДТ [15]: это позволяет предположить, что тяжелый дефицит андрогенов нарушает функцию β-клеток и приводит к неспособности компенсировать ИР [16, 17]. В условиях эксперимента in vivo и in vitro Navarro G. et al. изучали культуру β-клеток островков поджелудочной железы животных и регуляцию глюкозозависимой стимуляции секреции инсулина. Авторы выявили новый негеномный механизм, с помощью которого внеядерный андрогенный рецептор и его паракринное взаимодействие с α-островковыми клетками регулируют рецептор глюкагоноподобного пептида-1 (ГПП-1), который стимулирует функцию β-клеток. Было отмечено снижение глюкозозависимой секреции инсулина с развитием гипергликемии при использовании диеты с высоким содержанием жиров, а также при блокировании андрогенных рецепторов и действия тестостерона [17]. Авторами выявлено, что андрогенный рецептор на β-клетках стимулирует глюкозозависимую секрецию инсулина путем увеличения внутриклеточного биосинтеза цАМФ и таким образом активирует цАМФ-зависимую протеинкиназу А. Кроме того, инсулинотропный эффект тестостерона был опосредован через активацию рецепторов ГПП-1 на островковых клетках с помощью паракринных механизмов. Эти данные подтверждают потенциальную роль дефицита андрогенов в повышении риска развития СД 2 типа, а также обосновывают новые терапевтические подходы, которые могут помочь в профилактике и/или лечении нарушений углеводного обмена. Вместе с тем на данный момент остаются без ответа вопросы о том, какие показатели углеводного обмена являются наиболее репрезентативными у этой группы пациентов, когда нужно их оценивать, какие антидиабетические препараты могут использоваться и на каком этапе.
Немало исследований подтвердило связь АДТ с развитием СД [6, 7, 14], однако точные молекулярные механизмы влияния такой терапии на развитие инсулинорезистентности (ИР) и гипергликемии остаются малоизученными. В японском исследовании выявлено не только достоверное повышение гликемии, но и снижение функции β-клеток у пациентов с РПЖ, получающих АДТ [15]: это позволяет предположить, что тяжелый дефицит андрогенов нарушает функцию β-клеток и приводит к неспособности компенсировать ИР [16, 17]. В условиях эксперимента in vivo и in vitro Navarro G. et al. изучали культуру β-клеток островков поджелудочной железы животных и регуляцию глюкозозависимой стимуляции секреции инсулина. Авторы выявили новый негеномный механизм, с помощью которого внеядерный андрогенный рецептор и его паракринное взаимодействие с α-островковыми клетками регулируют рецептор глюкагоноподобного пептида-1 (ГПП-1), который стимулирует функцию β-клеток. Было отмечено снижение глюкозозависимой секреции инсулина с развитием гипергликемии при использовании диеты с высоким содержанием жиров, а также при блокировании андрогенных рецепторов и действия тестостерона [17]. Авторами выявлено, что андрогенный рецептор на β-клетках стимулирует глюкозозависимую секрецию инсулина путем увеличения внутриклеточного биосинтеза цАМФ и таким образом активирует цАМФ-зависимую протеинкиназу А. Кроме того, инсулинотропный эффект тестостерона был опосредован через активацию рецепторов ГПП-1 на островковых клетках с помощью паракринных механизмов. Эти данные подтверждают потенциальную роль дефицита андрогенов в повышении риска развития СД 2 типа, а также обосновывают новые терапевтические подходы, которые могут помочь в профилактике и/или лечении нарушений углеводного обмена. Вместе с тем на данный момент остаются без ответа вопросы о том, какие показатели углеводного обмена являются наиболее репрезентативными у этой группы пациентов, когда нужно их оценивать, какие антидиабетические препараты могут использоваться и на каком этапе.
Целью нашего исследования было изучение влияния АДТ препаратами из группы аЛГРГ у пациентов с местно-распространенным РПЖ (МРРПЖ) на параметры углеводного обмена.
МАТЕРИАЛ И МЕТОДЫ
 В исследование были включены 102 пациента с МРРПЖ, получающих АДТ препарата аЛГРГ, из них завершили исследование 99 человек (1 пациент исключен в связи с прогрессией МРРПЖ и 2 пациента в связи с началом приема сахароснижающих препаратов). Средний возраст больных составил 69 лет, общие их характеристики представлены в таблице 1.
В исследование были включены 102 пациента с МРРПЖ, получающих АДТ препарата аЛГРГ, из них завершили исследование 99 человек (1 пациент исключен в связи с прогрессией МРРПЖ и 2 пациента в связи с началом приема сахароснижающих препаратов). Средний возраст больных составил 69 лет, общие их характеристики представлены в таблице 1.
Таким образом, включенные пациенты характеризовались средним и старшим возрастом, отсутствием значительного избытка массы тела и абдоминального ожирения, нарушений углеводного обмена, наличием преимущественно кардиоваскулярной сопутствующей патологии.
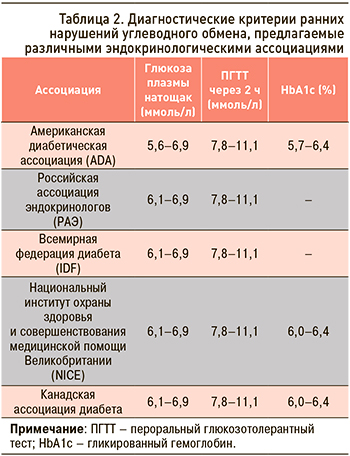
Для оценки динамики состояния углеводного обмена, согласно Алгоритмам специализированной медицинской помощи больным сахарным диабетом, были выбраны показатели НbA1c и глюкозы плазмы натощак как наиболее значимые для верификации диагноза и определяющие последующую тактику ведения пациентов. На момент включения в исследование средний показатель HbA1c составил 5,36+0,66%, что соответствует нормальным диапазонам его значений, оговоренным в рекомендациях ведущих эндокринологических ассоциаций (табл. 2). Следует подчеркнуть, что в отличие от СД 2 типа на сегодняшний день даже на уровне экспертного сообщества отсутствует единое понимание критериев диагностики предиабета, однако это может иметь чрезвычайно важное прогностическое значение. Сегодня нет сомнений в том, что на этапе «предиабетических» титров глюкозы начинает развиваться не только СД 2 типа, но и атеросклеротические сердечно-сосудистые заболевания, сердечная недостаточность и другие серьезные проблемы. Было показано, что повышение HbA1c в «предиабетическом» диапазоне имеет значение также в предсказании сердечно-сосудистых осложнений и общей смертности. Определение закономерностей динамики выбранных показателей – НbA1c и глюкозы плазмы натощак (ГПН) – могут помочь определить тактику ведения таких больных и улучшить их глобальный прогноз.
РЕЗУЛЬТАТЫ
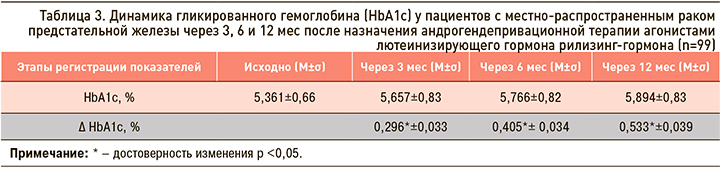
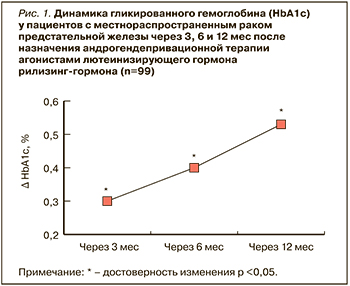 Установленные закономерности динамики HbA1c в среднем по группе у пациентов за 12-месячный период АДТ отражены в таблице 3 и на рисунке 1. Из них следует, что статистически значимое изменение этого параметра наблюдалось в первые три месяца, с последующим менее выраженным, но продолжающимся приростом. Так, динамика средних показателей HbA1c за первые три месяца (между 1 и 2 визитами) составила 0,296%, а за вторые три месяца (между 2 и 3 визитами) – 0,109%; в последующие шесть месяцев (между 3 и 4 визитом) динамика HbA1c оставалась незначительной – 0,128%. Исходя из этих данных, можно считать, что именно в первые три месяца АДТ следует рекомендовать активный мониторинг изменений углеводного обмена и немедикаментозные меры профилактики.
Установленные закономерности динамики HbA1c в среднем по группе у пациентов за 12-месячный период АДТ отражены в таблице 3 и на рисунке 1. Из них следует, что статистически значимое изменение этого параметра наблюдалось в первые три месяца, с последующим менее выраженным, но продолжающимся приростом. Так, динамика средних показателей HbA1c за первые три месяца (между 1 и 2 визитами) составила 0,296%, а за вторые три месяца (между 2 и 3 визитами) – 0,109%; в последующие шесть месяцев (между 3 и 4 визитом) динамика HbA1c оставалась незначительной – 0,128%. Исходя из этих данных, можно считать, что именно в первые три месяца АДТ следует рекомендовать активный мониторинг изменений углеводного обмена и немедикаментозные меры профилактики.
Анализируя в комплексе диагностическую значимость приведенных изменений уровней HbA1c, мы установили, что через 3 мес происходило статистически достоверное повышение его значения, с сохранением тенденции к росту через 6 и 12 мес, что отражает прогрессивный характер указанных изменений (табл. 3). За весь 12-месячный период проведения АДТ динамика уровней HbA1c достигла клинически важного значения 0,533%, а показатель НbА1с в среднем по группе составил 5,894%. Несмотря на то что лишь ADA (в отличие от РАЭ и IDF) классифицирует такой уровень HbA1c как значимый для выявления группы высокого риска развития СД 2 типа (см. табл. 2), мы должны уделить ему должное внимание. Ежегодная конверсия нарушения толерантности к глюкозе (НТГ) в СД 2 типа наблюдается у 5–10%, а за 5-летний период – и у 20–34% пациентов; при сочетании нарушения гликемии натощак (НГТ) и НТГ этот показатель достигает 38–65%. В исследовании TOPICS 4, включавшем 4670 мужчин и 1571 женщину без СД 2 типа, сравнивали способность сочетания различных значений НГТ (глюкоза плазмы натощак 5,6–6,9 или 6,1–6,9 ммоль/л) и повышенного HbA1c (5,7–6,4 или 6,0–6,4%) влиять на развитие СД 2 типа. Было установлено, что при сочетании НГТ 6,1–6,9 ммоль/л с HbA1c 6,0–6,4% вероятность развития СД 2 типа у обследованных лиц в течение 5 лет составляла 100% [18]. Таким образом, диапазон HbA1c 6,0–6,4% позволяет выявить пациентов, имеющих максимальный риск СД 2 типа.
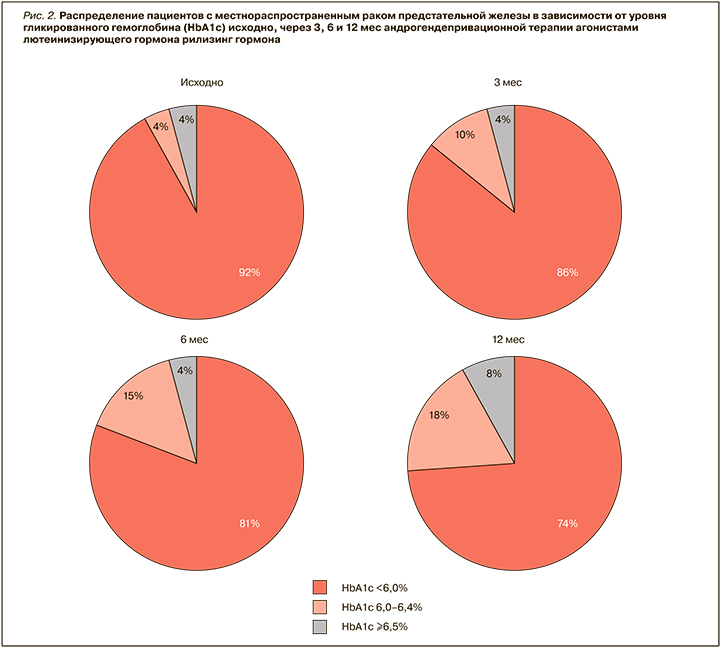
 В нашем исследовании через 12 мес АДТ показатели HbA1c продемонстрировали очень существенную, статистически значимую динамику. В результате этих изменений доля пациентов, имеющих статус предиабета (по критериям ADA), через 3 мес составила 10%, через 6 мес – 15%, через 12 мес – 18%. При этом если оценивать только уровень HbA1c по критериям ADA, то предиабет можно было диагностировать у 47%. Интересно, что доля пациентов с диагностически значимыми для СД 2 типа значениями HbA1c в первые шесть месяцев не менялась, но уже через 12 мес удвоилась и составила 8%, а доля пациентов в нормодиапазоне сократилась на 18% (рис. 2).
В нашем исследовании через 12 мес АДТ показатели HbA1c продемонстрировали очень существенную, статистически значимую динамику. В результате этих изменений доля пациентов, имеющих статус предиабета (по критериям ADA), через 3 мес составила 10%, через 6 мес – 15%, через 12 мес – 18%. При этом если оценивать только уровень HbA1c по критериям ADA, то предиабет можно было диагностировать у 47%. Интересно, что доля пациентов с диагностически значимыми для СД 2 типа значениями HbA1c в первые шесть месяцев не менялась, но уже через 12 мес удвоилась и составила 8%, а доля пациентов в нормодиапазоне сократилась на 18% (рис. 2).
Аналогичным образом, оценивая изменения ГПН, которые исходно находились в пределах нормодиапазона, было установлено, что через 12 мес АДТ уровень ГПН в среднем по группе статистически значимо увеличился: через 3 мес до 5,67±0,93 ммоль/л, через 6 мес – до 5,77±0,96 ммоль/л, через 12 мес – до 5,90±1,12 ммоль/л (табл. 4). Отметим, что, хотя эти показатели были все еще ниже диабетического порогового значения, однако соответствовали предиабетическим показателям ADA (5,6–6,9 ммоль/л).

При анализе динамики изменений ГПН на протяжении 12 мес АДТ (рис. 3) было выявлено, что максимальный прирост уровней ГПН (ΔГПН) отмечался в течение первых 3 мес лечения: он составил +0,486±0,045 ммоль/л и также носил прогрессирующий характер через 6 и 12 мес. По нашим данным, в отобранной группе больных последующее увеличение уровней ГПН продолжалось уже менее значимо, однако статистически достоверно: к 6 месяцу дополнительный ΔГПН составил +0,103±0,027 ммоль/л (p=0,001), а к 12 месяцу – еще +0,133±0,037 ммоль/л (p=0,003). Таким образом, к 12 мес АДТ суммарный ΔГПН составил +0,721±0,066 ммоль/л (p=0,003), что, несомненно, имеет большое клиническое значение.
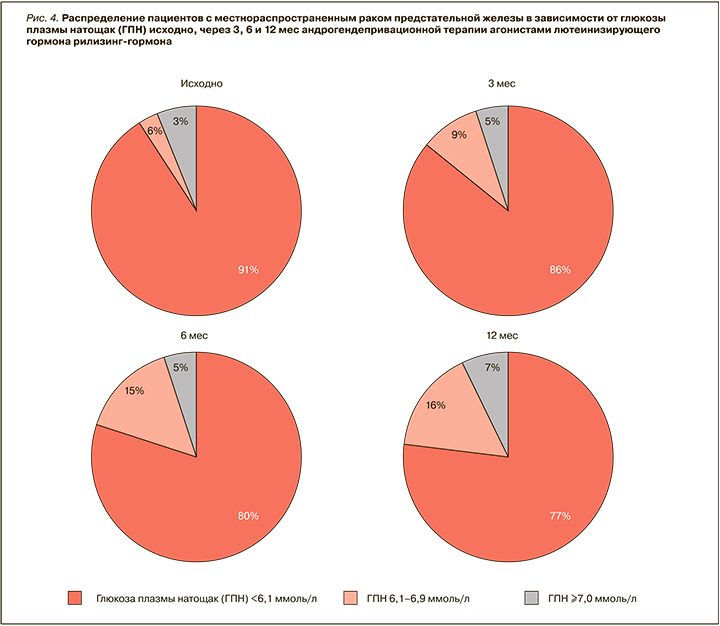
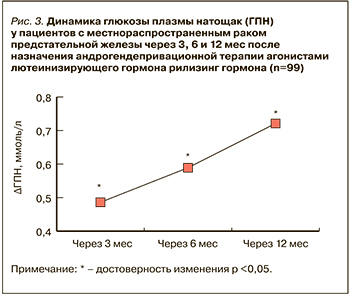 Комплексный анализ клинической значимости динамических изменений показателей ГПН на фоне длительной АДТ отражает ранние закономерности в ухудшении показателей углеводного обмена, требующих коррекции. При анализе диагностической значимости приведенных изменений уровней ГПН мы установили убедительное перераспределение пациентов в группу ранних нарушений углеводного обмена вплоть до диабетических пороговых значений и значимое сокращение пациентов в нормодиапазоне (рис.4). Через 12 мес у 23% пациентов, получающих АДТ, даже по критериям IDF и РАЭ предиабетические нарушения углеводного обмена были диагностированы, а по критериям ADA (ГПН ≥5,6 ммоль/л) – и вовсе у 60%.
Комплексный анализ клинической значимости динамических изменений показателей ГПН на фоне длительной АДТ отражает ранние закономерности в ухудшении показателей углеводного обмена, требующих коррекции. При анализе диагностической значимости приведенных изменений уровней ГПН мы установили убедительное перераспределение пациентов в группу ранних нарушений углеводного обмена вплоть до диабетических пороговых значений и значимое сокращение пациентов в нормодиапазоне (рис.4). Через 12 мес у 23% пациентов, получающих АДТ, даже по критериям IDF и РАЭ предиабетические нарушения углеводного обмена были диагностированы, а по критериям ADA (ГПН ≥5,6 ммоль/л) – и вовсе у 60%.
Крайне важно учитывать роль повышения глюкозы плазмы натощак в развитии не только СД 2 типа, но и сердечно-сосудистых заболеваний (ССЗ). В 2013 г. были опубликованы совместные рекомендации Европейского кардиологического общества (ESC) и Европейской ассоциации по изучению диабета (EASD), посвященные ведению пациентов с СД 2 типа, предиабетом и ССЗ, где подчеркивается наличие тесной патогенетической взаимосвязи между этими заболеваниями/состояниями. Так, в основе многих ССЗ лежит нарушение эндотелиальной функции: механизмы ее формирования (сосудистая инсулинорезистентность, накопление висцеральной и периваскулярной жировой ткани, гипергликемия) начинают реализоваться задолго до развития СД 2 типа, еще на этапе начальных нарушений углеводного обмена. Диастолическая дисфункция миокарда левого желудочка наблюдается на всех этапах диабетического континуума, включая предиабет (относительный риск диастолической дисфункции по сравнению с нормогликемией = 1,77; 95% доверительный интервал 1,10–2,86), и прогрессирует по мере утяжеления. Согласно приведенным выше данным нашего исследования, как уровень HbA1c, так и глюкозы плазмы натощак продемонстрировали клинически значимую динамику за 12 мес АДТ. Это иллюстрирует общую закономерность на фоне АДТ – увеличение доли пациентов с ранними нарушениями углеводного обмена – и требует разработки стратегии своевременной и эффективной коррекции таких нарушений с целью профилактики их ускоренной прогрессии в СД и развития ССЗ.
На сегодняшний день высокая продолжительность жизни пациентов с МРРПЖ при длительной АДТ с применением аЛГРГ диктует необходимость изучения ее отдаленных метаболических последствий, особенно в области нарушений углеводного обмена. По нашим данным, андрогенная депривация вносит большой и независимый вклад в развитие углеводных нарушений, механизмы формирования которых почти не изучены и требуют дальнейшей детализации. В связи с этим логично предполагать, что стандартные меры коррекции ранних нарушений углеводного обмена у больных, получающих АДТ по поводу МРРПЖ, могут быть менее эффективными, чем в общей популяции гипергликемии, и требовать разработки критериев индивидуализации терапии, направленной на профилактику СД 2 типа, кардиоваскулярной патологии и увеличение продолжительности жизни.
С целью изучения характера изменений гликемии, оценки общих суточных изменений, вариабельности постпрандиальной гликемии, закономерностей и тенденций в состоянии натощак и прандиально мы выбрали наиболее современный и удобный для пациентов метод исследования – Flash-мониторинг глюкозы, позволяющий решить эти задачи. Среди пациентов с повышением гликемии были специально отобраны 10 пациентов, получающих АДТ аЛГРГ не менее 6 мес: им были установлены системы Flash-мониторинга глюкозы, позволяющие получить данные «амбулаторного гликемического профиля». Возраст отобранных больных находился в пределах от 59 до 78 лет. Половину из них составили пациенты с нормальной и избыточной массой тела (n=5), половину – пациенты с ожирением (n=5).
Анализ гликемии у пациентов осуществлялся в течение периода мониторинга (14 дней), были выстроены усредненные графики для каждого пациента. Как видно из рисунка 5, данные постпрандиальной гипергликемии в большинстве случаев сочетаются с повышением гликемии в ранние утренние часы (натощак) выше 6 ммоль/л, что также свидетельствует о системном нарушении регуляции глюкозы.
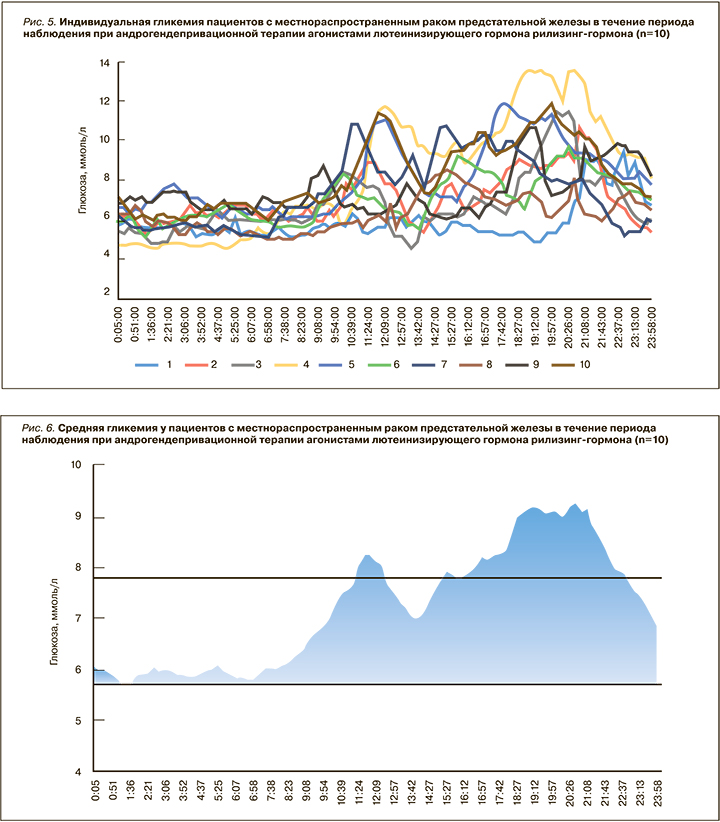
В последующем были подсчитаны средние значения гликемии по времени на одном графике (рис. 6). Отрезные линии на нем соответствуют значениям гликемии 5,6 и 7,8 ммоль/л. Также в результате анализа полученных данных было установлено, что у всех пациентов наблюдались постпрандиальные подъемы гликемии, превышающие 7,8 ммоль/л. Среднее значение гликемии в прандиальный период (с 09:00 до 24:00) составило 7,95+0,79 ммоль/л.
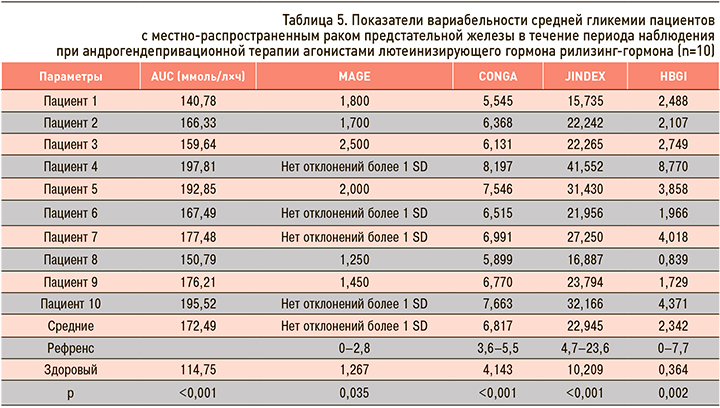
Для средних величин гликемии пациентов были подсчитаны индексы вариабельности (табл. 5). Вариабельность оценивали по следующим параметрам.
1) AUC – характер динамики гликемической кривой, площадь под кривой гликемии. Этот параметр описывает изменения гликемии вокруг базисного уровня глюкозы, или референтной линии во времени.
2) MAGE – показатель средней амплитуды колебаний гликемии.
3) СONGA – непрерывное частично перекрывающееся изменение гликемии. Этот показатель учитывает перепад уровня гликемии за определенный период (m) с последующим шагом анализа перепада гликемии через определенный отрезок времени (в условиях «амбулаторного гликемического профиля» – 15 мин).
4) J-index – сумма среднего значения глюкозы крови и стандартного отклонения.
5) HGBI – индекс риска гипергликемии.
Наиболее показательными стали параметры CONGA и AUC, продемонстрировавшие увеличение вариабельности средних величин гликемии у этой группы пациентов. «Амплитудный» показатель MAGE был мало информативен, поскольку пациенты не получали сахароснижающую терапию и у них не наблюдалось резкое снижение гликемии. JINDEX для средней гликемии находился у верхней границы диапазона. Таким образом, у пациентов на фоне андрогенного дефицита, вызванного аЛГРГ, отмечалось повышение вариабельности гликемии, схожее с больными СД.
ОБСУЖДЕНИЕ
В нашем исследовании уровень глюкозы плазмы натощак увеличился на 13,9%, а HbA1c – почти на 10%. Возрастание показателей углеводного обмена происходило уже через 3 мес АДТ. Это соотносится с данными коротких исследований, которые демонстрируют повышение гликемии, а в уже отмеченном исследовании Smith М.R. et al. – еще и снижение чувствительности к инсулину и повышение уровня инсулина в сыворотке крови у пациентов, получавших AДT 12 нед. Полученные нами данные сходны и с результатами японского исследования Мitsuzuka K. et al. [19], в котором показатели углеводного обмена также исследовались каждые три месяца. Авторы сделали вывод, что АДТ в течение 12 мес вызвала значительные изменения метаболических параметров японских пациентов с РПЖ, а выраженность этих изменений была наиболее заметна в первой половине годичного курса AДT.
Дополнительным фактом, подтверждающим ранние нарушения углеводного обмена при АДТ, служит повышение постпрандиальной гликемии, выявленной при Flash-мониторировании глюкозы. Данные по Flash-мониторированию являются новыми, ранее не встречавшимися нам в литературе. Они позволяют по-другому взглянуть на нарушения углеводного обмена у таких пациентов и предложить иные стратегии в их ведении, поскольку демонстрируют ранние прандиальные нарушения. Это дает основания предположить возможность применения препаратов с инкретиннаправленым механизмом действия для коррекции таких нарушений. В ряде исследований было продемонстрировано, что ранние нарушения углеводного обмена выступают не только промежуточным этапом развития СД, но и независимым фактором риска ССЗ [20, 21]. В связи с этим важны своевременность терапии, ее направленность на конкретные звенья нарушений, индивидуализация лечения.
ЗАКЛЮЧЕНИЕ
На основании проведенного исследования можно предположить, что ключевые негативные последствия при остром андрогенном дефиците вследствие АДТ аЛГРГ могут опосредоваться через феномен глюкотоксичности. Результаты исследования демонстрируют новые данные о факторах, влияющих на прогрессирование углеводных нарушений у мужчин, получающих АДТ аЛГРГ, а также их возможное потенциальное влияние на кардиоваскулярные риски. В дальнейшем актуально не только исследовать сроки развития таких нарушений, но и понять, какими принципами следует руководствоваться при принятии решения об их коррекции: общепопуляционными критериями, принятыми в России на основании критериев ВОЗ, более жесткими ориентирами, заданными ADA, или же для этой категории больных должны быть разработаны свои, отдельные критерии. Кроме этого, необходимо разработать рекомендации по коррекции нарушений углеводного обмена у этой особой группы пациентов.



