Ревматоидный артрит (РА) – системное аутоиммунное заболевание, наиболее заметными клиническими проявлениями которого являются хронический воспалительный полиартрит и рецидивирующий синовит, способные привести к необратимому повреждению суставов и инвалидности. Патологические эффекты РА опосредуются воспалительными цитокинами, включая фактор некроза опухоли-α (ФНО-α) и интерлейкин-1 (ИЛ-1), и усугубляются аутоантителами, что приводит к постоянному аутоиммунно-воспалительному процессу. В последние годы хронические воспалительные заболевания, и в их числе РА, все чаще становятся факторами риска сердечно-сосудистых заболеваний (ССЗ), включая ишемическую болезнь сердца (ИБС), инфаркт миокарда, желудочковые аритмии и внезапную сердечную смерть (ВСС). Проблема заключается в выявлении пациентов, которые подвержены значительному риску ВСС.
ВСС характеризуется резким снижением сердечного выброса и часто вызывается желудочковой аритмией – желудочковой тахикардией или фибрилляцией желудочков. Ежегодная частота ВСС среди населения в целом составляет ≈0,2%, а у пациентов с РА вероятность ее развития вдвое выше, чем у здоровых людей. Эта вероятность сопоставима с таковой у пациентов, страдающих сахарным диабетом [1].
Несмотря на доказательства, связывающие воспаление с ранним атеросклерозом и ИБС, было продемонстрировано, что двукратный риск ВСС, наблюдаемый в популяции РА, сохраняется после внесения поправок на историю госпитализированных или нераспознанных инфарктов миокарда, процедур реваскуляризации и факторы риска ССЗ. Это говорит о том, что повышенный риск ВСС при РА не может быть объяснен только повышением частоты ИБС [2, 3].
Действительно, при РА обычно наблюдаются нарушения реполяризации желудочков (удлинение корригированного интервала QTc, дисперсия интервала QT) и вегетативная дисфункция сердечно-сосудистой системы [4]. Дисперсия интервала QT (QTd) является мерой дисперсии реполяризации желудочков (максимальный интервал QT – минимальный интервал QT). В общей популяции как удлинение QTc, так и увеличение QTd выступают известными факторами риска ВСС [5].
К аномалиям реполяризации, влияющим на риск возникновения ВСС, относят также альтернацию зубца Т, особенно ее микроволновую форму. Альтернация Т-зубцов – это изменчивость морфологии (полярности и амплитуды) зубцов Т электрокардиограммы (ЭКГ) от цикла к циклу (от QRS к QRS) на ЭКГ или при холтеровском мониторировании. Микроальтернация зубцов Т – минимальная периодическая изменчивость зубцов Т, которую практически невозможно уловить глазом. Наличие микроальтернации Т указывает на электрическую нестабильность миокарда [6].
Помимо вышеуказанных нарушений реполяризации, свой вклад в повышение риска ВСС вносит гипертрофия миокарда [5]. Имеющиеся исследования указывают на выраженные аномалии реполяризации при гипертрофии левого желудочка и на дисперсию интервала QT как ценный показатель неоднородности реполяризации и последующей вариабельности сердечного ритма [7].
Имеются отдельные публикации, свидетельствующие о связи между дисперсией QT и различными видами структурной геометрии левого желудочка. В частности, было показано, что по сравнению со здоровыми людьми она повышена у гипертоников с концентрической и эксцентрической гипертрофией [8].
Гипертрофия миокарда нередко сопровождается развитием диастолической сердечной недостаточности, которая, в свою очередь, также влияет на прогноз. Это актуально и для РА, так как при нем возможно развитие диастолической дисфункции с дальнейшим исходом в сердечную недостаточность [9].
Не только ВСС, но сердечная недостаточность у пациентов с РА отличается по своему генезу от таковой в целом по популяции. Установлено, что повышенный риск застойной сердечной недостаточности у пациентов с РА не может быть объяснен высокой частотой факторов риска ССЗ, в том числе ИБС. В то время как 80% хронической сердечной недостаточности в общей популяции связано с классическими факторами риска сердечно-сосудистых заболеваний, при РА эти же предикторы объясняют только 40% случаев [10].
Многообразие факторов, влияющих на развитие ВСС в общей популяции, привело нас к вопросу об изучении распространенности некоторых из этих факторов среди лиц с РА с учетом того, что это ревматологическое заболевание затрагивает не только суставы, но и сердце.
Цель исследования – изучить распространенность факторов риска ВСС среди пациентов с РА.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 282 пациента (240 женщин и 42 мужчины) с верифицированным РА. Эти пациенты проходили стационарное лечение в ревматологическом отделении Республиканской клинической больницы Минздрава Республики Татарстан.
Критериями включения в исследование были возраст старше 18 лет, наличие верифицированного РА, длительность заболевания не менее 1 года.
Критериями исключения служили наличие других воспалительных болезней суставов, злокачественные новообразования и лимфопролиферативные заболевания, беременность и период лактации, достоверно установленные сахарный диабет, ИБС, некорригированная артериальная гипертензия 2–3 степени, кардиомиопатии, клапанные пороки сердца.
До включения в исследование пациенты подписывали информированное согласие установленной формы.
РА у участников исследования был установлен в соответствии с классификационными критериями ACR/EULAR 2010 г. на основании Федеральных клинических рекомендаций по РА, утвержденных Минздравом России в 2018 г. [11].
Всем пациентам проводились стандартные лабораторные и инструментальные диагностические исследования, включавшие общие анализы крови и мочи, биохимический анализ крови, определение уровня циркулирующих иммунных комплексов, рентгенографию пораженных суставов. Помимо этого, выполнялись ЭКГ с вычислением дисперсии интервала QT и определением альтернации зубца Т, двухмерная трансторакальная эхокардиография (ЭхоКГ) с тканевой допплерографией миокарда, определение уровня стимулирующего фактора роста (ST2) в сыворотке крови.
При формулировании клинического диагноза, согласно Федеральным клиническим рекомендациям по РА (2018), вычислялся индекс активности ревматоидного артрита DAS-28, определяли наличие системных внесуставных проявлений [11].
Трансторакальная ЭхоКГ позволила нам обнаружить изменения в структурной геометрии сердца и выделить пациентов с концентрическим ремоделированием, концентрической гипертрофией и эксцентрической гипертрофией миокарда [12]. При совокупном применении двухмерной ЭхоКГ и тканевой допплерографии, согласно рекомендациям Американского общества эхокардиографии и Европейской ассоциации сердечно-сосудистой визуализации 2016 г., у части пациентов были выявлены признаки диастолической дисфункции миокарда [13].
В последние годы большое внимание кардиологов привлекает биомаркер ST2, который, наряду с натрийуретическим пептидом, свидетельствует о развитии сердечной недостаточности, в том числе на ранних этапах. ST2 – член семейства рецепторов ИЛ-1, являющийся «ловушкой» для других белков, которые обеспечивают кардиопротективный эффект при повышении давления или растяжении миокарда. Будучи биомаркером, ST2 модулирует внеклеточный матрикс, регулирует воспалительные, электрические сигналы между кардиомиоцитами, способствуя электрической нестабильности миокарда и, как следствие, летальному исходу или патологическим событиям, в конечном итоге приводящим к ВСС [14].
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2013. Статистический анализ проводился с использованием программы STATISTICA 10.0 (разработчик – StatSoft.Inc). В случае описания количественных показателей, имеющих нормальное распределение, проводился расчет средних арифметических величин (M) и стандартных отклонений (SD). Совокупности количественных показателей, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me), нижнего и верхнего квартилей (Q1–Q3). Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных применялся U-критерий Манна–Уитни. Сравнение номинальных данных проводилось при помощи критерия χ2 Пирсона. За критический уровень статистической значимости принимался p=0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
 Характеристика обследованных пациентов представлена в таблице 1. Большинство пациентов имело 3–4 рентгенологическую стадию и высокую степень активности РА. Больше половины участников исследования страдали от внесуставных системных проявлений этого заболевания.
Характеристика обследованных пациентов представлена в таблице 1. Большинство пациентов имело 3–4 рентгенологическую стадию и высокую степень активности РА. Больше половины участников исследования страдали от внесуставных системных проявлений этого заболевания.
При проведении двухмерной ЭхоКГ нами оценивалась структурная геометрия сердца. У 146 пациентов (51,8%) было выявлено структурно-геометрическое ремоделирование сердца, среди них концентрическое ремоделирование – у 29, концентрическая гипертрофия – у 35, эксцентрическая гипертрофия – у 82 человек (самый высокий показатель).
Среди 136 пациентов с нормальной геометрией сердца (48,2%) 39 человек страдали артериальной гипертензией, 79 имели различные системные проявления РА (синдром Шегрена, ревматоидные узелки и/или криоглобулинемию). У лиц с ремоделированием сердца артериальная гипертензия по понятным причинам диагностировалась достоверно чаще – у 107 человек (p <0,0001), а системные проявления РА – у 87 пациентов (p >0,05).
Средний возраст пациентов в разных группах достоверно различался: 57,9±8,55 лет в группе с ремоделированием сердца и 47,2±11,92 лет – у лиц с нормальной геометрией сердца (p <0,0001).
Учитывая общность механизма формирования ремоделирования сердца по типу концентрической гипертрофии и концентрического ремоделирования, нами было проведено сравнение между группой пациентов с эксцентрической гипертрофией (n=82) и объединенной группой пациентов с концентрическим ремоделированием и концентрической гипертрофией (n=64). Оказалось, что возраст пациентов в первой группе был достоверно выше и составил 58,6±8,52 лет, тогда как во второй – 57,2±7,96 лет (p=0,049). Также нами были получены достоверные различия по частоте системных внесуставных проявлений РА. В первой группе они были обнаружены у 56 (68,3%), во второй – у 33 лиц (51,6%), что соответствовало p=0,04. Стоит отметить, что во второй группе наибольший вклад в этот показатель внесли пациенты с концентрической гипертрофией: среди них (n=35) системные проявления РА были выявлены у 23 человек (65,7%), что сопоставимо с аналогичной частотой среди лиц с эксцентрической гипертрофией.
В связи с этим с исследовательской целью нами были объединены лица с нормальной геометрией и концентрическим ремоделированием в одну группу (n=165), а пациенты с концентрической и эксцентрической гипертрофией – в другую (n=117). При сравнении было установлено, что вне зависимости от типа гипертрофии миокарда эти лица достоверно чаще страдают от системных проявлений РА: 53,9 и 67,5% соответственно (p=0,02). Следовательно, в целом можно заключить, что у пациентов с гипертрофией миокарда чаще обнаруживаются внесуставные проявления РА.
Проведение тканевой допплерографии в совокупности с двухмерной ЭхоКГ позволило нам выделить пациентов с диастолической дисфункцией миокарда и сформировать следующие подгруппы:
- 1 – с нормальной геометрией сердца и без диастолической дисфункции миокарда (n=91);
- 2 – с нормальной геометрией сердца и с диастолической дисфункцией (n=45);
- 3 – со структурно-геометрическим ремоделированием сердца и без диастолической дисфункции миокарда (n=73);
- 4 – со структурно-геометрическим ремоделированием сердца и с диастолической дисфункцией (n=73).
Вполне ожидаемо, что среди пациентов с измененной геометрией сердца (3 и 4 подгруппы) достоверно выше были распространенность диастолической дисфункции, чем среди лиц с нормальной геометрией (1 и 2 подгруппы): 50 и 33,1% соответственно (p=0,004).
Нами было выполнено сравнение между подгруппами в зависимости от наличия диастолической дисфункции миокарда (табл. 2, 3).
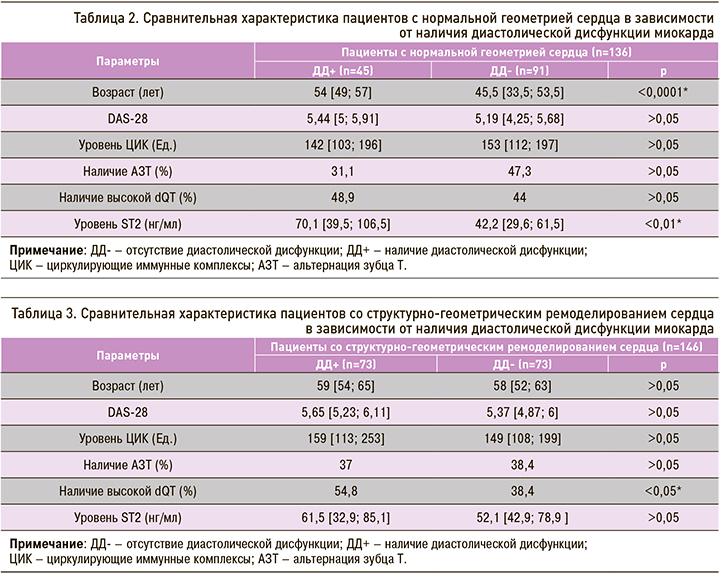
Как видно из таблицы 2, средний возраст пациентов с РА, у которых были выявлены признаки диастолической дисфункции при нормальной геометрии сердца, был выше, чем в сравниваемой подгруппе. Также у них был достоверно выше уровень маркера ST2, что свидетельствует о раннем доклиническом признаке сердечной недостаточности. Судя по всему, несмотря на отсутствие ремоделирования сердца, с возрастом у больных РА повышается вероятность развития не только диастолической дисфункции, но и диастолического типа сердечной недостаточности.
Обе подгруппы пациентов с РА, у которых имелось структурно-геометрическое ремоделирование сердца, практически не отличались по возрасту. Но в подгруппе с диастолической дисфункцией достоверно чаще выявлялась высокая дисперсия интервала QT, чем среди лиц без дисфункции миокарда. Таким образом, развитие диастолической дисфункции при измененной геометрии сердца сопровождается увеличением дисперсии интервала QT, служащей предиктором ВСС у лиц с сердечной недостаточностью.
Полученные результаты направили нас к следующему этапу исследования, в рамках которого было осуществлено сравнение между лицами с высокой дисперсией интервала QT (1 подгруппа, n=139) и без таковой (2 подгруппа, n=143). Нами не было получено достоверных различий между подгруппами по распространенности структурно-геометрического ремоделирования миокарда (51,8 и 51,7% соответственно), гипертрофии левого желудочка (40,3 и 42,7% соответственно) и диастолической дисфункции (45,3 и 38,5% соответственно). Однако в группе с высокой дисперсией интервала QT достоверно чаще, чем в группе без таковой, регистрировалась альтернация зубца Т: 55,6 против 29,3% (p=0,0001).
ЗАКЛЮЧЕНИЕ
Таким образом, у пациентов с РА и системными внесуставными проявлениями этого заболевания чаще обнаруживается гипертрофия миокарда. Наличие диастолической дисфункции у пациентов с ремоделированием сердца на фоне РА сопровождается увеличением дисперсии интервала QT, которая, в свою очередь, ассоциируется с более частым возникновением микроальтернации зубца Т. Учитывая тот факт, что гипертрофия миокарда, наряду с увеличением дисперсии интервала QT и появлением альтернации зубца Т, относится к важным предикторам развития ВСС, необходимо особое внимание уделять пациентам с внесуставными проявлениями РА и с диастолической дисфункцией сердца, особенно при имеющемся нарушении структурной геометрии.



