Лечение ревматоидного артрита (РА) в последние годы претерпело радикальные изменения. Наиболее важным из них следует считать внедрение стратегического подхода. Ряд исследований продемонстрировал, что ведение пациентов с заранее заданными сроками осмотра специалистом и принятием решений по изменению лечения на основании ясных критериев приводит к значительно лучшим результатам, чем просто свободное лечение. В общих чертах концепция стратегического лечения РА, названная «Лечение к цели» (Treat to target), может быть описана следующими правилами:
Лечение должно быть направлено на достижение ремиссии или в случае ее недостижимости – на достижение низкой активности, которые определяются по строгим количественным критериям активности ревматоидного артрита.
Пациент должен регулярно осматриваться врачом-специалистом (ежемесячно до достижения цели лечения и 1 раз в 3–6 мес при достижении); на каждом осмотре на основании оценки активности заболевания, ее изменения на фоне терапии и других факторов должно приниматься решение о целесообразности коррекции лечения.
Оценка активности должна осуществляться с помощь комплексных индексов.
Если цели лечения не достигаются, на любом из его этапов терапия должна наращиваться или модифицироваться, а в случае устойчивого достижения цели лечения объем медикаментозной терапии может сокращаться [1, 4].
В результате более раннего начала лечения, более интенсивного старта лечения в условиях применения стратегического подхода принципиально меняются исходы заболевания [2]. Если около 30 лет назад основной задачей лечения представлялась задержка наступления инвалидности, то сейчас ремиссии удается достигать у большинства пациентов. Более того, у существенной части пациентов, у которых лечение было начато в первые месяцы с момента появления симптомов заболевания, удается достигать долгосрочных безмедикаментозных ремиссий [3].
Еще одним важным этапом стало внедрение в технологию лечения РА таргетных противовоспалительных препаратов (ТПВП) [5]. Речь идет о лекарствах, направленных на отдельные звенья иммунитета и воспаления. К настоящему моменту в Российской Федерации для лечения РА зарегистрировано 9 таких средств: 5 ингибиторов фактора некроза опухоли (адалимумаб, голимумаб, инфликсимаб, цертолизумаб пэгол и этанерцепт), анти-В-клеточный препарат ритуксимаб, блокатор межклеточного взаимодействия абатацепт, ингибитор интерлейкина-6 тоцилизумаб и блокатор JAK-киназ тофацитиниб [6]. Первые 8 препаратов являются белковыми молекулами, получаемыми генно-инженерным способом (ГИБП – генно-инженерные биологические препараты). Тофацитиниб – синтетическая молекула малой массы, блокирующая внутриклеточную передачу сигнала от ряда провоспалительных цитокинов. Таргетные препараты позволили достигать ремиссии или низкой активности у большинства пациентов из числа тех, у кого успех не был достигнут в результате применения традиционных базисных противовоспалительных препаратов (тБПВП).
Значительное расширение спектра доступных лекарственных средств требует выработки подходов к их дифференцированному применению, тактике их использования. Результаты рандомизированных клинических исследований, к сожалению, практически не дают такой информации. Ключевая информация для практических решений, как правило, приходит из исследований реальной практики (единомоментных, когортных, регистровых и др.). Эти же источники незаменимы при изучении безопасности применения препаратов.
МАТЕРИАЛ И МЕТОДЫ
Московский единый регистр артритов (МЕРА) начал набор пациентов с РА в 2011 г. В регистр преимущественно включали пациентов, получающих таргетное лечение данного заболевания. С 2015 г. в регистр стали включать пациентов с псориатическим артритом, а с 2018 г. – также лиц с анкилозирующим спондилитом. В последние две группы набирали только больных, получающих ТПВП или планируемых к такому лечению.
Включаемые в регистр пациенты с РА соответствуют критериям данного заболевания ACR 1991 и/или критериям ACR/EULAR 2010. Все пациенты включаются в регистр после подписания информированного согласия. Для анализа предикторов эффективности лечения из регистра отобраны данные пациентов с РА, получавших на момент последнего их осмотра лечение ГИБП или тофацитинибом не менее 6 мес. Таргетные препараты назначали в соответствии с действующими клиническими рекомендациями ассоциации ревматологов России лицам, у которых терапия традиционными базисными препаратами, включая парентерально вводимый метотрексат в дозе 25–30 мг, не позволила достичь низкой активности или ремиссии заболевания или не переносилась [6]. Пациентам, не достигавшим целевой активности на фоне лечения ТБПВП в течение более 6 мес, производилась смена препарата. Выборка данных регистра произведена 01.03.2018.
В рамках работы регистра пациенты осматриваются уполномоченными врачами. При первом осмотре собирается подробный анамнез жизни (демографические данные, уровень образования, социальный статус, перенесенные и сопутствующие заболевания, лечение по поводу сопутствующих заболеваний), анамнез заболевания суставов (время возникновения симптомов, острое или постепенный тип начала заболевания, симптомы в начале и в дальнейшем течении заболевания, связь начала заболевания с респираторной, кишечной, мочевой или генитальной инфекцией, время установления диагноза, лечение, проводившееся и продолжающееся по поводу РА). При включении в регистр и при каждом последующем осмотре пациенты заполняют опросники, характеризующие их функциональные возможности (HAQ-DI), активность заболевания (RAPID3), качество жизни (EQ-5D), оценивают свое общее состояние в связи с заболеванием по визуальной аналоговой шкале (ВАШ). Пациент осматривается врачом, производится подсчет числа болезненных и припухших суставов из 28, на основании медицинских документов вносятся данные о текущих лабораторных показателях (СОЭ и С-реактивный белок). При всех осмотрах, кроме первого, пациент сообщает о всех медицински значимых событиях, произошедших между визитами, а также о всех изменения в лечении.
 Эффективность лечения оценивали по достигнутой величине комплексного индекса активности заболевания DAS28(СОЭ). Под достижением целевой активности понималось достижение величин DAS28(СОЭ) менее 3,2 на последнем осмотре в рамках регистра.
Эффективность лечения оценивали по достигнутой величине комплексного индекса активности заболевания DAS28(СОЭ). Под достижением целевой активности понималось достижение величин DAS28(СОЭ) менее 3,2 на последнем осмотре в рамках регистра.
Поиск предикторов эффективности лечения осуществляли в 2 этапа [7]. На первом путем однофакторных тестов (однофакторный дисперсионный анализ для категорийных показателей и корреляционный тест Спирмена для количественных) выявлялись факторы, значимо связанные с достигнутой величиной DAS28(СОЭ). На втором этапе из отобранных показателей путем обратного пошагового отбора переменных строилась многофакторная обобщенная линейная модель (General lineal model). Процесс отбора переменных продолжался до достижения ситуации, когда все переменные в модели демонстрировали статистически значимую связь с зависимой переменной (p <0,05). Анализ производился с помощью статистического пакета IBM SPSS Statistics ver. 22. (SPSS corp. 1989, 2013).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В анализ предикторов эффективности лечения были включены 554 пациента. Характеристика их приведена в табл. 1.
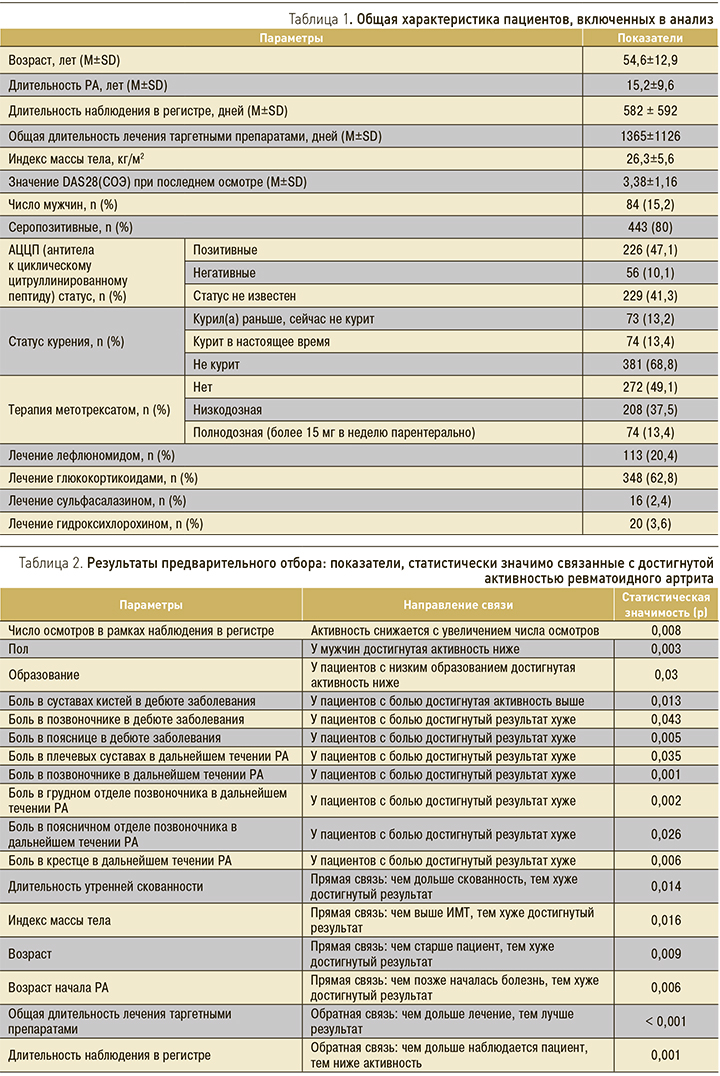
Использовавшиеся таргетные препараты представлены на рис. 1.
В результате анализа выявлен ряд однофакторных связей достигнутой активности с различными показателями, характеризующими пациентов и течение их заболевания. Они представлены в табл. 2.
Дальнейший отбор осуществлялся из вышеуказанных показателей в рамках многофакторной модели (обобщенная линейная модель) путем обратного пошагового отбора переменных. В результате была сформирована модель, в рамках которой связи всех переменных с зависимой (достигнутая величина DAS28) была статистически значимой. Результат представлен в табл. 3.
После этого модель была проверена на наличие значимых взаимодействий между включенными переменными. Было выявлено статистически достоверное взаимодействие между числом визитов пациентов в регистре и общей длительностью лечения таргетными препаратами: положительная связь их произведения с зависимой переменной (p <0,001).
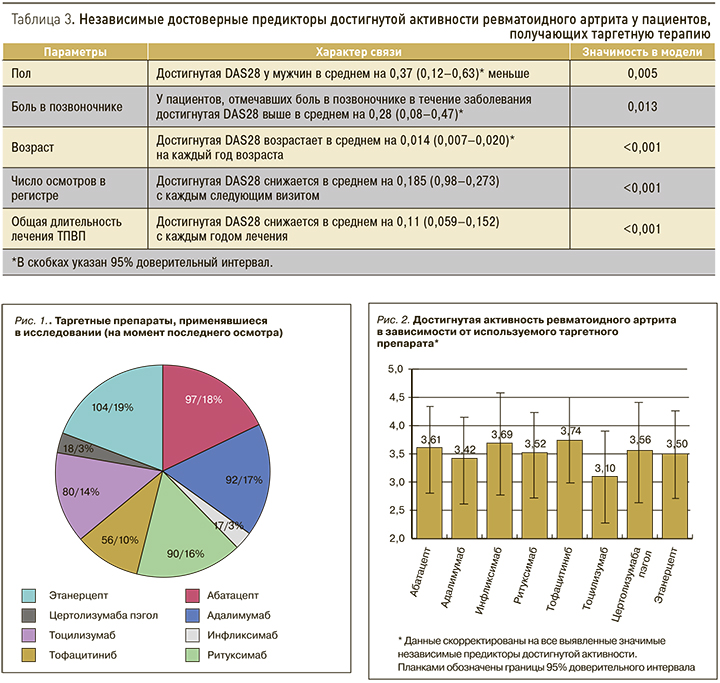
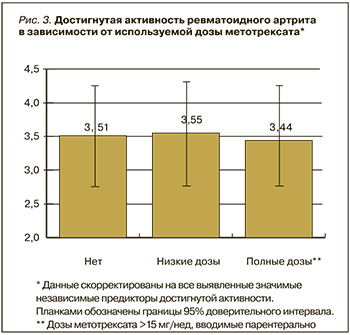
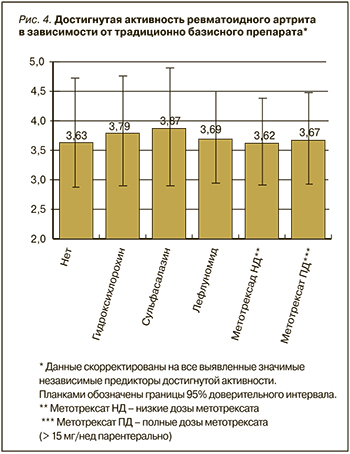 На следующем этапе анализа в рамках разработанной модели анализировались эффекты различных аспектов лечения пациентов. Таким образом, оценка эффекта лечения производилась с коррекцией на выявленные независимые значимые предикторы, что можно рассматривать как математическое нивелирование различий между пациентами. Достигнутый уровень активности оказался значимо связанным с используемым таргетным препаратом (p=0,03; см. рис. 2). Не было выявлено значимых различий в достигнутой активности у пациентов, получавших различные дозы метотрексата и различную традиционную базисную терапию (рис. 3, 4).
На следующем этапе анализа в рамках разработанной модели анализировались эффекты различных аспектов лечения пациентов. Таким образом, оценка эффекта лечения производилась с коррекцией на выявленные независимые значимые предикторы, что можно рассматривать как математическое нивелирование различий между пациентами. Достигнутый уровень активности оказался значимо связанным с используемым таргетным препаратом (p=0,03; см. рис. 2). Не было выявлено значимых различий в достигнутой активности у пациентов, получавших различные дозы метотрексата и различную традиционную базисную терапию (рис. 3, 4).
Данные скорректированы на все выявленные значимые независимые предикторы достигнутой активности заболевания. Планками обозначены границы 95% доверительного интервала.
Данные скорректированы на все выявленные значимые независимые предикторы достигнутой активности заболевания. Планками обозначены границы 95% доверительного интервала. Под полными дозами метотрексата понимались дозы более 15 мг в неделю, вводимые парентерально.
Данные скорректированы на все выявленные значимые независимые предикторы достигнутой активности заболевания. Планками обозначены границы 95% доверительного интервала. Полные дозы метотрексата – дозы более 15 мг в неделю, вводимые парентерально.
ОБСУЖДЕНИЕ
Очень важным для осмысления полученных результатов является понимание того факта, что включались пациенты с РА наиболее сложной категории – больные, у которых не удалось достичь низкой активности заболевания на фоне использования всех возможностей традиционной базисной противовоспалительной терапии. В отличие от популяции «неответчиков на базисную терапию» многих рандомизированных клинических исследований в регистр МЕРА включаются пациенты, проходящие намного более строгий отбор. Это лица, получающие таргетные препараты за счет бюджетных средств. Одобрение на выписку этих препаратов дает Комиссия по применению генно-инженерных препаратов, которая тщательно проверяет соответствие пациентов критериям назначения таргетных средств в клинических рекомендациях Ассоциации ревматологов России.
С учетом применявшегося отбора может быть интересен анализ лечения, которое получали такие пациенты. Обращает на себя внимание относительно небольшая доля пациентов, получающих дозы метотрексата более 15 мг парентерально (74 пациента из 554). Остальные пациенты могли быть включены в регистр только в том случае, если у них была документирована непереносимость таких доз или их полная неэффективность, поскольку клинические рекомендации предполагают обязательное применение метотрексата в дозах 25–30 мг парентерально до присоединения таргетного препарата. Эти факты дают повод предполагать, что пациенты, получающие адекватные дозы метотрексата, в большинстве своем достигают целевой активности (низкая активность или ремиссия) и не требуют применения ТПВП.
Обращает на себя внимание большая доля пациентов, получавших глюкокортикоиды (348 из 554 – 62,8%). Рекомендации предполагают возможность назначения их на короткое время в начальном периоде лечения больных РА. В нашей популяции больные получали эти препараты на постоянной основе. Такой высокий процент пациентов на глюкокортикоидах дает основания для двух предположений. С одной стороны, в отличие от метотрексата применение глюкокортикоидов, по-видимому, как минимум не способствует достижению целевой активности артрита. С другой стороны, длительное продолжение глюкокортикоидной терапии можно рассматривать как индикатор неадекватного ведения пациента в целом (недостаточно плотное наблюдение, несвоевременность коррекции лечения, необоснованные назначения и отмены препаратов и другое). Последний аспект позволяет ожидать худших результатов лечения соответствующих больных и высокую потребность их присоединения к таргетной терапии.
Главной измеряемой целью лечения в РА является активность заболевания. Анализ предикторов достигнутой на лечении активности также может привести к интересным наблюдениям. Мужской пол во многих когортных исследованиях оказался ассоциированным с меньшими значениями комбинированных индексов активности. При этом, как правило, пол был связан с различиями в субъективных компонентах этих индексов (число болезненных суставов, оценка общего состояния пациентом). Это дало повод ряду авторов предлагать использовать разные критерии ремиссии и низкой активности для мужчин и женщин (у мужчин они должны быть строже). Возможно, сходные причины лежат за ассоциацией между низким уровнем образования и меньшими значениями индекса активности РА.
Связь возраста с худшими результатами лечения отмечалась во многих наблюдательных исследованиях. Весьма вероятно наслаивание различных симптомов, прямо не связанных с РА, но находящих свое отражение в индексе активности. Например, оссалгии, характерные для дефицита витамина D, дефицита кальция, вторичного гиперпаратиреоза, значительно учащаются с возрастом и могут приводить к возрастанию числа болезненных суставов и ухудшению оценки общего состояния пациентом. С возрастом увеличивается и риск депрессии, влияние которой на индекс активности заболевания будет очень похожим. Вероятно, в реальной практике врач должен очень тщательно дифференцировать симптомы активности артрита и проявления других (связанных или не связанных с ним) состояний. Особенно это актуально у лиц старших возрастных групп.
Число осмотров пациента в рамках его наблюдения в регистре и общая продолжительность таргетной терапии оказались взаимонезависимыми предикторами, обратно коррелирующими с достигнутой величиной DAS28. Действительно, в длительных наблюдательных исследованиях отмечалось постепенное и постоянное (год от года) снижение активности РА и возрастание вероятности достижения ремиссии у пациентов, получающих генно-инженерные препараты. Причем такое снижение наблюдалось и в начальный период применения таргетных препаратов, когда возможности для переключения с препарата на препарат были ограниченными. Число осмотров пациента и тесно связанная с ним длительность наблюдения его в регистре во всех наших анализах ассоциировались со снижением активности заболевания. Так, в одном из них мы показывали, что за период наблюдения в регистре в среднем около 400 дней число пациентов, достигших целевого уровня активности заболевания, возросло с 28,3 до 55,7%. Причем снижение активности наблюдалось и у пациентов, длительно находившихся на таргетной терапии. Мы связывали наблюдаемое улучшение состояния пациентов с результатами более тщательного наблюдения за пациентами, регулярным количественным измерением активности и своевременной сменой недостаточно эффективных препаратов. Демонстрация независимости этого явления от общей длительности таргетной терапии имеет важный практический смысл: присоединив к терапии таргетный препарат, не следует просто пассивно ждать достижения результата. Нужно продолжать тщательно наблюдать за пациентом и энергично модифицировать лечение, если целевая активность не достигается через 6 мес лечения или утрачивается, будучи достигнута ранее.
И еще одна интересная находка этого исследования: боли в позвоночнике в течение заболевания оказались независимым предиктором худших результатов лечения. В регистре МЕРА в отличие от большинства других тщательно собирается анамнестическая информация об особенностях клинической симптоматики заболевания. Результаты данного анализа подтвердили их практическую важность. Трудно судить с уверенностью, что стоит за данной связью. Большинство экспертов склонны считать РА патогенетически и клинически гетерогенным заболеванием. Возможно, подвариант болезни, протекающий с вовлечением позвоночника, отличается большей резистентностью к лечению. Другим объяснением может быть предположение, что боли в спине у этих пациентов не связаны напрямую с активностью РА, а являются проявлением коморбидности или осложнений заболевания (например, дефицит витамина D, остеопороз и др.). В любом случае врач должен с большим вниманием относиться к этому симптому и предпринять необходимые усилия для того, чтобы понять его природу и устранить его.
ЗАКЛЮЧЕНИЕ
Данный анализ позволяет выявить ряд проблем и закономерностей, связанных с ведением пациентов с РА, находящихся на лечении таргетными противовоспалительными препаратами. Практические заключения, которые могут быть из него сделаны, весьма точно соответствуют основным принципам современной стратегии лечения к цели (treat to target), разработанной для РА.



