ВВЕДЕНИЕ
В основе определения тяжести клинического состояния пациента с легочной артериальной гипертензией (ЛАГ) лежит классификация Всемирной организации здравоохранения (ВОЗ), которая разделяет больных на определенные функциональные классы (ФК I, II, III, IV) [1–3]. Эта классификация основана на оценке тяжести сердечной недостаточности и возникновении и/ или ухудшении симптомов болезни в зависимости от физической нагрузки, которая является ключевой частью верификации степени тяжести заболевания и индивидуального прогноза пациентов с ЛАГ. Повышение ФК служит тревожным и чувствительным предиктором ухудшения заболевания [4–6].
На основании множества исследований установлено, что показатели дистанции теста шестиминутной ходьбы (6МТХ), уровни мозгового натрийуретического пептида (BNP) / N-терминального фрагмента мозгового натрийуретического пропептида (NT-proBNP) так же, как и ФК, выступают надежными прогностическими факторами, которые необходимо учитывать для стратификации конкретного пациента в ту или иную группу риска и выбора тактики лечения [1, 7, 8]. В текущих клинических рекомендациях предлагается использовать данные лабораторных, инструментальных и клинических исследований для оценки индивидуального риска летальности от легочной гипертензии в течение года (низкий, средний и высокий уровень годовой летальности) [9].
Эхокардиография (ЭхоКГ) – широкодоступный и удобный метод, который позволяет быстро и точно оценить размеры правых и левых предсердий и желудочков, систолическую экскурсию кольца трискупидального клапана (tricuspid annular plane systolic excursion – TAPSE), наличие выпота в сумке перикарда, систолическое давление в легочной артерии (сДЛА), а также произвести вычисление отношения TAPSE к сДЛА. Все эти показатели также имеют важное прогностическое значение в оценке индивидуального риска у пациентов с ЛАГ [10]. Выполнение магнитно-резонансной томографии (МРТ) сердца может дать дополнительные ценные данные (показатели фракции выброса правого желудочка, конечно-диастолического объема правого желудочка, ударного объема), что дает возможность более точно отслеживать эффекты лечения и адаптировать индивидуальную стратегию терапии легочной гипертензии [11]. Клинически важная информация (давление в правом предсердии, систолический индекс, ударный объем, насыщение кислородом смешанной венозной крови) о состоянии сердечно-легочной гемодинамики может быть получена с помощью катетеризации правых отделов сердца [12].
6МТХ – наиболее частый нагрузочный тест, применяемый в экспертных центрах. При оценке его результатов (в метрах) важно, наряду с прочим, учитывать пол, возраст, рост, вес, сопутствующие заболевания, мотивацию пациента. Изменения дистанции 6МТХ – один из самых частых параметров, используемых в качестве различных конечных точек в рандомизированных клинических исследованиях (РКИ) [13].
BNP и NT-proBNP – пока единственные маркеры, которые могут рутинно использоваться для наблюдения и долгосрочной оценки риска у пациентов с ЛАГ [14].
Принципы стратификации пациентов с ЛАГ на три группы риска летальности отражены в таблице.
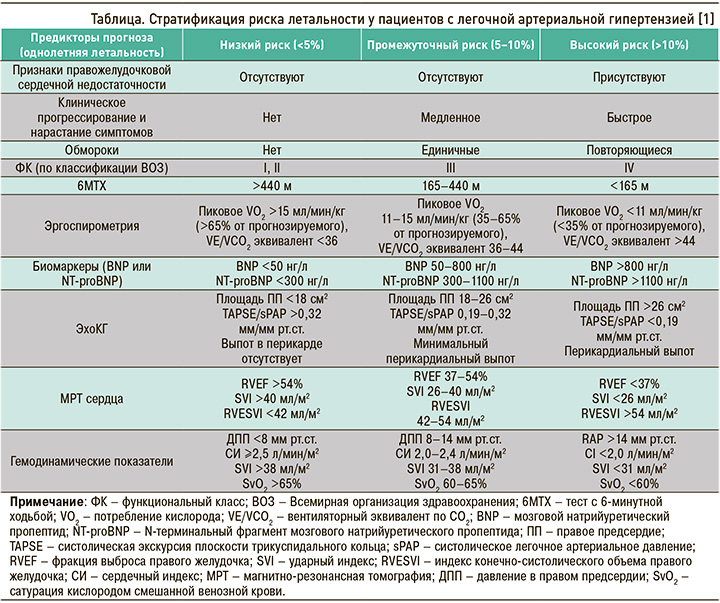
Основной недостаток приведенной «трехгрупповой» модели стратификации заключается в том, что многих пациентов с ЛАГ (около 60–70%) относят к группе промежуточного риска, что не всегда соответствует действительности [15]. В связи с этим в последних рекомендациях Европейского кардиологического общества (European Society of Cardiology) и Европейского респираторного общества (European Respiratory Society) ESC/ERS от 2022 г. [3] было предложено стратифицировать пациентов на четыре группы риска, разделяя промежуточный риск на низкий и высокий (наблюдаемые годовые показатели смертности в четырех группах риска составляли 0–3, 2–7, 9–19 и >20% соответственно). Это, по мнению европейских коллег, позволит точнее классифицировать пациентов и определять более оправданный и индивидуализированный подход к выбору тактики терапии [16]. Тем не менее модель с тремя группами риска всегда должна учитываться для начальной его комплексной оценки, так как она включает важные показатели эхокардиографии, МРТ сердца и гемодинамические параметры [3].
Тактика стратификации пациентов по степени риска годичной летальности и прогрессирования заболевания необходима для решения принципиальной задачи выбора лекарственной терапии. На современном этапе стратегия терапии ЛАГ достаточно «агрессивна», и уже для пациентов, находящихся в зоне низкого риска, предусматривается возможность назначения комбинации препаратов из разных групп, влияющих на различные пути патогенеза. Двойная и тройная комбинированная терапия на сегодняшний день – стандартная методика лечения пациентов с легочной гипертензией. Более того, все чаще рассматривается необходимость назначения комбинированной терапии уже в дебюте ЛАГ для как можно более эффективного предотвращения прогрессирования заболевания в дальнейшем [3].
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ
Блокаторы кальциевых каналов
Для пациентов с ЛАГ (идиопатической, наследственной и ЛАГ, ассоциированной с приемом лекарственных препаратов) [1], которые являются «ответчиками» на вазореактивный тест (это примерно 5% пациентов с легочной гипертензией, прошедших тестирование), проводится начальная пробная терапия (например, от 1 до 3 мес) блокаторами кальциевых каналов – дилтиаземом и нифедипином. Пациентам, у которых наблюдается непереносимость двух вышеуказанных препаратов, а также сопутствующая артериальная гипертензия, стоит рассмотреть назначение амлодипина [17]. Механизм действия этой группы препаратов основан на блокировании кальциевых каналов L-типа, что препятствует току кальция внутрь гладкомышечных клеток сосудов, вызывая их расслабление и расширение просвета сосудов.
К наиболее частым побочным эффектам, которые встречаются у пациентов с ЛАГ, получающих блокаторы кальциевых каналов (БКК), относятся тахикардия, гипотензия и периферические отеки. Они, наряду с прочим, могут быть обусловлены ухудшением функции правого желудочка из-за отрицательного инотропного эффекта препаратов этой группы [18].
Оценка эффективности и безопасности терапии БКК должна проводиться каждые 3–6 мес. Считается, что только у половины пациентов с положительным вазореактивным тестом наблюдается долгосрочный ответ на такое лечение (улучшение функционального класса ВОЗ, которое сохраняется в течение как минимум одного года при применении только БКК) [19]. Соответственно у многих пациентов, у которых наблюдался положительный вазоактивный тест исходно, ответ на терапию БКК, как правило, непродолжителен, что в конечном итоге требует замены этих лекарственных средств на специфические препараты другого класса [20].
Антагонисты рецепторов эндотелина
Эндотелин-1 – это пептид, который вырабатывается эндотелиальными клетками и является мощным вазоконстриктором гладкой мускулатуры. Он реализует свои эффекты, связываясь со специфическими эндотелиновыми рецепторами типа А и В, которые экспрессируются преимущественно на гладкомышечных клетках сосудов и в меньшей степени на фибробластах. Эндотелин-1, воздействуя на рецепторы эндотелина типа A, вызывает вазоконстрикцию и пролиферацию гладкомышечных клеток сосудов. В то же время при взаимодействии эндотелина-1 с рецепторами типа B эндотелиальных клеток происходит вазодилатация – опосредованно через увеличение продукции оксида азота (NO) и простациклина [21].
К неселективным антагонистам рецепторов эндотелина (АРЭ) двойного действия относится бозентан, тогда как амбризентан является селективным антагонистом рецептора эндотелина А. Тем не менее избирательное блокирование рецепторов эндотелина А или одновременное неселективное блокирование рецепторов А и B показали аналогичную эффективность при ЛАГ. Препарат мацитентан является, в свою очередь, неселективным двойным антагонистом обоих типов эндотелиновых рецепторов и обладает уникальными физико-химическими свойствами, что выгодно отличает его от своих предшественников. Эта особенность позволяет препарату надежно и длительно (более 25 ч) удерживать связь с рецепторами, обеспечивая тем самым вазодилатирующие и антипролиферативные эффекты на эндотелии легочных сосудов. Все три препарата одобрены в России для лечения ЛАГ [1].
Бозентан, изученный в 6 РКИ (Study-351, BREATHE-1, BREATHE-2, BREATHE-5, EARLY, COMPASS-2) [22–24], увеличивает время до клинического ухудшения и улучшает гемодинамику легочных сосудов, толерантность к физической нагрузке [25]. РКИ EARLY с участием 168 пациентов c ЛАГ (II ФК) показало увеличение дистанции 6МТХ и снижение легочного сосудистого сопротивления (PVR) у пациентов, принимавших бозентан в качестве монотерапии, через 6 мес исследования по сравнению с плацебо [26]. В двойном слепом РКИ COMPASS-2 исследовались преимущества добавления перорального бозентана к терапии у пациентов с ЛАГ, уже получающих силденафил в качестве монотерапии. В качестве композитной конечной точки было выбрано время до первого исхода – ухудшение тяжести заболевания или смерти. Добавление бозентана не оказалось более эффективным, чем монотерапия только силденафилом [27].
Рандомизированные плацебо-контролируемые исследования с амбризентаном ARIES-1 и ARIES- 2 у пациентов с умеренной и тяжелой идиопатической ЛАГ (в основном II и III ФК по классификации ВОЗ) продемонстрировали эффективность этого препарата в отношении качества жизни пациентов, толерантности к физической нагрузки, гемодинамики легочных сосудов и времени до клинического ухудшения [28].
В исследовании SERAPHIN (самом масштабном исследовании препаратов класса АРЭ) прием перорального мацитентана у 250 больных ЛАГ (от умеренной до тяжелой степени заболевания) при сравнении с плацебо способствовал снижению риска заболеваемости и смертности на 30 и 45% соответственно. Преимущества мацитентана по влиянию на прогноз заболевания убедительно были продемонстрированы как в группе монотерапии, так и в случае его комбинации с другими ЛАГ-специфическими препаратами [29].
В настоящее время проводится двойное слепое РКИ UNISUS, в котором планируется рандомизация 900 пациентов с ЛАГ (II и III ФК) для получения 75 и 10 мг мацицентана соответственно. В качестве первичной конечной точки выбрана композитная точка заболеваемость/смертность [30].
Наиболее частые побочные эффекты АРЭ связаны с гепатотоксичностью и периферическими отеками. Согласно данным, умеренное повышение уровня аминотрансфераз происходит у 10% пациентов, принимающих бозентан (а иногда и амбризентан). Поэтому во время лечения бозентаном целесообразно ежемесячно контролировать показатели функции печени [31]. Наименее гепатотоксичен среди АРЭ амбризентан. Низкий уровень гепатотоксичности характерен и для мацитентана [1].
Важно помнить, что периферический отек выступает наиболее частым побочным эффектом у пациентов, принимающих амбризентан, а также то, что АРЭ обладают тератогенным действием и не должны применяться во время беременности [32].
Исследование AMBITION с участием 500 пациентов показало эффективность комбинации амбризентана и ингибитора фосфодиэстеразы 5-го типа (ИФДЭ-5) тадалафила: назначение такой комбинации привело к значительному снижению частоты достижения первичной контрольной точки по сравнению с монотерапией одним из этих препаратов [33].
В исследовании PHIRST пациенты с ЛАГ, половина из которых принимали бозентан, были рандомизированы для приема тадалафила или плацебо 1 раз/сут в течение 16 нед. Тадалафил значительно увеличил дистанцию 6МТХ и время до достижения контрольной точки, а также улучшил качество жизни пациентов. В неконтролируемом расширенном исследовании PHIRST-2 улучшение показателей 6МТХ сохранялось в течение дополнительных 52 нед [34].
Принимая во внимание результаты вышеуказанных исследований, в настоящее время у пациентов с ЛАГ низкого и промежуточного риска с негативным вазореактивным тестом без сопутствующих сердечных и легочных заболеваний рекомендуется начинать терапию сразу же с комбинации препаратов разных классов (АРЭ + ИФДЭ-5 или АРЭ + ИФДЭ-5 + агонисты простациклина у пациентов высокого риска). В качестве средств монотерапии АРЭ рассматриваются только в том случае, когда у пациента присутствуют другие легочные и/или сердечно-сосудистые заболевания [3].
Ингибиторы фосфодиэстеразы 5-го типа
Из препаратов этой группы в России для лечения ЛАГ зарегистрирован только силденафил.
В основе патогенеза ЛАГ лежит недостаток NO. NO активирует гуанилатциклазу и увеличивает синтез циклического гуанозинмонофосфата (цГМФ), который вызывает релаксацию гладкомышечных клеток стенки сосудов микрокапиллярного русла легких, регулирует проницаемость эндотелия, а также предотвращает агрегацию тромбоцитов. Фосфодиэстераза 5-го типа – фермент, разрушающий цГМФ [1]. Соответственно ИФДЭ-5 осуществляют свое действие, предотвращая распад цГМФ и дополнительно повышая его уровни в клетках-мишенях [35].
Несколько РКИ (SUPER-1, SUPER-2) [36, 37], включавших пациентов с ЛАГ, которые получали силденафил, подтвердили благоприятное влияние препарата на толерантность к физической нагрузке, клиническую картину заболевания и показатели гемодинамики. Одобренная доза силденафила при лечении ЛАГ составляет 20 мг 3 раза/сут [3].
В настоящее время применение ИФДЭ-5 при ЛАГ в монорежиме может быть показано только пациентам с легочными и/или сердечно-сосудистыми заболеваниями [3].
В исследованиях PHIRST, упомянутых выше, еще один препарат из класса ИФДЭ-5, тадалафил (не зарегистрирован в России для лечения ЛАГ), при использовании в дозе 40 мг увеличивал дистанцию 6МТХ и время до клинического ухудшения по сравнению с плацебо [34].
Основные побочные эффекты этой группы препаратов – головная боль, приливы, диспепсия, боли в мышцах и суставах. Совместное применение силденафила с органическими нитратами, а также с риоцигуатом противопоказано из-за высокого риска симптомной гипотензии [35].
Стимуляторы растворимой гуанилатциклазы
К препаратам этого класса относится риоцигуат, предназначенный для перорального приема. В отличие от ИФДЭ-5 он усиливает продукцию цГМФ путем непосредственной стимуляции растворимой гуанилатциклазы как в присутствии, так и в отсутствие эндогенного NO.
В рандомизированном плацебо-контролируемом исследовании риоцигуата (PATENT-1) приняли участие 443 пациента с симптоматической ЛАГ (ИЛАГ, семейной ЛАГ, а также ЛАГ, ассоциированной с системными заболеваниями соединительной ткани, врожденными пороками сердца, портальной гипертензией, приемом препаратов для лечения ожирения центрального действия или амфетамина) [38]. Приблизительно 50% из них до исследования не получали лечения, остальные же применяли в первую очередь АРЭ бозентан. 12 нед перорального приема риоцигуата в дозе 2,5 мг 3 раза/сут привели к умеренному увеличению дистанции 6МТХ, снижению легочного сосудистого сопротивления (PVR), ФК заболевания (по классификации ВОЗ) и времени до клинического ухудшения по сравнению с плацебо. В последующем долгосрочном исследовании (PATENT-2) сообщалось об устойчивых преимуществах и аналогичном профиле безопасности риоцигуата при приеме в течение 2 лет [39].
Исследование RESPITE [40] изучало результат замены ИФДЭ-5 на риоцигуат у пациентов, не имевших адекватного ответа на первую группу препаратов. Это 24-недельное открытое неконтролируемое исследование показало улучшение ФК по ВОЗ у 54% пациентов с ЛАГ.
В РКИ REPLACE [41] в течение 24 нед оценивалась стратегия смены ИФДЭ-5 на риоцигуат у 226 пациентов с ЛАГ, имеющих промежуточный риск летального исхода в течение 1 года. В группе риоцигуата клиническое ухудшение произошло только в 1% случаев (n=1) по сравнению с 9% (n=10) в группе ИФДЭ-5. Результаты этого исследования свидетельствуют, что смена ИФДЭ-5 на риоцигуат у пациентов с ЛАГ с промежуточным риском летальности может быть потенциальным стратегическим вариантом для улучшения прогноза в этой группе больных.
Риоцигуат обладает узким терапевтическим окном, поэтому необходима медленная (с интервалом в две недели) титрация его дозы до максимально переносимой при тщательном контроле клинических проявлений ЛАГ и уровня артериального давления. Риоцигуат также обладает тератогенным эффектом и его применение у беременных противопоказано [1].
Аналоги простациклина и агонисты простациклиновых рецепторов
Известно, что у пациентов с ЛАГ происходит нарушение синтеза и обмена простациклина [42]. Эндогенный простациклин, воздействуя на специфические рецепторы, вызывает увеличение продукции внутриклеточного циклического аденозинмонофосфата (цАМФ). цАМФ, в свою очередь, запускает внутриклеточные метаболические процессы, что приводит к вазодилатации и ингибированию агрегации тромбоцитов [43]. Простациклин также обладает цитопротекторной и антипролиферативной активностью. Именно поэтому в клинической практике для коррекции дефицита простациклина применяются его синтетические аналоги.
В России зарегистрирован только один препарат этой группы – илопрост, который применяется в виде ингаляций. К основным недостаткам его можно отнести необходимость частого введения вследствие короткого периода полураспада, резкие пики и спады концентрации лекарственного средства в плазме и невозможность дозирования во время сна [1].
Эффективность монотерапии ЛАГ илопростом была показана в РКИ AIR [44]. В нем отмечалось улучшение показателей гемодинамики пациентов, увеличение толерантности к физической нагрузке и снижение ФК заболевания. Однако в настоящее время ингаляционный илопрост чаще всего применяется в составе комбинированной специфической терапии ЛАГ в дополнение к пероральным препаратам у больных с высоким риском прогрессирования заболевания [1]. В двух РКИ (COMBI и STEP) [45, 46] ожидаемая эффективность ингаляционного илопроста в качестве дополнительной терапии у пациентов с ЛАГ, уже принимающих бозентан, не оправдалась, и были получены противоречивые результаты.
Основные побочные эффекты илопроста включают головные боли, приливы, боли в нижней челюсти, кашель.
К пероральным непростаноидным селективным агонистам простациклиновых рецепторов относится препарат селексипаг. По механизму действия он аналогичен илопросту, но является более селективным и активным агентом [47].
В исследовании GRIPHON 1156 пациентов с ЛАГ группы 1 и функциональным классом (ФК) по ВОЗ II или III были рандомизированы в группы плацебо или селексипага. Около 80% участников до начала исследования получали стабильную дозу АРЭ, ИФДЭ-5 или комбинацию этих препаратов, остальные 20% применяли только селексипаг. Эффект селексипага в значительной степени был обусловлен снижением частоты госпитализаций (14 против 19%) и прогрессирования заболевания (7 против 17%) и в незначительной степени – выживаемостью (смертность – 5 против 3%) [48].
Наиболее распространенными побочными эффектами этого препарата являются головная боль, диарея, тошнота и боль в нижней челюсти. [1]
В исследовании TRITON [49] пациентам с ЛАГ, ранее не получавшим лечения, назначалась начальная двойная (мацитентан + тадалафил) или тройная (мацитентан + тадалафил + селексипаг) комбинированная терапия. Данное исследование не продемонстрировало преимущества тройной терапии по сравнению с двойной, но подтвердило, что существенные улучшения в гемодинамических показателях и толерантности к физической нагрузке может быть получено при начальном комбинированном лечении (АРЭ + ИФДЭ-5) [3].
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящее время в России доступы все группы лекарственных препаратов для лечения ЛГ. Тактика и стратегия назначения терапии представлена в национальных и международных клинических рекомендациях и в достаточно большом объеме международных РКИ.



