Сахарный диабет является серьезной медико-социальной проблемой, что обусловлено его большой распространенностью, хроническим течением, ранней инвалидизацией и высокой смертностью от сердечно-сосудистых осложнений [1]. По данным Международной федерации диабета (IDF), в 2017 г. в мире были зарегистрированы 425 млн взрослых, страдающих сахарным диабетом [2]. Результаты первого национального эпидемиологического исследования NATION продемонстрировали, что распространенность сахарного диабета 2 типа (СД2) среди населения Российской Федерации составляет 5,4% (около 5,9 млн человек в возрасте 20–79 лет) [3].
Многим пациентам с диабетом не удается достичь и поддерживать целевые уровни гликированного гемоглобина (HbA1c) [4]. Инсулинотерапия часто используется в качестве 2–3-й линий лечения пациентов с СД2 [5]. Так, по данным исследования ФОРСАЙТ-СД2, 40,9% российских пациентов с СД2 получают лечение препаратами инсулина в сочетании с различными пероральными сахароснижающими препаратами (ПССП) или в режиме базис-болюсной инсулинотерапии. Однако применение инсулинотерапии для лечения больных СД2 не всегда эффективно. По данным исследования ФОРСАЙТ-СД2, средний уровень HbA1c в группе пациентов, получавших инсулинотерапию, составлял 8,8±2,0%, в данной когорте пациентов наблюдался высокий уровень гликемии натощак – 8,7±3,1 ммоль/л и постпрандиально – 14,5±2,9 ммоль/л [6]. Согласно части исследования, посвященной клинико-экономическому анализу, лидирующие места в структуре затрат на сахароснижающую терапию занимают препараты инсулина (38%) [1]. Также следует отметить, что у пациентов, получающих инсулин, прямые медицинские затраты оказались в 2,5 раза больше, чем у пациентов, получающих только ПССП [7].
Эффективное применение базис-болюсной схемы инсулинотерапии требует от пациента ежедневного выполнения множества сложных задач. Согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом 2 типа» оптимальным терапевтическим подходом для данной группы больных является обучение подсчету углеводов по системе «хлебных единиц», самоконтроль гликемии не менее 4 раз в сутки [4]. New insulin delivery recommendations (2016) называют правильную технику инъекций инсулина одним из ключевых моментов для оптимального контроля глюкозы крови [8]. Согласно Национальным рекомендациям для медицинских работников по технике инъекций при лечении сахарного диабета (2012) к основным требованиям техники инъекций относятся грамотный режим выполнения инъекций/инфузии, выбор и методика применения устройств для инъекций, правильная техника выполнения инъекции (включая чередование мест введения, угол введения иглы и возможное использование кожных складок), оптимальная длина иглы [9]. Несоблюдение обозначенных условий введения инсулина приводит к появлению липогипертрофий. Известно, что у пациентов с наличием данного осложнения инъекционной терапии уровень HbA1c в среднем выше на 0,55% [10].
В то же время большинство авторов полагают, что для пациентов с СД2 характерны нарушения когнитивной деятельности: снижение концентрации внимания, затруднение обучения, замедление мышления [11]. Было установлено, что СД2 увеличивает риск развития когнитивных нарушений более чем в 6 раз [12], что может становиться существенным барьером на пути достижения контроля углеводного обмена с помощью инсулинотерапии. Основной причиной когнитивных расстройств являются гипогликемические состояния различной степени тяжести, которые часто возникают у пациентов с СД2, получающих инсулинотерапию.
Известно, что негативное восприятие терапии пациентом возрастает с увеличением числа инъекций [13]. Так, 28,8% пациентов c СД2 пропускают инъекции инсулина [14]. Поэтому Экспертная группа по диабету для Центральной и Восточной Европы (CEEDEG) рекомендует для достижения долгосрочной приверженности и хорошего самоконтроля со стороны пациента использование как можно более простых стратегий лечения и отодвигает использование прандиального инсулина на 4-ю линию терапии СД2 [15].
Цель. Изучить параметры гликемического контроля, технику инъекций и приверженность лечению у больных СД2, получающих инсулинотерапию.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось с апреля по октябрь 2017 г. Были обследованы 177 пациентов с СД2 на инсулинотерапии. Возраст участников составил от 32 до 89 лет (в среднем 65,43±9,75 года), преобладали (82%) лица старше 55 лет. В исследовании приняли участие 136 (77%) женщин и 41 (23%) мужчина. Группа представлена пациентами с различной длительностью заболевания: от пациентов с впервые установленным диагнозом, которым на момент выявления СД2 была назначена инсулинотерапия (4 человека – 2,26%), до больных, страдающих СД2 в течение 37 лет. Средняя продолжительность заболевания составила 13,14±7,97 года (от 3 мес до 37 лет). Средняя длительность инсулинотерапии была 6,32±5,64 года (от 2 мес до 37 лет). Большинство пациентов (82%) получали инсулинотерапию менее 10 лет.
Исследование было проведено на базе БУЗ ВО «ЧГБ № 2» Череповецкого диабетологического центра. На январь 2017 г. в городе были зарегистрированы 10 300 человек с установленным диагнозом «сахарный диабет». Из них 9493 пациентов имели диагноз СД2, 801 – СД1. Получали инсулинотерапию 2279 больных СД2. В Череповецком диабетологическом центре наблюдаются 3578 пациентов с СД2. Находятся на инсулинотерапии 1440 человек, таблетированную сахароснижающую терапию получают 2138 пациентов.
В исследование были включены все пациенты с СД2, получающие инсулинотерапию в качестве лечения и обратившиеся за медицинской помощью в диабетологический центр в период проведения исследования.
Всем участникам был проведен объективный осмотр по общепринятой методике стандартного терапевтического обследования с подробным анализом анамнеза, ретроспективным анализом медицинской документации. При проведении клинического обследования и опроса больного использовали индивидуальную регистрационную карту пациента, разработанную с учетом целей и задач настоящего исследования. С целью оценки техники инсулинотерапии был создан опросник (на основе Worldwide Injection Technique Questionnaire) [16], заполняемый самими пациентами. Опросник включал вопросы о длительности СД и инсулинотерапии, наименованиях получаемых инсулинов, числе инъекций в сутки, используемых областях для введения инсулина, формировании кожной складки, угле введения и длине иглы, частоте смены игл для шприц-ручек, пропусках инъекций, наличии и методе ресуспензирования готовых комбинаций инсулина и НПХ-инсулинов перед инъекцией, счете до 10 после введения иглы и удерживании поршня шприц-ручки.
Лабораторные методы обследования включали определение уровня HbA1c (биохимический анализатор с использованием иммунотурбидиметрического теста по конечной точке с сенсибилизацией частицами и непосредственным определением HbA1c без измерения общего Hb). Анализ гликемии натощак и постпрандиально проводился по данным дневников самоконтроля пациентов (глюкозооксидантный метод).
Учитывая ограниченное число участников в подгруппах базальной инсулинотерапии, для анализа суточных доз инсулина и параметров гликемического контроля были использованы медиана (Ме) и квантили (Q1 и Q3). Статистический анализ осуществлялся с использованием программы Statistica 13.3.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По результатам обследования больных СД2 было показано, что средний уровень HbA1c был 7,84±1,62% (от 5,07 до 15,7%). Средний уровень гликемии натощак был 9,1±2,86 ммоль/л, постпрандиально – 10,93±3,55 ммоль/л.
Целевой уровень HbA1c <7% наблюдался лишь у 36,9% пациентов, HbA1c в диапазоне 7–8% – у 21,7% пациентов, >8,0% – у 41,4%.
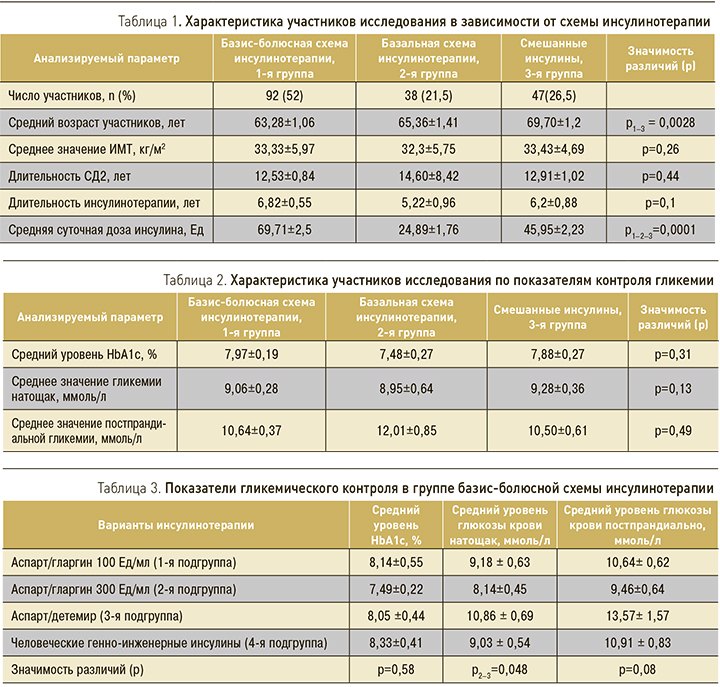
В соответствии с характером проводимой терапии всех участников исследования разделили на 3 группы: 1-я – группа базис-болюсной схемы инсулинотерапии, 2-я – базальной схемы инсулинотерапии, 3-я – смешанных инсулинов (табл. 1).
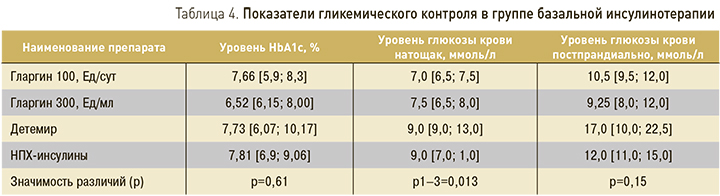
Как видно из представленных данных, среди обследованных больных СД2 52% получали базис-болюсную схему инсулинотерапии. Пациенты, получавшие микс-инсулины, были значимо старше участников группы базис-болюсного режима (р=0,0028). Группы были сопоставимы по длительности заболевания и инсулинотерапии. При анализе средних суточных доз инсулина, получаемых пациентами трех групп, были выявлены значимые различия (р=0,0001). Так, участники группы базис-болюсной инсулинотерапии получали суточную дозу инсулина в 3 раза бóльшую (69,71 Ед) по сравнению с участниками группы базальной инсулинотерапии (24,89 Ед). Однако применение базис-болюсного режима введения инсулина не улучшало контроля углеводного обмена у пациентов с СД2 – значимых различий между группами по среднему уровню HbA1c, гликемии натощак и постпрандиально установлено не было (табл. 2).
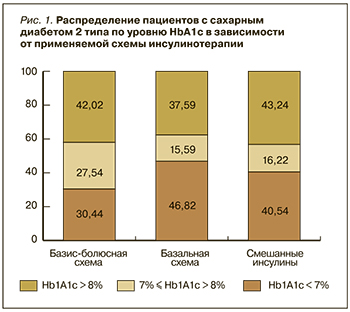 Наиболее часто используемыми комбинациями инсулинов в группе базис-болюсной инсулинотерапии были инсулин аспарт/инсулин гларгин 100 Ед/мл (1-я подгруппа), инсулин аспарт/инсулин гларгин 300 Ед/мл (2-я подгруппа), инсулин аспарт/инсулин детемир (3-я подгруппа), человеческий инсулин короткого действия/инсулин НПХ (4-я подгруппа).
Наиболее часто используемыми комбинациями инсулинов в группе базис-болюсной инсулинотерапии были инсулин аспарт/инсулин гларгин 100 Ед/мл (1-я подгруппа), инсулин аспарт/инсулин гларгин 300 Ед/мл (2-я подгруппа), инсулин аспарт/инсулин детемир (3-я подгруппа), человеческий инсулин короткого действия/инсулин НПХ (4-я подгруппа).
Анализ различной терапии в группе базис-болюсного режима лечения показал, что применение базального инсулина гларгин 300 Ед/мл давало некоторые преимущества по контролю гликемии натощак по сравнению с НПХ-инсулинами и детемиром (р=0,048). Однако значимых различий между подгруппами по среднему уровню HbA1c, тощаковой и постпрандиальной гликемии выявлено не было (табл. 3).
Как видно из представленных данных, использование у больных СД2 базис-болюсной инсулинотерапии не давало каких-либо преимуществ по контролю гликемии по сравнению с группами базальной и микс-терапии. В то же время известно, что применение базис-болюсного режима введения инсулина связано с большей суммарной дозой инсулина, высоким риском гипогликемий, способствующих увеличению массы тела, большим числом инъекций (увеличением кратности инъекций до 4–5 раз в сутки).
В группе базальной инсулинотерапии участники применяли инсулин гларгин 100 Ед/мл, гларгин 300 Ед/мл, инсулин детемир и НПХ-инсулины.
Участники подгруппы генно-инженерного человеческого инсулина средней продолжительности действия были старше, с большей длительностью заболевания и инсулинотерапии, средняя суточная доза была больше, однако каких-либо значимых различий по этим показателям выявлено не было выявлено. В связи с малочисленностью групп для представления данных были использована медиана и квантили (Q1 и Q3).
Был выявлен значимо лучший контроль гликемии натощак (р=0,013) в подгруппе инсулина гларгин 100 Ед/мл по сравнению с инсулином детемир (табл. 4).
В группе комбинированной инсулинотерапии подавляющее большинство участников (91,5%) получали инсулин аспарт двухфазный 30/70. Каких-либо значимых различий по изучаемым показателям выявлено не было.
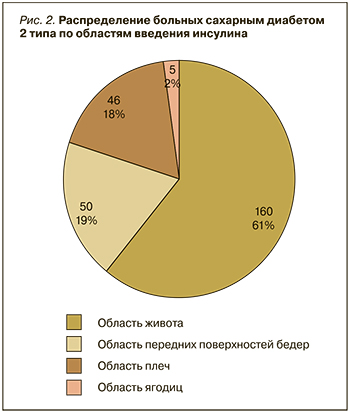 Анализ распределения участников исследования по степени компенсации СД2 показал, что в группе базис-болюсной схемы инсулинотерапии только один из трех пациентов достигал целевого контроля гликемии (рис. 1). В то же время в группе базальной инсулинотерапии почти у половины пациентов был достигнут целевой уровень HbA1с<7%. Таким образом, применение базис-болюсного режима введения инсулина не давало каких-либо преимуществ по достижению контроля гликемии (р=0,039).
Анализ распределения участников исследования по степени компенсации СД2 показал, что в группе базис-болюсной схемы инсулинотерапии только один из трех пациентов достигал целевого контроля гликемии (рис. 1). В то же время в группе базальной инсулинотерапии почти у половины пациентов был достигнут целевой уровень HbA1с<7%. Таким образом, применение базис-болюсного режима введения инсулина не давало каких-либо преимуществ по достижению контроля гликемии (р=0,039).
В результате ретроспективного анализа было выявлено, что у трети обследованных пациентов наблюдались гипогликемии различной степени тяжести. Чаще эпизоды снижения уровня глюкозы до 3,9 ммоль/л и ниже фиксировались пациентами, получавшими базис-болюсную инсулинотерапию (35,8%). Значительно реже (21,05%) гипогликемические состояния наблюдались у пациентов, получавших инсулинотерапию в базальном режиме. Участники, получающие комбинированные инсулины, заявили о наличии гипогликемий в 27,9% случаев. Значимых различий не было (р=0,18), однако любые эпизоды гипогликемий представляют серьезную опасность для больных СД2.
Таким образом, анализ данных большой группы пациентов с СД2 на инсулинотерапии свидетельствует о том, что большинство больных (62,9%) не достигают целевых значений HbA1c, несмотря на использование базис-болюсной схемы, высокие дозы и современные аналоги человеческого инсулина. Применение базис-болюсной схемы инсулинотерапии у больных СД2 требует больших усилий со стороны больного, сопряжено с высокими дозами инсулина, риском гипогликемий, нарастанием массы тела и, вероятно, нецелесообразно для больных СД2.
В достижении компенсации углеводного обмена важную роль играет правильная техника инъекций инсулина. Неверное выполнение инъекций ведет к увеличению вариабельности гликемии, что, в свою очередь, является одним из факторов появления осложнений СД и препятствует достижению оптимального контроля гликемии.
Рекомендованными местами для введения инсулина являются передняя поверхность брюшной стенки, передние поверхности бедер, ягодицы и плечи [8]. Наиболее часто (61%) участники исследования вводили инсулин в область живота, меньше всего (2%) использовалась область ягодиц (рис. 2). Часть пациентов использовали последовательно несколько областей для инъекций.
Однако большинство участников не придерживались какой-либо схемы ротации мест инъекций, а вводили инсулин на площади всего несколько квадратных сантиметров вокруг пупка (87% опрошенных).
В настоящий момент известно, что длинные иглы (≥8 м) увеличивают риск осложнений при внутримышечном введении инсулина и не имеют преимуществ в плане улучшения гликемического контроля. Иглы 4 мм для шприц-ручек признаны самыми безопасными, независимо от возраста, пола и индекса массы тела [8]. Наибольшее число участников использовали иглы для шприц-ручек длиной 8 мм – 121 (68%), 4 мм –15 (6,7%), 5 мм – 2, 6 мм – 44 участника, а иглами длиной 12 мм пользовались 2 пациента. Только 18 (10%) человек производили смену иглы после каждой инъекции, 38% – при смене шприц-ручки, 3 опрошенных использовали 1 иглу на 2 шприц-ручки.
Появление липогипертрофий является частым осложнением инсулинотерапии. Абсорбция инсулина из области поврежденной подкожно-жировой клетчатки может быть непредсказуемой и приводить как к гипергликемии, так и к непредсказуемым гипогликемиям, тем самым увеличивая вариабельность гликемии [8]. Распространенность липогипертрофий в исследовании составила 12%, причем в 86% случаев липогипертрофии располагались вокруг пупка.
В нескольких исследованиях было показано, что комбинированные инсулины часто неадекватно ресуспензируются пациентами, что ведет к увеличению вариабельности действия данного вида инсулина [8]. Из подгруппы пациентов, получающих НПХ и комбинированные инсулины, 16% опрошенных не производили ресуспензирование инсулина перед инъекцией. Из 53 человек, перемешивающих «мутные» инсулины перед инъекцией, 19 (36%) человек трясли шприц-ручки, что является недопустимой методикой. Только 9 (5%) человек сообщили, что пропускают инъекции инсулина.
Использовали правильную технику инъекций инсулина (соблюдение ротации мест инъекций, при необходимости формирование кожной складки или ввод иглы под углом 45°, смена иглы после каждой инъекции, счет до 10 после введения иглы и нажатия кнопки поршня шприц-ручки) всего 2,8% участников.
ОБСУЖДЕНИЕ
К настоящему времени в мире накоплен достаточно большой опыт проведения эпидемиологических исследований среди пациентов с СД2. В России, начиная с 2008 г., для анализа типичной практики лечения СД2 было проведено 4 проспективных наблюдательных исследования: международное исследование IMPROVE (2008), многоцентровое национальное исследование A1chieve (2008–2010), ДИА-КОНТРОЛЬ (2010–2011) [6], наблюдательное многоцентровое эпидемиологическое исследование ФОРСАЙТ-СД2 (2014). В настоящем исследовании проанализирована эффективность применения инсулинотерапии и параметры контроля гликемии у пациентов с СД2 в Череповце.
В исследовании ФОРСАЙТ-СД2 было установлено, что в 2014 г. примерно у трети (36%) обследованных пациентов отмечался неадекватный гликемический контроль [1]. В исследовании пациентов с СД2 в Череповце уровень HbA1c >8% наблюдался у 41,4% участников. Средний уровень HbA1c среди пациентов, находящихся на инсулинотерапии, в исследовании ФОРСАЙТ-СД2 составил 8,8±2,0%, гликемии натощак – 8,7±3,1 ммоль/л и постпрандиально – 14,5±2,9 ммоль/л [6]. В исследовании Череповецкого диабетологического центра средние показатели гликемического контроля были несколько лучше: HbA1c – 7,84±1,62%, гликемии натощак – 9,1±2,86 ммоль/л, постпрандиально – 10,93±3,55 ммоль/л.
В обследованной группе пациентов с СД2 в исследовании ФОРСАЙТ-СД2 лечение инсулином получали 26,7%. На базис-болюсном режиме инсулинотерапии находились 37,8% больных, на комбинированной терапии – базальный инсулин+ПССП – 53,5%, терапию микс-инсулинами получали 8,7% пациентов с СД2 [6]. В проведенном исследовании 52% участников получали базис-болюсную схему инсулинотерапии, базальную терапию получали 21,5%, смешанные инсулины – 26,5%. Пациенты с СД2 Череповца чаще использовали базис-болюсную схему инсулинотерапии и смешанные инсулины. В то же время использование базис-болюсной инсулинотерапии не дает клинических преимуществ в плане улучшения контроля гликемии.
Известно, что большинство больных СД2 не соблюдают рекомендации по технике инъекций инсулина и имеют низкую приверженность лечению. Так, в многонациональном исследовании [17], посвященном оценке приверженности пациентов СД2 инсулинотерапии, было показано, что 35% опрошенных пропускали инъекции инсулина [17]. По мнению большинства исследователей, при СД2 наблюдается неудовлетворительная (низкая) приверженность лечению, что является причиной прогрессирования осложнений (например, сердечно-сосудистых заболеваний, ретинопатии, невропатии, нефропатии) и приводит к увеличению частоты госпитализаций и повышению уровня смертности [18]. В исследовании, проведенном на базе Череповецкого диабетологического центра, показано, что большинство больных не соблюдают правила и технику инъекций инсулина. Приверженность больных СД2 лечению также невысокая.
ВЫВОДЫ
- У большинства пациентов СД2 контроль гликемии был неудовлетворительным. Целевого контроля гликемии достигли 36,9% участников исследования.
- Применение базис-болюсного режима и больших доз препаратов инсулина не имеет каких-либо преимуществ в достижении адекватного контроля гликемии. Участники группы базис-болюсной инсулинотерапии получали суточную дозу инсулина в 3 раза бóльшую (69,71 Ед) по сравнению с участниками группы базальной инсулинотерапии (24,89 Ед).
- Оптимальным вариантом для пациентов с СД2 представляется режим базальной инсулинотерапии в сочетании с диетой, физическими нагрузками и ПССП. Число пациентов с целевым значением HbA1c было значимо больше, а суммарная доза инсулина была значимо меньше в группе больных, получавших базальную инсулинотерапию.
- В большинстве случаев больные СД2 нарушают технику введения инсулина. Всего 2,8% пациентов вводили инсулин согласно рекомендациям, что доказывает низкую приверженность лечению и недостаточную осведомленность в вопросах инсулинотерапии.



