Остеоартрит (ОА) является шестой по значимости причиной инвалидности в мире, основной причиной ограниченной активности и низкого качества жизни. Прогнозируется, что к 2020 г. ОА выйдет на четвертое место среди причин инвалидности.
ОА коленного сустава может существенно способствовать увеличению терапевтических затрат [1–4]. Учитывая, что на сегодняшний день большинство пациентов обращается за помощью уже при стойком болевом синдроме и с 3–4 рентгенологической стадией ОА, его терапия представляет большие трудности: на практике не всегда удается достичь существенного клинического эффекта в отношении купирования боли и торможения структурного прогрессирования заболевания, что приводит к эндопротезированию сустава. Соответственно актуальным вопросом является терапия ОА на ранних стадиях с учетом и коррекцией модифицируемых факторов риска. Следует отметить, что в настоящее время у пациентов с патологией суставов в анамнезе наблюдается несколько заболеваний (кардиоваскулярных, метаболических и др.), имеющих общие патогенетические аспекты и оказывающих взаимное негативное влияние, что еще больше осложняет ведение данной группы больных [5–7].
ОА рассматривается как мультифакторный процесс. В основе развития дегенеративно-деструктивного заболевания суставов лежит генетическая предрасположенность, биомеханические и метаболические изменения, взаимодействующие друг с другом и только частично связанные с возрастными изменениями [8].
Хотя патофизиологические механизмы ОА до конца не изучены, появляется все больше доказательств, что метаболические факторы могут способствовать инициации и прогрессированию процесса [9]. Метаболический синдром является распространенным нарушением обмена веществ, которое возникает в результате увеличения распространенности ожирения и связано с повышенным риском сердечно-сосудистых заболеваний (ССЗ). Недавно метаболический остеоартрит был признан в качестве пятого компонента метаболического синдрома [10], поскольку ОА был классифицирован по трем фенотипам, включая метаболический, возрастной и связанный с травмой. Принимая во внимание общие механизмы, ученые пришли к выводу, что метаболический синдром тесно связан с ОА, а тот, в свою очередь, выступает частью генерализованного метаболического расстройства [11].
Ожирение относится к общепризнанным факторам риска ОА коленных суставов, что связано с повышенной биомеханической нагрузкой [12]. Однако связь ОА с метаболическим синдромом более многогранна, поскольку люди с избыточным весом и ожирением имеют аналогичный повышенный риск ОА суставов кистей, которые не несут веса, что объясняется системными факторами [13]. Вероятно, системная связь между ОА и метаболическим синдромом обусловлена измененным метаболизмом и воспалением. В течение последних нескольких десятилетий как ОА, так и метаболический синдром все чаще признавались воспалительными состояниями слабой степени с повышением системных воспалительных маркеров, таких как высокочувствительный С-реактивный белок (вчСРБ) [14]. Для обоих субъектов существуют четкие патогенные роли медиаторов воспаления, таких как интерлейкин 1β (IL1β) и фактор некроза опухоли α10 (TNFα10). Кроме того, с патогенезом ОА связан лептин – провоспалительный гормон, продуцируемый макрофагами в жировой ткани, и ключевой медиатор метаболической дисрегуляции, обусловленной ожирением. Лептин наиболее известен как регулятор потребления энергии в качестве средства, подавляющего аппетит, но он также играет роль в пролиферации остеокластов и хондроцитов и синтезе коллагена [15].
Артериальная гипертензия (АГ), компонент метаболического синдрома и независимый фактор риска сердечно-сосудистых и цереброваскулярных заболеваний, признана третьей по значимости причиной инвалидности во всем мире [16].
Основная суть этой взаимосвязи заключается в том, что АГ ведет к субхондральной ишемии из-за поражения сосудов. Артериолы не справляются с высоким давлением, дилатируют и склерозируются, давление ишемизирует сосудистую стенку и оказывает повреждающее действие [9]. Все это ведет к утолщению и сужению сосудов. Перфузия и диффузия в субхондральную кость более не могут обеспечить должный приток кислорода и питательных веществ. Наступает ишемия костной ткани, ее апоптоз и резорбция, возникают субхондральные кисты, диагностируемые при рентгенодиагностике [9, 17]. Ишемия порождает высвобождение множества мощнейших цитокинов: фактора роста эндотелия сосудов (VEGF), трансформирующего фактора роста бета (TGF-β), фактора роста фибробластов (FGF), тромбоцитарных факторов роста (PTGF), инсулиноподобного фактора роста один (IGF-1). Все это ведет к росту новых патологических сосудов, нарушающих архитектонику кости [18, 19]. Возникает процесс, схожий с механизмом при синдроме коронарного обкрадывания, только в костном микроциркуляторном русле: новообразованные сосуды забирают часть кровотока вместе с питательными веществами из основных артериальных путей, субхондральная ишемия усиливается. Происходит ремоделирование субхондральной кости, нарушается архитектоника, формируются остеофиты [20]. Соответственно, ишемия субхондральной кости приводит к дистрофии хряща. Таким образом, АГ приводит к ишемии самого сустава в целом, что в дальнейшем запускает патогенетический механизм воспаления внутри сустава [9].
Цель исследования – выявить особенности тяжести течения ОА у пациентов с такими компонентами метаболического синдрома, как избыточный вес и АГ.
МАТЕРИАЛ И МЕТОДЫ
Проведено комплексное обследование 52 пациентов с установленным диагнозом остеоартрит, гонартроз (критерии Altman R.D., 1995). Доля женщин среди них составила 84,6%, мужчин – 15,4%, средний возраст 60,9±8,9 лет (от 32 до 78 лет). Длительность заболевания составляла 8,75 [2,58; 26] лет (табл.).
Для оценки компонентов метаболического синдрома – ожирения и АГ – использовали критерии метаболического синдрома 2013 г. Российского кардиологического общества, где основной признак – центральный (абдоминальный) тип ожирения: окружность талии (ОТ) >80 см у женщин и >94 см у мужчин. Дополнительные критерии: АГ (артериальное давление ≥140/90 мм рт.ст.); повышение уровня триглицеридов (≥1,7 ммоль/л); снижение уровня холестерина ЛПВП (<1,0 ммоль/л у мужчин; <1,2 ммоль/л у женщин); повышение уровня холестерина ЛПНП >3,0 ммоль/л; гипергликемия натощак (глюкоза в плазме крови натощак ≥6,1 ммоль/л); нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 ч после нагрузки глюкозой в пределах ≥7,8 и ≤11,1 ммоль/л) [21]. Классификация ожирения производилась согласно критериям национальных клинических рекомендаций 2017 г. по следующим значениям ИМТ (кг/м²): <25 – нормальная масса тела; 25–29,9 – избыточный вес; 30–34,9 – ожирение 1 степени; 35–39,9 – ожирение 2 степени; ≥40 – ожирение 3 степени [22]. Классификация уровней артериального давления (АД) проводилась согласно Российским клиническим рекомендациям 2016 г.: нормальное АД – 120–129 и/или 80–84 мм рт.ст.; высокое нормальное – 130–139 и/или 85–89; АГ 1 степени – 140–159 и/или 90–99; АГ 2 степени – 160–179 и/или 100–109; АГ 3 степени –≥180 и/или ≥110 [23].
У всех пациентов проводились сбор анамнеза заболевания, объективное обследование на наличие синовита и измерение окружности сустава при помощи измерительной сантиметровой ленты, оценка лабораторных данных, определение рентгенологической стадии ОА (по Kellgren и Lawrence). Проводились оценка суставного синдрома и качества жизни в соответствии с выраженностью боли по визуально аналоговой шкале (ВАШ), индексом измерения физической функции (WOMAC), опросником оценки качества жизни (EQ-5D).
С помощью электронных весов регистрировались значения веса с последующим вычислением ИМТ по формуле: I = m/h², где m – масса тела в кг, h – рост в м. Показатели АД исследуемых пациентов регистрировались механическим тонометром. Для оценки связи между рентгенологической стадией ОА и степенью АГ использовались средние значения систолического АД в мм рт.ст.
При распределении пациентов по рентгенологической стадии чаще всего регистрировалась II стадия ОА – 57,6%. Пациенты с первой стадией заболевания составили 9,6%, с третьей – 26,9%, на четвертую стадию пришлось 5,9% больных.
Среди участников исследования с диапазоном ИМТ от 21 до 43 кг/м2 преобладали пациенты с ожирением 1 степени (38,4%). Ожирение 2 степени встречалось у 15,3% больных, 3 степени – 4%. ИМТ <30 кг/м2 имел место у 22 пациентов: 17,3% составили пациенты с нормальным весом, 25% – с избытком массы тела.
Доля пациентов с АГ была равна 69,2%. При этом АГ 1 степени страдали 66,6% пациентов, 2 степени – 30,5%, 3 степени – 2,9%.
Реактивный синовит коленных суставов был выявлен у 25 (48%) пациентов.
Статистический анализ проводился с помощью пакета прикладных программ STATISTICA 6.0 (StatSoft, USA) и Microsoft Excel 2007. В описательных статистиках данные представлены в виде M±SD, где M – среднее значение, SD – среднеквадратическое (стандартное) отклонение или в виде медианы с 25-ным и 75-ным процентилем. Для сравнения двух групп по количественному и качественному признакам использовались непараметрические U-критерий Манна–Уитни и критерий χ2 Пирсона. Корреляционный анализ проводили по методу Спирмена. Различия показателей считали статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно результатам исследования, пациенты с ожирением и ОА имели более выраженный болевой синдром. Пациенты с ожирением оценивали болевой синдром по шкале ВАШ на 1,3 балла интенсивнее, чем пациенты с ИМТ <30 кг/м² (p <0,001). Однако при детальном рассмотрении каждой последующей степени ожирения была выявлена тенденция к снижению болевого синдрома от 7,52 баллов при 1 степени ожирения и до 5 баллов при 3 степени (p <0,001). Такую тенденцию со снижением болевого синдрома при крайней степени ожирения можно объяснить тем, что пациенты меньше двигаются, не подвергая суставы нагрузке.
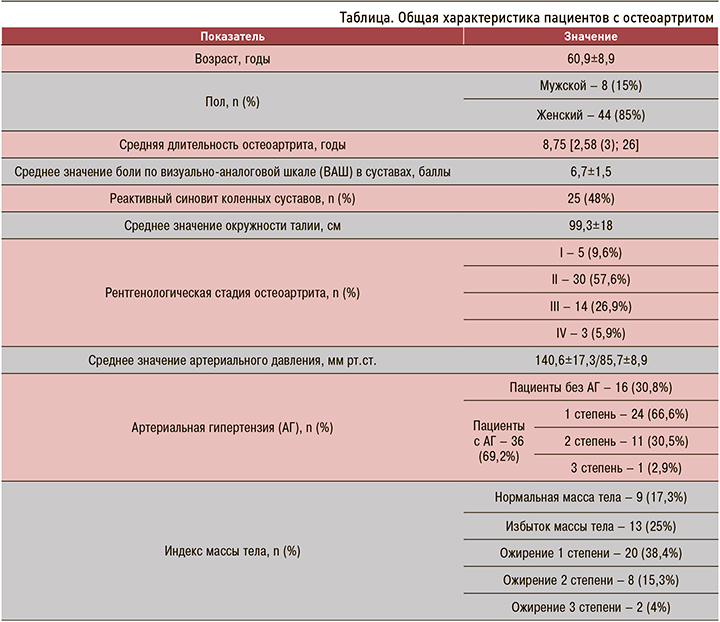
Также обсуждается роль периферической нейропатии [24, 25], характерной для метаболического синдрома. Соответственно, испытывая боль, пациенты стараются меньше двигаться, а это, в свою очередь, способствует еще большему набору веса и прогрессированию ОА. Подтверждая вышеописанное, нами выявлена высокая степень корреляции (рис. 1) рентгенологической стадии ОА с ИМТ (r=0,74; <0,001).
Реактивный синовит коленных суставов выявлен у 25 (48%) пациентов. При анализе зависимости синовита от ИМТ выявлена следующая закономерность: частота встречаемости синовита у пациентов с ИМТ <30 кг/м² равна 27%, с ИМТ >30 кг/м² – 68%. Пациенты с ожирением 1 степени имели синовиты в 65%, 2 степени – в 75%, 3 степени – в 84% случаев (p <0,05). Это подтверждает теорию воспалительной природы заболеваний с повышением провоспалительных цитокинов как при ожирении и метаболическим синдроме, так и при ОА [9–10].
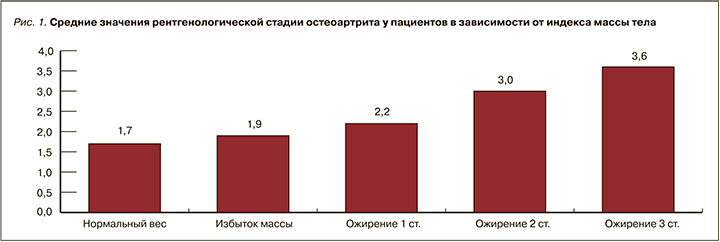
 Как уже отмечалось, среди обследуемых диагноз АГ была выявлена у 69,2% пациентов. Выявлена прямая корреляционная связь между рентгенологической стадией ОА и степенью АГ (r=0,5121; p <0,01): с каждой последующей рентгенологической стадией ОА возрастает среднее значение уровня систолического АД (рис. 2).
Как уже отмечалось, среди обследуемых диагноз АГ была выявлена у 69,2% пациентов. Выявлена прямая корреляционная связь между рентгенологической стадией ОА и степенью АГ (r=0,5121; p <0,01): с каждой последующей рентгенологической стадией ОА возрастает среднее значение уровня систолического АД (рис. 2).
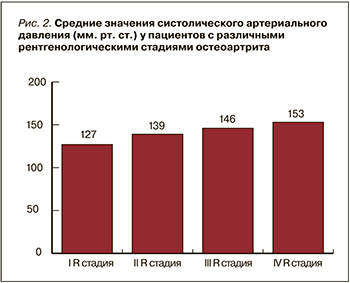
Также нами было обнаружено, что с увеличением степени АГ отмечалось усиление боли по ВАШ и усиление затруднений в повседневной деятельности по WOMAC (рис. 3) (r=0,559; p <0,05).
В целом это согласуется с литературными данными и поддерживает теорию, что болевой синдром способен активировать симпатоадреналовую систему и способствовать вазоконстрикции и повышению АД [26–27]. С другой стороны, дисфункция эндотелия и увеличение жесткости сосудистой стенки при метаболическом синдроме и АГ способствуют хронической ишемии тканей и ускоряют прогрессирование ОА [9, 18, 19].
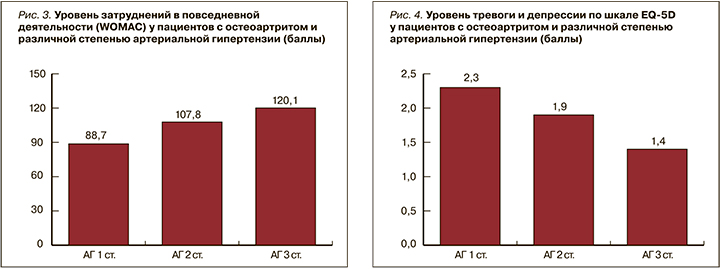
Анализируя результаты, полученные при использовании опросника EQ-5D, была обнаружена обратная тенденция: с увеличением степени АГ характерно постепенное снижение уровня тревоги и депрессии (рис. 4) (r=−0,58; p <0,05).
Несомненно, болевой синдром, ожирение, АГ не могут не оказывать влияние на психологическое состояние пациента. Так, по опроснику EQ-5D установлен следующий факт: увеличение степени ожирения ассоциируется со снижением уровня тревоги относительно тяжести своего заболевания (рис. 5).
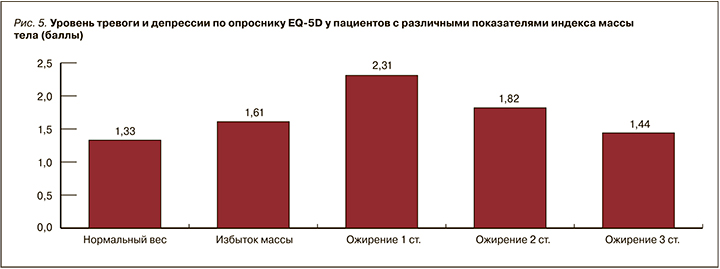
Обращает на себя внимание результат, что в большей мере за свое состояние переживают пациенты с 1 степенью ожирения и 1 степенью АГ. В то же время при крайней степени ожирения и 3 степени АГ склонность пациентов к тревоге и депрессии меньше.
Объяснить этот факт сложно. Вероятно, высокое АД приводит к патологическому воздействию на сосуды мозга, способствуя прогрессированию дегенеративных процессов, что отражается на когнитивных функциях, меняя приоритеты относительно значимости заболевания.
Также не исключается роль адипокинов в негативном влиянии на сосудистые и нервные структуры организма [28]. Возможно, развивающаяся на поздних стадиях нейропатия и отсутствие движения вместе приводят к меньшей болевой чувствительности. В результате нашего исследования мы выявили группу пациентов, которая нуждается в пристальном внимании врачей терапевтического профиля. Низкий уровень тревоги за свое здоровье и физическое благополучие (по EQ-5D) у пациентов с прогрессирующим ОА и выраженным ожирением и/или АГ может указывать на слабую приверженность к лечению, что еще больше осложняет ведение таких пациентов.
ЗАКЛЮЧЕНИЕ
Пациенты с ОА и ожирением имеют более выраженный болевой синдром. Помимо этого, ожирение способствует развитию реактивного синовита и прогрессированию рентгенологической стадии ОА.
Наличие АГ ассоциируется с увеличением болевого синдрома, снижением функциональной способности (WOMAC), усугублением рентгенологической стадии ОА и усилением депрессии.
При наличии компонентов метаболического синдрома в умеренной стадии ОА проявляется повышенным уровнем тревожности. Однако дальнейшее прогрессирование ожирения и АГ при ОА сопровождаются снижением уровня тревожности. Низкий уровень тревоги и депрессии у пациентов с прогрессирующим ОА и выраженным ожирением и/или поздними степенями АГ – основание для настороженности врачей терапевтического профиля, так как данная группа может иметь слабую приверженность к лечению и высокие риски кардиоваскулярных катастроф.



