АНЦА-ассоциированные васкулиты (ААВ) – группа заболеваний с развитием некротизирующего гранулематозного воспаления стенок мелких и средних сосудов, связанного с циркулирующими аутоантителами к цитоплазме нейтрофилов (АНЦА – антинейтрофильные цитоплазматические антитела) [1]. Органы-мишени – верхние дыхательные пути, легкие и почки. АНЦА-ассоциированный гломерулонефрит (АНЦА-ГН) характеризуется быстро прогрессирующим течением, может выступать в качестве изолированного почечного васкулита или развиваться в результате поражения почек при ААВ [1]. У 10–20% пациентов с АНЦА-ГН в сыворотке крови АНЦА не обнаруживаются [2]. Клинические наблюдения продемонстрировали, что отсутствие АНЦА у данных пациентов ассоциировано с увеличением тяжести тубулоинтерстициального фиброза и ухудшением почечного прогноза [2].
АНЦА – группа антител преимущественно иммуноглобулинов класса G (IgG), взаимодействующих на поверхности эндотелия с антигенами гранул цитоплазмы нейтрофилов и лизосом моноцитов (протеиназой-3, миелопероксидазой, лактоферрином, катепсином G, эластазой и др.). Известны два основных типа иммунофлуоресцентного свечения АНЦА: цитоплазматическое, характерное для антител нейтрофилов к протеиназе-3 (ц-АНЦА), и перинуклеарное, характерное для антител к миелопероксидазе (п-АНЦА) [1].
В настоящее время, согласно классификации, принятой в 2012 г. на согласительной конференции в Chapel Hill, к ААВ относят следующие нозологические формы: гранулематоз с полиангиитом (ГПА), эозинофильный гранулематоз с полиангиитом (ЭГПА) и микроскопический полиангиит (МПА) [3]. При этом для ГПА наиболее специфичными являются ц-АНЦА, для ЭГПА – п-АНЦА, для МПА – как ц-АНЦА, так и п-АНЦА [1]. МПА представляет собой заболевание неясного генеза, в основе которого лежит васкулит мелких сосудов без формирования гранулем. МПА имеет быстро прогрессирующее течение с развитием осложнений, приводящих к летальному исходу. Причиной смерти обычно являются массивные легочные кровотечения, инфекционные осложнения. Редкость патологии создает дополнительные трудности своевременной диагностики заболевания. Клинические проявления заболевания многообразны. Чаще всего в дебюте развивается гриппоподобный синдром с субфебрильной, реже фебрильной температурой тела, миалгиями, артралгиями и кожными петехиальными высыпаниями на конечностях. Другим вариантом начала болезни может быть поражение верхних дыхательных путей (ринит, синусит, средний отит), в большинстве случаев без развития эрозий и язв слизистых оболочек и без деструкции мягких тканей [4–6].
IgA-нефропатия – иммунокомплексный гломерулонефрит (ГН), развитие которого обусловлено отложением в мезангии клубочков IgA с измененной молекулярной структурой [1]. Обсуждается роль IgG АНЦА в патогенезе развития IgA-нефропатии. В литературе имеются данные о развитии IgA-нефропатии при наличии АНЦА [7–9].
Приводим клинические наблюдения, демонстрирующие особенности клинического течения АНЦА-ассоциированных васкулитов.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 1
Больной М., 59 лет. Впервые был госпитализирован в пульмонологическое отделение ГУЗ «Областная клиническая больница» (ОКБ) г. Саратова в феврале 2013 г. Из анамнеза известно, что болен с февраля 2012 г., когда появились кашель, повышение температуры до 39 °С, слабость. Впервые отмечено повышение скорости оседания эритроцитов (СОЭ) до 50 мм/ч. Амбулаторно установлено наличие внебольничной пневмонии, проводилась антибактериальная терапия. На этом фоне температура нормализовалась, СОЭ снизилась до 24 мм/ч. Изменений в биохимическом анализе крови и общем анализе мочи не было. Сохранялась общая слабость. Через 2 мес отмечено повышение артериального давления (АД) до 160/100 мм рт.ст. В анализе мочи выявлена протеинурия до 0,16 г/л, в общем анализе крови – СОЭ 50 мм/ч. Назначена антигипертензивная терапия с положительным эффектом. С июня 2012 г. появились боли в коленных суставах, сохранялась общая слабость.
С декабря 2012 г. отметил повышение температуры до фебрильных цифр, малопродуктивный кашель, кровохарканье, одышку смешанного характера при умеренной физической нагрузке. В январе 2013 г. был госпитализирован, диагностирована правосторонняя полисегментарная пневмония. Впервые выявлена анемия (гемоглобин 90 г/л, эритроциты 2,9 млн/мкл), отмечено повышение СОЭ до 71 мм/ч. Проводилась антибактериальная терапия левофлоксацином и цефотаксимом – без эффекта.
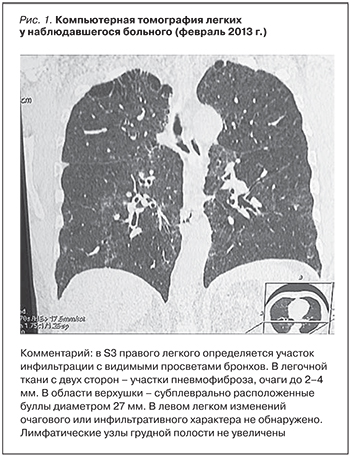 При поступлении в ОКБ при объективном обследовании выявлена крепитация в базальных отделах легких с двух сторон, больше справа; повышение АД до 180/100 мм рт.ст. При рентгенографии легких (01.02.2013) установлено наличие инфильтрации в S3, 4, 8, 9 справа. Корни гомогенизированы, в прикорневых зонах усиление легочного рисунка. Заключение: правостороння полисегментарная пневмония. При компьютерной томографии (КТ) легких (08.02.2013, рис. 1) инфильтративно-фиброзно-очаговые изменения в легких. КТ-картина может быть характерна для специфического процесса. Буллы в верхних отделах легких.
При поступлении в ОКБ при объективном обследовании выявлена крепитация в базальных отделах легких с двух сторон, больше справа; повышение АД до 180/100 мм рт.ст. При рентгенографии легких (01.02.2013) установлено наличие инфильтрации в S3, 4, 8, 9 справа. Корни гомогенизированы, в прикорневых зонах усиление легочного рисунка. Заключение: правостороння полисегментарная пневмония. При компьютерной томографии (КТ) легких (08.02.2013, рис. 1) инфильтративно-фиброзно-очаговые изменения в легких. КТ-картина может быть характерна для специфического процесса. Буллы в верхних отделах легких.
Выявлены анемия (гемоглобин 74 г/л, эритроциты 2,64 млн/мкл), снижение удельного веса мочи (1010), щелочная реакция мочи, протеинурия (0,64 г/л), лейкоцитурия (4–8 в поле зрения), эритроцитурия (до 100 в поле зрения), СОЭ 66 мм/ч, С-реактивный белок (СРБ) 192 мг/л. Эритроцитурия носила непостоянный характер: от 1–2 до 100 в поле зрения по данным общего анализа, от 48 700 до 405 000 в пробе Нечипоренко. Суточная протеинурия 0,7 г. Впервые выявлено повышение уровня креатинина крови до 438,9 мкмоль/л. Ревматоидный фактор и волчаночный антикоагулянт отрицательные. При осмотре отоларингологом выявлен хронический субатрофический ринофарингит.
Учитывая анемию, повышение СОЭ, возраст пациента, признаки поражения почек, КТ-картину легких, отсутствие рентгенологической динамики на фоне антибактериальной терапии, проводилась дифференциальная диагностика между васкулитом, неопластическим и специфическим процессами. Была предпринята попытка нефробиопсии – неудачно (во время процедуры развился судорожный припадок). В процессе обследования данных в пользу наличия туберкулеза, онкопатологии получено не было.
До ноября 2013 г. чувствовал себя относительно удовлетворительно, одышка беспокоила лишь при физической нагрузке; кашля, лихорадки не было. Лабораторно сохранялась анемия, повышение СОЭ (47–60 мм/ч), протеинурия (до 0,5 г/л), азотемия (креатинин 251 мкмоль/л). Получал антигипертензивную терапию, препараты железа. С ноября 2013 г. лихорадка до 38 °С, кровохарканье, заложенность носа, одышка при физической нагрузке, припухлость правого коленного сустава. Лабораторно: СОЭ 54 мм/ч, в общем анализе мочи: белок 0,13 г/л, микрогематурия. Исследовались АНЦА, антитела к базальной мембране – результаты отрицательные.
В декабре 2013 г. госпитализирован в ревматологическое отделение ОКБ. В процессе обследования данных в пользу гранулематозного поражения верхних дыхательных путей не выявлено, АНЦА отрицательные. По данным КТ легких: внутригрудная лимфаденопатия, интерстициальное поражение легких. Сохранялось повышение СОЭ (26 мм/ч), вчСРБ (5,9 мг/л), азотемия (креатинин 190 мкмоль/л), протеинурия (1,5 г/сут), микрогематурия.
Выставлен диагноз «недифференцированный васкулит с поражением легких, почек (ГН, стадия С3 ХБП)». Назначен преднизолон 30 мг/сут внутрь. В марте 2014 г. выполнена нефробиопсия. По результатам световой микроскопии и иммунофлуоресценции (ООО «Национальный центр клинической морфологической диагностики», Санкт-Петербург) установлено наличие склерозирующего ГН с выраженным тубулоинтерстициальным компонентом. Данных, свидетельствующих о поражении почек в рамках системного васкулита или синдрома Гудпасчера, не получено (не выявлено экстракапиллярных полулуний, специфического свечения иммуноглобулина вдоль базальной и тубулярной мембран).
В марте 2014 г., учитывая положительную динамику на фоне приема преднизолона (суточная протеинурия 0,27 г при отсутствии гематурии, стабилизация азотемии: креатинин 203 мкмоль/л, исчезновение кровохарканья, лихорадки), решено начать программную терапию глюкокортикоидами и цитостатиками. Доза преднизолона была снижена до 15 мг/сут. Выполнялось внутривенное введение метилпреднизолона по 500–750 мг (3 введения) и циклофосфамида по 600–800 мг 1 раз в месяц в течение года. На фоне терапии отмечена положительная динамика.
В октябре 2014 г. при повторном исследовании выявлены положительные АНЦА к миелопероксидазе. С ноября 2014 по февраль 2016 г. проводилась терапия преднизолоном по 10 мг и азатиоприном по 50 мг/сут. В феврале 2016 г. в связи с активацией процесса (усиление одышки, увеличение протеинурии) возобновлена терапия глюкокортикоидами и цитостатиками (преднизолон по 1000 мг и циклофосфамид по 1000 мг). Через 2 мес отмечена положительная динамика.
В апреле 2016 г. пациент был проконсультирован в клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева Первого МГМУ им. И.М. Сеченова. Диагноз «микроскопический полиангиит, АНЦА-ассоциированный васкулит (положительные антитела к миелопероксидазе), с поражением легких, почек (хронический ГН – морфологически с фокально-сегментарным гломерулосклерозом, ХБП стадия С4), хроническое течение». Продолжена активная терапия циклофосфаном внутривенно по 1000 мг № 6 каждые 3 мес. На этом фоне состояние пациента оставалось стабильным, одышка не нарастала, суточная протеинурия была отрицательной.
При госпитализации в январе 2018 г. самочувствие пациента удовлетворительное, отеков нет, одышка не беспокоит, СОЭ 21 мм/ч, СРБ отрицательный, уровень креатинина стабильный (190–204 мкмоль/л), суточная протеинурия отрицательная. Продолжает прием поддерживающей дозы преднизолона (5 мг/сут) и циклофосфана (200 мг в неделю).
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 2
Пациентка Х., 53 года. В течение 7 лет отмечает повышение АД до 150 и 100 мм рт.ст., при амбулаторном обследовании в анализах мочи выявлялась протеинурия до 0,6 г/л, микрогематурия. Эпизодически получала антигипертензивную терапию. При госпитализации в июле 2015 г. по поводу неконтролируемой артериальной гипертензии выявлен мочевой синдром (микрогематурия, протеинурия до 1,23 г/сут). С учетом клинической картины и лабораторных данных диагностирована гипертензивная форма хронического ГН, рекомендована нефропротективная терапия ингибиторами ангиотензинпревращающего фермента.
 С лета 2016 г. появилась общая слабость, заложенность носа и слизисто-кровянистые выделения из носа. В октябре 2016 г. госпитализирована в нефрологическое отделение. При обследовании выявлены анемия (гемоглобин 74 г/л), азотемия (креатинин крови 355 мкмоль/л), в анализах мочи микрогематурия, суточная протеинурия 1,3 г. Проводилась дифференциальная диагностика между идиопатическим хроническим ГН и поражением почек в рамках системных заболеваний (системная красная волчанка, системные васкулиты). При иммунофлуоресценции в крови выявлены нетипичные АНЦА (нАНЦА) 1:320. Антитела к ДНК, ревматоидный фактор не обнаружены. По данным компьютерной томографии – пансинусит, полостное образование в нижней доле правого легкого, интерстициальные изменения с двух сторон.
С лета 2016 г. появилась общая слабость, заложенность носа и слизисто-кровянистые выделения из носа. В октябре 2016 г. госпитализирована в нефрологическое отделение. При обследовании выявлены анемия (гемоглобин 74 г/л), азотемия (креатинин крови 355 мкмоль/л), в анализах мочи микрогематурия, суточная протеинурия 1,3 г. Проводилась дифференциальная диагностика между идиопатическим хроническим ГН и поражением почек в рамках системных заболеваний (системная красная волчанка, системные васкулиты). При иммунофлуоресценции в крови выявлены нетипичные АНЦА (нАНЦА) 1:320. Антитела к ДНК, ревматоидный фактор не обнаружены. По данным компьютерной томографии – пансинусит, полостное образование в нижней доле правого легкого, интерстициальные изменения с двух сторон.
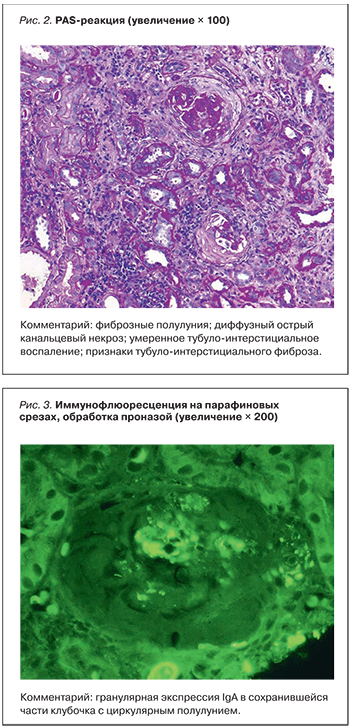
С целью морфологической верификации диагноза выполнена диагностическая нефробиопсия, выявившая картину IgA-нефропатии. Заключение: IgA-нефропатия, Oxford-2009 M1E1S1T2 (незначительная мезангиальная и эндокапиллярная гиперклеточность; полный (54%) и обширный сегментарный (19%) гломерулосклероз; полулуния (27%) клеточные и фиброзные (соотношение 1:1), диффузный острый канальцевый некроз, умеренное тубулоинтерстициальное воспаление, выраженный тубулоинтерстициальный фиброз (60%), тяжелый артериосклероз с резким сужением просвета сосуда (рис. 2, 3).
С учетом клинико-лабораторной симптоматики и данных нефробиопсии высказано предположение о наличии у больной сочетанного механизма повреждения почек (АНЦА-позитивный, экстракапиллярный нефрит и IgA-нефропатия). Клинический диагноз «АНЦА-ассоциированный васкулит с поражением почек (ANCA-позитивный экстракапиллярный ГН, IgA-нефропатия), легких (очагово-интерстициальные изменения с формированием полостей распада), кожи, пансинусит».
Начата иммуносупрессивная терапия (ИСТ) преднизолоном по 60 мг/сут и циклофосфаном в виде внутривенных инфузий по 1000 мг каждые 4 нед. Через 2 мес появились отеки нижних конечностей до уровня колен, одышка в покое, геморрагические высыпания на коже передней поверхности живота и нижних конечностей, тахикардия. При обследовании выявлен нефротический синдром (протеинурия 3,51 г/сут, общий белок крови 55 г/л, альбумин 30 г/л), нарастание креатинина до 584 мкмоль/л. Эффекта от проводимой терапии не было. Начата заместительная почечная терапия гемодиализом.
При КТ легких выявлен гидропневмоторакс справа, при исследовании плевральной жидкости гнойное содержимое. Выполнено дренирование плевральной полости, назначена антибактериальная терапия. Учитывая наличие инфекционных осложнений, от продолжения ИСТ решено воздержаться, начато медленное снижение дозы преднизолона. В динамике отмечено развитие инфаркта головного мозга в бассейне средней мозговой артерии (по данным магнитно-резонансной томографии, эпизод психомоторного возбуждения с травматическим переломом костей лицевого черепа справа). Продолжена заместительная почечная терапия гемодиализом в режиме 12 ч в неделю. Через 2 нед при явлениях нарастающей общемозговой симптоматики пациентка скончалась.
ОБСУЖДЕНИЕ
Микроскопический полиангиит относится к группе системных ААВ, характеризуется упорным, прогрессирующим течением, контролировать которое чрезвычайно сложно [10]. В последние годы достигнуты значительные успехи в изучении иммунопатогенеза ААВ [11]. Доказано, что АНЦА не являются серологическим маркером ААВ, но играют значительную патогенетическую роль в их развитии [11, 12]. АНЦА усиливают адгезию нейтрофилов к эндотелию, способствуют их дегрануляции с высвобождением окислительных метаболитов, провоспалительных цитокинов, активации лимфоцитов, моноцитов, системы комплемента [2, 11, 12]. В настоящее время обнаружено, что патогенетическую роль могут играть антитела к лизосом-ассоциированному мембранному протеину-2 (anti-LAMP-2) [2, 11, 12]. Они способствуют активации нейтрофилов, индуцируют апоптоз эндотелиальных клеток и развитие малоиммунного ГН.
Как самостоятельное заболевание МПА описано только в 1985 г. британскими исследователями [6]. В последующем установлено повышение содержания АНЦА при МПА. В настоящее время выделяют два иммунологических варианта МПА. Один вариант характеризуется высокими показателями антител к миелопероксидазе, как в представленном клиническом наблюдении, другой – к протеиназе-3 [5].
В последние годы наметилось улучшение прогноза МПА, что связанно с расширением возможностей диагностики, позволяющей начать активную терапию на ранней стадии болезни, широким внедрением циклофосфамида и разработкой нового класса препаратов, способных эффективно контролировать заболевание путем истощения (и/или модуляции функции) В-клеток. Вместе с тем ранняя диагностика МПА по-прежнему представляет трудности для врачей различных специальностей, что в первую очередь связано с поражением многих органов, разнообразием клинических вариантов течения.
В первом клиническом наблюдении продемонстрировано развитие микроскопического полиангиита с поражением почек и легких с положительным эффектом ИСТ, несмотря на достаточно позднюю диагностику заболевания. Одной из причин поздней диагностики в данном случае являются отрицательные тесты АНЦА в начале заболевания, что не позволило отнести клиническую картину, имевшуюся у пациента, к ААВ. При анализе течения МПА у 70 пациентов Т.В. Бекетова [10] отмечает, что более неблагоприятный вариант течения с худшим прогнозом отмечается в первые два года у пациентов с высокими показателями антител к протеиназе-3, в последующем эта разница между иммунологическими вариантами заболевания нивелируется. Принципиально важно как можно раньше диагностировать заболевание и своевременно начать адекватное лечение [10]. В нашем клиническом наблюдении лечение глюкокортикоидами и цитостатиками было начато относительно рано, что позволило обеспечить сохранение жизни пациента в течение 5 лет наблюдения.
Из органных поражений в начале заболевания у пациента доминировало поражение почек и легких. По данным литературы, поражение почек при МПА чаще проявляется гематурией и протеинурией различной степени, которая сравнительно редко достигает нефротического уровня [13]. Поражение почек при МПА характеризуется более высокой протеинурией и гематурией и более частым, чем при других АНЦА-васкулитах, развитием артериальной гипертензии и клинической картины быстро прогрессирующего нефрита (БПГН) [13]. Быстрое снижение почечных функций, характерное для БПГН, мы наблюдали и у нашего пациента. Обращают на себя внимание трудности трактовки морфологических изменений в нефробиоптате, не выявивших типичного для ААВ экстракапиллярного ГН. Вероятно, обнаруженный фокальный и сегментарный гломерулосклероз явился следствием достаточно поздней стадии почечного процесса.
Согласно данным литературы, поражение легких встречается в 25–73% случаев МПА [10]. МПА отличает наиболее высокая частота поражения легких в манифестную фазу болезни и склонность к формированию диффузного или ограниченного легочного фиброза, что мы наблюдали у нашего пациента. По данным литературы [10], МПА – заболевание, склонное к рецидивированию, что мы также отмечали в данном клиническом наблюдении. Своевременная коррекция терапии способствовала быстрому купированию обострения и стабилизации состояния пациента.
Второе клиническое наблюдение демонстрирует развитие ААВ с поражением почек, легких и верхних дыхательных путей. Особенностью поражения почек явился сочетанный механизм почечного повреждения: АНЦА-позитивный, экстракапиллярный ГН и IgA-нефропатия.
В литературе описано несколько случаев сочетанного механизма почечного повреждения: развитие IgA-нефропатии при наличии АНЦА [7–9]. По данным исследования O’Donoghue (1992), у двух из ста пациентов с IgA-нефропатией выявлено наличие АНЦА [7]. У обоих пациентов обнаружены антитела к миелопероскидазе. Haas и соавт. (2000) описали 6 пациентов с IgA-нефропатией и наличием АНЦА, из которых у 5 выявлены АТ к протеиназе-3, у 1 – к миелопероксидазе [7]. У всех пациентов с наличием антител к протеиназе-3 при обследовании выявлена протеинурия (у 2 пациентов регистрировался нефротический синдром), повышение уровня креатинина, по данным нефробиопсии выявлены экстракапиллярные полулуния. Ya-zi Yang и соавт. (2015) продемонстрировали данные ретроспективного анализа историй болезней пациентов с IgA-нефропатией [7]. Наличие АНЦА выявлено у 20 из 1729 пациентов (1,2%), из них у 9 пациентов, по данным нефробиопсии, обнаружена картина экстракапиллярного ГН. Опубликованы противоречивые результаты о влиянии АНЦА на тяжесть клинического течения АНЦА-ГН, эффективность ИСТ, прогноз заболевания [2]. Результаты большинства исследований свидетельствуют о высокой эффективности ИСТ, значительно улучшающей почечный прогноз [2, 7–9]. В данном клиническом наблюдении отмечалось тяжелое и неблагоприятное течение IgA-нефропатии, обусловленное системным характером поражения, невозможностью проведения ИСТ на фоне высокого риска повторных инфарктов головного мозга.
ЗАКЛЮЧЕНИЕ
Представленные клинические наблюдения демонстрируют клинико-морфологические особенности органной патологии при ААВ, трудности ранней диагностики МПА, а также возможность сочетанного механизма почечного повреждения при IgA-нефропатии и наличии АНЦА. Обсуждается важность раннего начала инициальной терапии при ААВ, что обусловливает необходимость тщательного анализа имеющейся клинической картины в каждом конкретном случае, планомерного обследования и длительного мониторирования состояния пациентов, в том числе АНЦА-мониторинга.



