ВВЕДЕНИЕ
Для лечения острого подагрического артрита (ПА) применяют нестероидные противовоспалительные препараты (НПВП), глюкокортикостероиды (ГКС) и колхицин. Эти противовоспалительные средства (ПВС) в большинстве случаев позволяют быстро и безопасно купировать явления артрита и болевого синдрома. Однако в определенных ситуациях даже кратковременное применение ПВС может привести к развитию значимых, и даже угрожающих нежелательных явлений, в том числе к дестабилизации коморбидных состояний. В связи с этим решение такой, казалась бы, простой задачи, как купирование острого ПА, у значительного числа пациентов требует тщательного анализа возможных рисков и мониторинга осложнений. В этом материале мы обсудим особенности лечения ПА у пациентов с наиболее распространенными заболеваниями и состояниями.
ЯЗВЕННАЯ БОЛЕЗНЬ ЖЕЛУДКА
У пациентов с язвенной болезнью желудка (ЯБЖ) для лечения острого ПА возможно применение отдельных НПВП, а в некоторых случаях – ГКС.
НПВП характеризуются высокой частотой нежелательных явлений со стороны ЖКТ, обусловленных подавлением ЦОГ-1-зависимого синтеза защитных простагландинов слизистых оболочек. Этот эффект реализуется в виде эрозивно-язвенных поражений, которые, в свою очередь, могут приводить к желудочно-кишечным кровотечениям [1]. При этом известно, что эрозивно-язвенное поражение у значительного числа пациентов развивается довольно быстро, уже через несколько дней приема НПВП [2]. В связи с этим использование НПВП у больных с обострением ЯБЖ противопоказано, а в случаях ЯБЖ в анамнезе – ограничено, но не исключено.
Пациенты с язвенным анамнезом входят в группу высокого риска НПВП-ассоциированных ЖКТ-осложнений. При необходимости назначения этого класса лекарственных средств им рекомендованы целекоксиб или эторикоксиб в сочетании с ингибиторами протонной помпы (ИПП). Строго говоря, другие НПВП для этой категории пациентов не рекомендованы, но в целом препаратами с хорошим профилем ЖКТ-безопасности, помимо указанных коксибов, считаются ацеклофенак, мелоксикам и нимесулид. В качестве профилактики ЖКТ-осложнений рекомендуется одновременное назначение ИПП, в частности пантопразола как препарата с минимальным риском лекарственных взаимодействий. Также рекомендовано учитывать факторы риска НПВП-ассоциированных ЖКТ-осложнений. К ним, кроме язвенного анамнеза, относят прием низких доз ацетилсалициловой кислоты (АСК) и/или антикоагулянтов, возраст старше 65 лет, диспепсию, курение, применение ГКС, инфицированность H. pylori [1].
Для лечения ПА, возникшего на фоне обострения ЯБЖ, возможно использование ГКС. Было показано, что у пациентов с язвенным кровотечением и острым ПА применение метилпреднизолона более эффективно, чем прием целекоксиба, а также безопасно при условии адекватного эндоскопического гемостаза и использования ИПП [3].
В действующей инструкции по применению колхицина не содержится прямых указаний относительно его применения у пациентов с ЯБЖ. Однако, учитывая хорошо известное ульцерогенное действие этого препарата, его использование при ЯБЖ можно, по-видимому, считать противопоказанным [4].
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
При назначении НПВП больным артериальной гипертензией (АГ) необходимо помнить о риске дестабилизации артериального давления (АД) вследствие ряда НПВП-ассоциированных изменений. В частности, на фоне приема НПВП возможно развитие «эффекта ускользания» – снижения гипотензивного эффекта бета-адреноблокаторов, ингибиторов АПФ и блокаторов рецепторов ангиотензина [5], но не блокаторов медленных кальциевых каналов [6] и агонистов имидазолиновых рецепторов [7]. Наряду с этим к дестабилизации АД могут приводить задержка натрия, воды и гиперкалиемия, которые также относятся к нежелательным эффектам НПВП [8]. В то же время дестабилизация АД на фоне их приема не является неизбежным осложнением. Известно, что на фоне длительной НПВП-терапии дестабилизация АД развивается у 5–7% пациентов [9]; в отношении же краткосрочного приема НПВП этот аспект не исследован.
Дестабилизирующее влияние НПВП на АД может развиваться очень быстро, в первые же дни применения препарата [10]. Факторы риска дестабилизации, помимо уже имеющейся АГ [6], включают недостаточный контроль АД, пожилой возраст, сахарный диабет 2-го типа и хронические болезни почек [10].
Препаратами, в наименьшей степени способствующими дестабилизации АД, считаются напроксен и целекоксиб [1].
Необходимо также помнить, что боль сама по себе выступает мощным фактором дестабилизации АД и резкого увеличения связанных с этим кардиоваскулярных рисков. В связи с этим вопрос скорейшего купирования острого ПА у пациента с АГ приобретает особое значение.
ХРОНИЧЕСКАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
НПВП не рекомендованы в качестве средств первой линии для лечения ПА у пациентов с хронической сердечной недостаточностью (ХСН). Это связано с рядом неблагоприятных эффектов НПВП, способствующих дестабилизации этого заболевания. Среди них задержка воды, натрия и калия, приводящие к нарастанию отеков, повышение АД, увеличение постнагрузки и др. [1, 11].
Развитие декомпенсации ХСН на фоне длительного приема НПВП считают редким осложнением [1,11], в отношении же кратковременного приема препаратов этой группы соответствующих доказательных данных нет.
Тем не менее известно, что наибольший риск декомпенсации связан с применением высоких доз НПВП, в том числе неселективных [1]. Кроме того, необходимо учитывать лекарственные взаимодействия НПВП с фуросемидом и ингибиторами АПФ, также ограничивающие их назначение при сердечной недостаточности [11].
Как наиболее безопасные НПВП у пациентов с ХСН рассматриваются напроксен и целекоксиб [1].
В контексте сердечно-сосудистой патологии необходимо учитывать и протромботические эффекты, свойственные всем НПВП и обусловливающие риск кардиоваскулярных и цереброваскулярных катастроф. Результаты многомесячных наблюдений свидетельствуют, что частота тромботических осложнений довольно высокая – они развиваются у 1–2% пациентов [1]. В отношении кратковременного приема НПВП таких сведений нет, хотя очевидно, что и кратковременное их назначение нельзя считать безопасным.
В целом выбор НПВП пациентам с сердечно-сосудистой патологией осуществляется исходя из уровня кардиоваскулярного риска. Наиболее благоприятными в этом плане считаются напроксен и целебрекс, которыми выбор НПВП для этой категории пациентов и ограничен. Пациентам с умеренным и высоким кардиоваскулярным риском возможно также назначение ибупрофена в малых дозах (не более 1200 мг/сут). Пациентам с очень высоким сердечно-сосудистым риском назначение НПВП не рекомендовано, однако в особых случаях допускается кратковременное применение напроксена в минимально эффективной дозе [1].
Колхицин противопоказан пациентам со значительной патологией сердечно-сосудистой системы в связи с такими нежелательными эффектами, как вазоконстрикция, потенциирование симпатомиметиков, усиление центральных вазомоторных реакций [12]. Однако в последнее время место колхицина в лечении кардиоваскулярных заболеваний, в том числе АГ и ХСН, пересматривается [13].
Использование ГКС (системно или внутрисуставно) у пациентов с ХСН считается более безопасным, чем НПВП и колхицина [11]. При этом рекомендованы ГКС с минимальной (или не обладающие) минералокортикоидной активностью – метилпреднизолон, триамцинолон, дексаметазон, бетаметазон.
ХРОНИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК
Тонус почечных артериол, а также экскреция натрия и воды в канальцах регулируются почечными простагландинами. НПВП подавляют их синтез, что запускает активацию множества вазоконстрикторных механизмов. У пациентов с исходно сниженной почечной перфузией это может привести к острому почечному повреждению (ОПП). Такое осложнение является полностью обратимым при условии незамедлительной отмены НПВП [1, 14]. К факторам риска преренального ОПП относятся АГ, ХСН, хроническая болезнь почек (ХБП), пожилой возраст, цирроз печени с асцитом, а также прием диуретиков, ингибиторов АПФ и ряда других лекарственных средств [15, 16]. Однако развитие этого осложнения возможно и в отсутствии предрасполагающих факторов [17].
Возможны и другие НПВП-ассоциированные почечные осложнения: острый канальцевый некроз, папиллярный некроз, интерстициальный нефрит, задержка натрия и воды и др. [1]. Потенциальная нефротоксичность свойственна всем НПВП [17]. Известно, что нефротоксические реакции отмечаются у 1–4% пациентов, однако эти данные относятся к длительному приему этой группы препаратов [15, 16].
При выборе НПВП для пациента с ХБП следует учитывать рекомендации KDIGO от 2012 г. [18]. В частности, пациентам со скоростью клубочковой фильтрации (СКФ) <30 мл/ мин/1,73м2 рекомендовано избегать их назначения. При СКФ <60 мл/мин/1,73 м2 нежелателен длительный прием НПВП, а также необходима их отмена в случае сопутствующих заболеваний, повышающих риск ОПП. Кроме того, не рекомендуется применять НПВП у пациентов, получающих ингибиторы ренин-ангиотензин-альдостероновой системы (РААС) и препараты лития.
Назначение колхицина пациентам с ХБП не рекомендовано в связи с повышенным риском токсических эффектов [19, 20]. Препарат абсолютно противопоказан при снижении СКФ <10 мл/мин/1,73 м2 и относительно противопоказан при СКФ <50 мл/ мин/1,73 м2. Таким образом, применение колхицина у пациентов со значительным снижением почечной функции в принципе возможно, но должно быть обосновано крайней необходимостью. Для купирования острого ПА у пациентов с СКФ 30–50 мл/ мин/1,73 м2 допускается прием 1,2 мг колхицина и еще 0,6 мг через час. При СКФ 10–30 мл/мин/1,73 м2 допускается такая же схема применения, но повторное использование препарата возможно только через 2 нед [21]. Помимо этого, важно помнить о возможности обратимой нейромышечной токсичности у пациентов с ХБП на фоне терапии колхицином, особенно при сопутствующем приеме циклоспорина [20].
У большинства пациентов с хронической почечной недостаточностью кратковременное использование ГКС считается более безопасным по сравнению с другими ПВС [11]. Возможно как системное, так и внутрисуставное введение этих препаратов. Коррекция дозы ГКС при хронической почечной недостаточности не требуется [22].
ТЕРМИНАЛЬНАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ, ПАЦИЕНТЫ НА ДИАЛИЗЕ
Для лечения острого ПА у пациентов, находящихся на диализе, рекомендовано использование ГКС (внутрисуставно или системно) [19].
Пациентам на гемодиализе в случае умеренной выраженности артрита допускается назначение короткого курса НПВП в минимальных эффективных дозах. При этом необходимо помнить, что на фоне гемодиализа одновременное использование антикоагулянтов и НПВП повышает риск развития кровотечений и ЖКТ-осложнений [19].
Предпочтительно использование у диализных пациентов НПВП с периодом полувыведения не более 12 ч, селективных НПВП, кроме того, следует выдерживать интервал между дозами не менее 6 ч. На весь период приема этого класса лекарственных средств диализному пациенту необходимо отменить блокаторы РААС и диуретики, а также проводить ежедневный контроль с целью своевременного выявления признаков перегрузки объемом [23].
У пациентов, находящихся на перитонеальном диализе, следует избегать применения НПВП из-за риска ухудшения функции почек. Любое их использование в этом случае в должно быть согласовано с лечащим нефрологом [19].
Применение колхицина у пациентов с подагрой, находящихся на гемодиализе, не рекомендовано, поскольку этот препарат в процессе диализа не удаляется, и, следовательно, возникает повышенный риск развития его токсических эффектов [19]. Допускается однократный прием 0,6 мг колхицина, но повторный его прием возможен не ранее чем через 2 нед [21].
ПАТОЛОГИЯ ПЕЧЕНИ
Гепатотоксичность характерна для всего класса НПВП, однако тяжелые реакции (выраженный холестаз или острая печеночная недостаточность) развиваются крайне редко [1]. Риск гепатотоксических осложнений повышен у лиц пожилого возраста, имеющих предсуществующие заболевания печени и принимающих другие гепатотоксичные средства и алкоголь. Наиболее безопасными в отношении печени считаются мелоксикам, целекоксиб и эторикокосиб [1].
Гепатотоксические эффекты колхицина описаны при его применении в сверхвысоких дозах (14–90 мг/сут), а также в единичных случаях в дозировках 2,4–4 мг/сут. Низкие дозы (до 1 мг/сут) считаются безопасными для печени даже при длительном приеме этого препарата. Противопоказанием к применению колхицина служит печеночная недостаточность в связи с нарушением его печеночного метаболизма и повышением риска других токсических эффектов [24].
Гепатотоксические эффекты ГКС реализуются при длительном применении высоких доз, а также при краткосрочном применении высоких и сверхвысоких дозировок, вводимых внутривенно [25]. В то же время купирование острого ПА подразумевает кратковременное применение средних доз, а также внутрисуставное введение ГК [26]. Сообщений о нежелательности такого лечения у пациентов с сопутствующей патологией печени в доступных литературных источниках не представлено.
САХАРНЫЙ ДИАБЕТ
Применение НПВП и колхицина при сахарном диабете ограничено в связи со снижением почечной функции, а использование ГКС несет риск гипергликемии. Однако именно назначение ГКС считают более предпочтительным способом купирования острого ПА у пациентов с сахарным диабетом, поскольку кратковременная гипергликемия неопасна и может быть быстро компенсирована [11].
ПАЦИЕНТЫ, ПОЛУЧАЮЩИЕ АНТИТРОМБОТИЧЕСКУЮ ТЕРАПИЮ
Неселективные НПВП обладают антитромботическими свойствами, обусловленными блокадой ЦОГ-1 и снижением синтеза тромбоксана А2. Этим объясняется повышение риска кровотечений на фоне приема НПВП. [27] Кроме того, комбинация НПВП с низкими дозами АСК и другими антитромботическими средствами приводит к резкому повышению риска кровотечений, в частности желудочно-кишечных. Селективные НПВП в этом смысле более безопасны; при необходимости совместного назначения низких доз АСК и НПВП предпочтителен целекоксиб [28].
Пациентам, получающим антикоагулянты, для лечения острого ПА рекомендован колхицин, поскольку он не имеет эффекта на коагуляцию. Другим вариантом может быть назначение ГКС. В случае поражения 1–2 суставов рекомендовано их внутрисуставное введение, при этом для профилактики гемартроза необходимо использовать иглу 22G; отменять или корректировать дозу антикоагулянта в связи с инъекцией не требуется. Системное применение ГКС назначается при полиартикулярном поражении, а также невозможности выполнить внутрисуставную инъекцию [19, 20].
В случае если применение ГКС или колхицина у этой категории больных по каким-либо причинам невозможно, рекомендуется назначение целекоксиба, для которого, в отличие от неселективных НПВП, характерно отсутствие антитромбоцитарного эффекта [19]. Поскольку целекоксиб не блокирует ЦОГ-1, он считается наиболее безопасным препаратом выбора при необходимости сочетания НПВП с низкими дозами АСК [28].
Назначение короткодействующего ингибитора интерлейкина 1 возможно у пациентов, получающих антикоагулятны и имеющих противопоказания к применению других ПВС [26].
Отдельно отметим, что в последние несколько лет обсуждается возможность развития острого ПА на фоне лечения прямым оральным антикоагулянтом дабигатрана этексилатом. Однако в настоящее время данных, подтверждающих связь приема этого препарата с возникновением приступов подагры, недостаточно [30].
БЕРЕМЕННОСТЬ И ЛАКТАЦИЯ
У женщин детородного возраста гиперурикемия и соответственно подагрические приступы встречаются крайне редко в силу урикозурического действия эстрогенов [31]. Поэтому при возникновении ярко-воспалительного артрита у беременных и кормящих необходимо прежде всего исключить инфекционное поражение [19].
В качестве препарата первой линии для лечения острого ПА у беременных и кормящих рекомендуют ГКС (при условии контроля АД и гликемии) [19]. В первом и втором триместрах беременности (до 30 нед) возможно назначение некоторых НПВП – диклофенака, напроксена, кетопрофена, ибупрофена [27, 32]. В третьем триместре применение НПВП противопоказано из-за риска преждевременного закрытия артериального протока [33].
В период лактации для купирования острого ПА предпочтительно назначение ибупрофена, поскольку он выделяется в грудное молоко в незначительных количествах [19, 27, 34].
Колхицин обладает тератогенным действием, а также секретируется в грудное молоко, в связи с этим он противопоказан на любом сроке беременности и во время лактации [19]. Однако в последнее время появляются данные о безопасности его применения у беременных [35].
При необходимости профилактики рецидивирующих приступов ПА у беременных и кормящих рекомендован ежедневный прием малых доз ГКС [19].
ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
Острый ПА нередко развивается в послеоперационном (п/о) периоде [36], что обусловлено воздействием ряда предрасполагающих факторов:
- развитием метаболического ацидоза вследствие интраоперационной кровопотери [37];
- резким снижением урикемии из-за длительного п/о голодания и/или ограниченного питания (в том числе парентерального), особенно после операций на ЖКТ [36];
- резким снижением урикемии, обусловленным повышенной секрецией уратов с мочой (снижение канальцевой реабсорбции вследствие воздействия декстрозы, содержащейся в растворах для внутривенного введения) [36].
П/о подагрический приступ может возникать как у больных подагрой, так и впервые, у лиц с ранее бессимптомной гиперурикемией [38]. Как правило, приступ развивается через 4–5 дней после операции и поражает суставы нижних конечностей, чаще коленный и суставы стопы. Риск развития приступа наиболее высок у пациентов с предоперационной гиперурикемией выше 540 мкмоль/л, а также в случае резкого снижения концентрации мочевой кислоты на 120 мкмоль/л и более [36, 37].
Ведение пациента с п/о приступом основывается на общих теоретических данных и результатах немногочисленных исследований. Клинических рекомендаций по этому вопросу не разработано.
Выбор препарата для купирования приступа осуществляется исходя из коморбидного фона п/о пациента [38]. Необходимо также учитывать тип перенесенной операции. В частности, у пациентов с ограничениями питания после хирургических вмешательств на ЖКТ, а также у всех больных, которые на момент развития приступа находятся на парентеральном питании, целесообразно применение внутрисуставного введения ГКС [38]. Наряду с этим, важно учитывать общие особенности, связанные с недавно перенесенным хирургическим вмешательством, а именно риск п/о кровотечения, инфекционных осложнений и замедленного заживления ран. Например, при решении вопроса о назначении НПВП необходимо помнить о повышенном риске кровотечений в п/о периоде, особенно у пациентов, получающих антикоагулянты. В связи с этим рекомендуется назначение или короткодействующих НПВП, или НПВП с минимальной ингибирующей активностью в отношении тромбоцитов [39].
Длительное использование ГКС повышает риск инфекционных осложнений и может способствовать замедлению заживления раны. Поэтому у пациентов, находящихся на длительном дооперационном приеме ГКС, проблема их использования в п/о периоде занимает особое место, что отражено в рекомендациях по периоперационному применению фармпрепаратов. В то же время вопросы кратковременного п/о применения ГКС (в том числе для лечения острого ПА) не рассматриваются. Это касается как внутрисуставных инъекций, так и других способов введения этих препаратов [40–42]. Тем не менее очевидно, что даже кратковременное назначение ГКС в этом случае должно обсуждаться с особым вниманием, поскольку применяемый в обычных условиях курс (до 10–14 дней) в п/о периоде совпадает по времени с наиболее критичным периодом заживления раны и ранних инфекционных осложнений.
Таким образом, при рассмотрении вопроса о п/о применении ГКС необходимо учитывать не только коморбидный фон пациента, но и характеристики раны и индивидуальные п/о риски. Помимо этого, целесообразно соотноситься с опытом лечения прежних приступов: применялись ли ранее ГКС, удавалось ли быстро купировать приступ с помощью их малых доз [41].
Возможность применения колхицина для купирования приступа ПА в п/о периоде следует оценивать исходя из особенностей конкретного случая [42].
Принимая во внимание высокий риск п/о инфекционных осложнений, важно помнить о возможности развития инфекционного артрита, имитирующего острый ПА. Для их дифференциальной диагностики проводится пункция пораженного сустава [40].
Основной мерой профилактики п/о подагрического приступа служит заблаговременная нормализация урикемии. Подбор дозы гипоурикемических препаратов (аллопуринола, фебуксостата) в обычных условиях занимает 2–3 мес, в течение которых проводится плавное снижение сывороточного уровня мочевой кислоты до целевых показателей (300–360 мкмоль/л) [26, 43]. Назначение гипоурикемических средств перед операцией для быстрого снижения уровня мочевой кислоты не рекомендовано, так как оно почти неизбежно приведет к развитию острого ПА. Гипоурикемические препараты не требуют отмены в периоперационном периоде [44].
ЗАКЛЮЧЕНИЕ
Несмотря на то что лечение острого ПА хорошо разработано, оно может быть затруднительным у пациентов с определенными сопутствующими состояниями. Перед началом лечения необходимо проанализировать возможные ограничения у конкретного пациента, а также учесть потенциальные лекарственные взаимодействия.
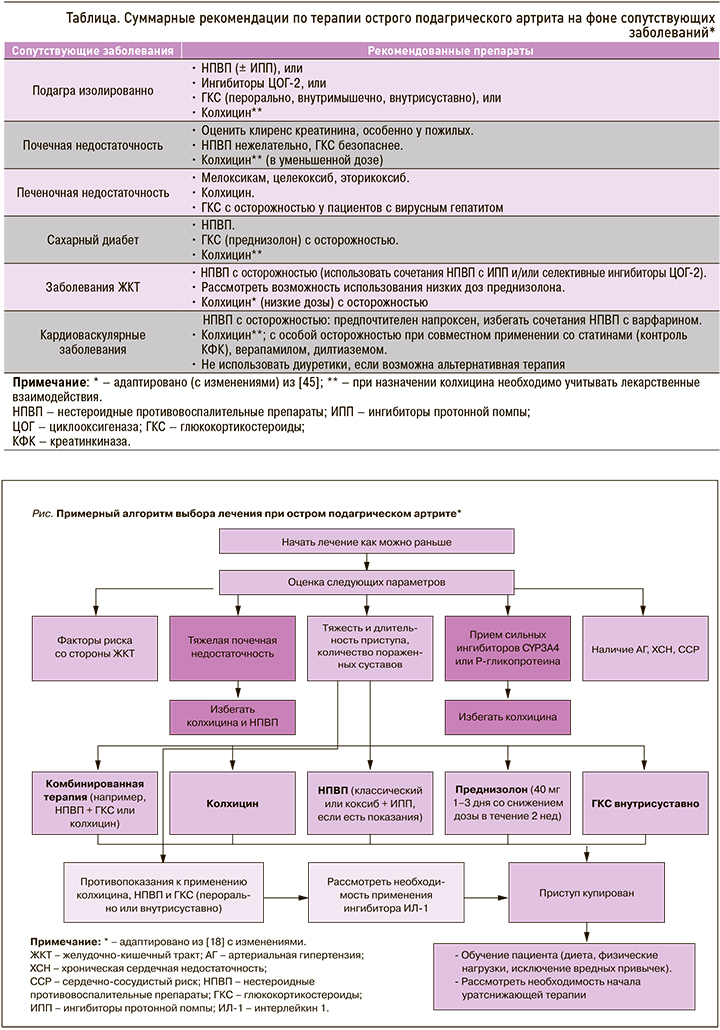
Суммарные рекомендации по лечению острого приступа подагры и базисному лечению с учетом сопутствующей патологии обобщены в таблице. Примерный алгоритм ведения острого ПА приведен на рисунке.