ВВЕДЕНИЕ
Острый подагрической артрит (ПА), называемый также подагрическим приступом, характеризуется высокой выраженностью локального воспаления, тяжелым болевым синдромом и ограничением функции пораженного сустава вплоть до временной ее утраты. В связи с этим ПА является неотложным состоянием и требует незамедлительного лечения.
Для лечения ПА применяют нестероидные противовоспалительные препараты (НПВП), глюкокортикостероиды (ГКС), колхицин. Этим лекарственным средствам, наряду с противовоспалительным действием, свойственны также высокая частота и широкий спектр нежелательных явлений. У пациентов без существенного коморбидного фона эти негативные эффекты либо не имеют значимой клинической выраженности, либо легко преодолеваются. Однако в определенных обстоятельствах, обусловленных сопутствующей патологией, даже краткосрочное применение противовоспалительных средств (ПВС) сопряжено с высоким риском тяжелых осложнений. Таким образом, у значительного числа пациентов купирование острого ПА становится непростой клинической задачей.
КЛИНИКА ОСТРОГО ПОДАГРИЧЕСКОГО АРТРИТА
Подагра – системное тофусное заболевание, которое характеризуется отложением в различных тканях кристаллов моноурата натрия и развивающимся в связи с этим воспалением у лиц с гиперурикемией, обусловленной внешнесредовыми и/ или генетическими факторами [1].
Одно из проявлений подагры – острый ПА. Первый приступ ПА в большинстве случаев (60–70%) развивается в I плюснефаланговом суставе, в дальнейшем наиболее часто поражаются суставы стопы, но в целом ПА может возникнуть в любом суставе. В рамках приступа отмечается, как правило, воспаление одного, реже – двух суставов. Клиника ПА характеризуется острым началом, быстрым развитием и ярчайшими признаками воспаления, в том числе нестерпимой болью. Продолжительность приступа без лечения обычно составляет от 1 до 7 сут [2–4].
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ОСТРОГО ПОДАГРИЧЕСКОГО ПРИСТУПА
Основой медикаментозного лечения ПА служит применение НПВП. Кроме того, используют ГКС, колхицин, ингибиторы интерлейкина 1 (ИЛ-1). Эти препараты применяют исходя из принципов раннего начала и адекватной продолжительности терапии [2, 5, 6].
Лечение необходимо начинать как можно раньше, при первых признаках артрита или даже на стадии его предвестников с применением полных доз ПВС [5, 7].
В случае раннего начала лечения (не позднее 12 ч от появления первых признаков) артрит регрессирует, как правило, за 2–3 дня. В случае позднего начала лечения (более 36 ч от первых проявлений), а также у пациентов с хронической подагрой купирование приступа требует нескольких дней или даже недель [5, 8].
Лечение завершают с прекращением приступа, но порядок отмены ПВС неодинаков. Применение НПВП рекомендуют продолжить в течение 3 дней после полного стихания приступа (правило «всё прошло + 3 дня»), это же относится и к колхицину [4, 8]. Дозу ГКС необходимо снижать постепенно, поскольку при резкой отмене возможно обострение [8]. Ингибиторы ИЛ-1 (канакинумаб) назначают однократно, а при необходимости повторного введения интервал между инфузиями должен быть не менее 12 нед [9].
Важно отметить, что во время острого ПА не следует отменять или изменять дозу постоянно принимаемых уратснижающих препаратов [8].
ПРИМЕНЕНИЕ НПВП ПРИ ОСТРОМ ПОДАГРИЧЕСКОМ АРТРИТЕ
Для лечения острого ПА можно применять любой НПВП, поскольку эффективность различных представителей этого класса лекарственных средств сопоставима [5]. Выбор НПВП необходимо проводить с учетом сопутствующей патологии и постоянно принимаемых лекарств [4]; в целом более предпочтительны препараты с благоприятным профилем безопасности, в том числе мелоксикам, напроксен, нимесулид [10].
Как правило, полный регресс ПА достигается через 2–3 сут лечения или даже раньше. Неэффективность НПВП в течение 7–10 дней требует усиления терапии (например, комбинации различных ПВС) или пересмотра диагноза [4, 5, 8].
Необходимо помнить о высокой частоте и разнообразии побочных эффектов на фоне приема НВПВ. Среди них различные нежелательные (в том числе угрожающие) явления со стороны сердечно-сосудистой системы, желудочно-кишечного тракта (ЖКТ), почек, печени, системы коагуляции. В связи с этим назначение НПВП (даже краткосрочное) необходимо предварять оценкой индивидуальных рисков пациента [10].
Несмотря на то что ацетилсалициловая кислота (АСК) также относится к группе НПВП, ее для лечения ПА не применяют. Это связано с парадоксальным эффектом салицилатов в отношении почечной экскреции мочевой кислоты: дозы до 2–3 г/сут приводят к гипоэкскреции, а более высокие дозы – к гиперэкскреции. В то же время низкие дозы АСК (100–150 мг/сут) не имеют значимого влияния на урикозурию, и их отмена в период острого ПА не требуется [8, 11].
ПРИМЕНЕНИЕ КОЛХИЦИНА
Колхицин является эффективным средством купирования острого ПА. Тем не менее его использование ограничено частым развитием нежелательных явлений, в том числе тяжелых токсических реакций. В их числе диарея и рвота (у 80% пациентов), миелосупрессия, острое почечное повреждение, сердечная недостаточность и др. [4, 12]. Внутривенное введение колхицина в настоящее время запрещено [4].
Назначение колхицина оправдано в следующих ситуациях [8]:
- наличия у пациента непереносимости или значимых противопоказаний к применению НПВП и ГКС;
- совместного решения врача и пациента, основанного на успешном опыте применения колхицина, но при условии, что лечение будет начато не позднее 24 ч от начала приступа;
- если терапия каким-либо НПВП вызвала побочные эффекты или оказалась неэффективной и требуется замена на другое ПВС, но при условии, что от начала приступа прошло не более 36 ч.
Колхицин противопоказан при скорости клубочковой фильтрации (СКФ) ниже 10 мл/мин/1,73 м2, а при СКФ меньше 50 мл/мин/1,73 м2 дозу препарата необходимо уменьшить. Кроме того, препарат не следует назначать пациентам с печеночной недостаточностью, обструкцией желчных путей, а также при нежелательности диареи [4].
Применяя колхицин, необходимо учитывать возможность значимых лекарственных взаимодействий. В частности, сочетание с верапамилом, кларитромицином, дилтиаземом и циклоспорином требует уменьшения дозы колхицина на 30–60%, а некоторые лекарственные сочетания вовсе недопустимы. Это связано с особенностями метаболизма колхицина. Система цитохромов CYP3A4 преобразует это лекарственное средство в неактивные метаболиты, а Р-гликопротеин ограничивает абсорбцию препарата в ЖКТ. Известно, что многие лекарственные препараты являются ингибиторами одного или обоих этих белков (табл. 1). Таким образом, совместное применение таких препаратов с колхицином приводит к его накоплению и повышению риска нежелательных реакций. Назначение колхицина тем, кто получал в течение последних 14 дней ингибиторы Р-гликопротеина или CYP3A4, возможно только при отсутствии других вариантов лечения и при условии тщательного наблюдения пациента [8, 13].
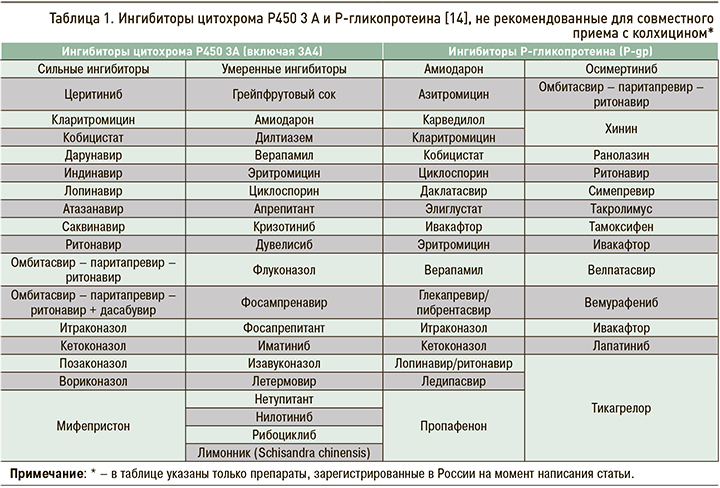
Потенциально неблагоприятными являются также сочетания колхицина с НПВП, ингибиторами АПФ и тиазидными диуретиками в связи с риском значительного снижения почечной функции, особенно в условиях обезвоживания. Имеется в виду дегидратация, обусловленная диареей на фоне приема колхицина и сознательного уменьшения потребления жидкости пациентом, чтобы реже ходить в туалет [7]. Таким образом, применение этого препарата требует тщательного контроля лекарственных взаимодействий.
Как уже отмечалось, лечение колхицином необходимо начинать не позднее 24 ч от начала приступа ПА (в качестве препарата первой линии) и не позднее 36 ч в качестве препарата второй линии [8]. Согласно современным рекомендациям, в первый день его применяют в дозе 1,5 мг/ сут, распределенной на два приема (1 мг и еще 0,5 мг через час), в последующие дни – 1 мг/ сут [5]. В зарубежных источниках можно встретить меньшие рекомендуемые дозы препарата (1,2 и 0,6 мг соответственно), что связано с другими стандартами дозирования таблетированного колхицина [12]. Более высокие дозы колхицина, применявшиеся ранее (до 4,8 мг/сут), в настоящее время не рекомендованы, поскольку было показано, что его применение в дозировке 1,5 мг/сут не менее эффективно, но более безопасно [13].
ПРИМЕНЕНИЕ ГЛЮКОКОРТИКОСТЕРОИДОВ
ГКС для лечения ПА используют при невозможности назначения или неэффективности НПВП и колхицина [5]. Препаратам ГКС свойственно, с одной стороны, быстрое и мощное противовоспалительное действие, но с другой – высокая частота и широкий спектр нежелательных эффектов. ГКС применяются внутрисуставно (в/с) или системно, и каждый из этих способов имеет свои преимущества и ограничения.
Используемые в клинической практике ГКС различаются, помимо прочего, по продолжительности действия, минералокортикоидной (МК) активности, воздействию на углеводный обмен и др.
ГКС короткого действия, к которым относятся преднизолон и метилпреднизолон, угнетают выработку адренокортикотропного гормона (АКТГ) на 24–36 ч. Препараты длительного действия (дексаметазон, триамцинолон и бетаметазон) подавляют АКТГ на срок более 48 ч, и их применение сопряжено с более высоким риском лекарственного гиперкортицизма.
МК-эффекты ГКС выражаются в снижении почечной экскреции натрия и воды и повышении выделения калия. Они наиболее выражены у природных ГКС (кортизона и гидрокортизона), в меньшей степени – у полусинтетических средств (преднизолона и метилпреднизолона). Фторированным препаратам – триамцинолону, дексаметазону и бетаметазону – МК-активность не свойственна, но они в то же время обладают более выраженным влиянием на углеводный обмен. Таким образом, применение препаратов с высокой МК-активностью требует осторожности у пациентов с сердечной недостаточностью и/или плохо контролируемой артериальной гипертензией (АГ). При использовании фторированных ГКС необходим особо тщательный контроль гликемии у пациентов с сахарным диабетом и другими нарушениями углеводного обмена [15]. В то же время ГКС не оказывают негативного влияния на функцию почек и считаются безопасными для пациентов с почечной недостаточностью [16].
Внутрисуставное применение глюкокортикостероидов
К в/с введению ГКС прибегают у пациентов с установленной подагрой в тех случаях, если приступ представлен поражением одного или двух суставов, и пероральные препараты не могут быть использованы или неэффективны. Если диагноз подагры не верифицирован, а также в случаях, когда имеется подозрение на инфекционное поражение сустава, от в/с введения ГКС следует воздержаться [8].
Доза ГКС для в/с инъекции в крупные суставы составляет 25–50 мг преднизолонового эквивалента, в мелкие – 5–10 мг [15].
Противопоказания к в/с введению ГКС включают [17]:
- локальное инфекционное поражение в области доступа (инфицированная рана, фурункулез, флегмона, рожистое воспаление и др.);
- инфекционный артрит (важно помнить о возможном сочетании подагрического и инфекционного артрита);
- системную инфекцию;
- выраженные структурные изменения сустава и факторы, предрасполагающие к ним (костная деструкция, некорригируемая статическая деформация сустава, чрезсуставной перелом, выраженный околосуставной остеопороз);
- сложный доступ к суставу.
Принято считать, что в/с введение ГКС является более щадящим по сравнению с системным их применением, поскольку область воздействия лекарственного средства ограничена полостью сустава. Однако известно, что значительное количество препарата, введенного в сустав, поступает в общий кровоток и соответственно, как и в ситуации системного применения ГКС, сопряжено с риском развития нежелательных системных эффектов (повышение артериального давления, гипергликемии и др.) [18].
Системное применение глюкокортикостероидов
Системное применение ГКС рекомендуется при невозможности выполнения в/с инъекций, а также при полиартикулярном поражении. В таких случаях препараты этого класса используют внутримышечно или перорально в средних дозах (в эквиваленте 30–35 мг преднизолона в сутки на протяжении 3–5 дней с дальнейшей отменой препарата в течение 10–14 дней) [5]. У пациентов с хронической подагрой на фоне отмены ГКС нередко возникают обострения, поэтому для таких больных рекомендовано более медленное снижение дозы – в продолжение 14–21 дня [8].
На практике в большинстве случаев приступ ПА удается купировать с помощью еще более кратковременного применения значительно меньших доз ГКС (5–10 мг/сут в течение 3–5 дней). Использовавшиеся ранее высокие дозы ГКС, в том числе пульс-терапия на протяжении 2–3 дней, в актуальных версиях клинических рекомендаций не прописаны.
ГЕННО-ИНЖЕНЕРНЫЕ БИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ ПРИ ОСТРОМ ПОДАГРИЧЕСКОМ АРТРИТЕ
В настоящее время обсуждается применение антагонистов рецептора ИЛ-1 (анакинра) и моноклональных антител к ИЛ-1 (канакинумаб) для лечения трудно купируемого приступа ПА. В действующих клинических рекомендациях назначение канакинумаба предусмотрено для наиболее тяжелых пациентов (при наличии абсолютных противопоказаний и/или неэффективности НПВП, ГКС и колхицина). При этом его применение противопоказано в случае инфекционных заболеваний [5, 9].
ЗАКЛЮЧЕНИЕ
Лечение острого ПА в большинстве случаев занимает несколько дней. Однако краткосрочное применение ПВС не исключает возможности нежелательных явлений, которые могут привести к значимой дестабилизации пациента. В связи с этим при выборе ПВС для лечения острого ПА необходимо учитывать наличие и характеристики сопутствующих заболеваний, избегать потенциально неблагоприятных лекарственных взаимодействий, уточнять наличие лекарственной непереносимости. Наиболее значимые риски, связанные с приемом ПВС, суммированы в таблице 2.




