ВВЕДЕНИЕ
Опухоли яичников – серьезная проблема среди женщин всех возрастных групп, занимающая 7-e место (4–6%) в структуре всех новообразований у женщин [1]. 5–10% лиц женского пола подвергаются хирургическому лечению по поводу опухолей яичников, причем у 13–21% оперированных обнаруживаются злокачественные опухоли [2].
Диагностика и дифференциальная диагностика доброкачественных новообразований яичников являются важными клиническими задачами с точки зрения профилактики возможных осложнений, требующих оказания экстренной медицинской помощи, а также оценки риска злокачественного процесса, диктующего необходимость правильной маршрутизации пациентки [3]. В соответствии с современной классификацией основные нозологические группы формируются по следующим категориям [4–6]: эпителиальные, стромальные, мезенхимальные опухоли, опухоли полового тяжа, герминогенные опухоли, смешанные, лимфопролиферативные заболевания, опухолеподобные заболевания, вторичные (метастатические) опухоли.
ОПИСАНИЕ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ
Пациентка Н., 1960 г.р., впервые обратилась в клинику Омского государственного медицинского университета в 2018 г. (в возрасте 58 лет) с жалобами на выпадение волос на волосистой части головы, избыточный рост волос на лице и теле.
Данные анамнеза: в возрасте 40 лет пациентка впервые стала отмечать нарушения менструального цикла по типу олигоопсоменореи, последняя менструация произошла в 43 года (2003 г.). С 2005 г. стала отмечать истончение и выпадение волос в области висков, лба, теменной зоне, повышенный рост волос на лице (в области усов и бороды, бакенбардов), плечах, животе, нижних конечностях. С 2007 г. пациентка регулярно (последнее время ежедневно) бреется, с 2010 г. постоянно носит головные уборы, парики. В течение указанных лет пациентка отмечала постепенное увеличение массы тела, повышение уровня артериального давления (АД). В 2010 г. впервые обратилась с указанными жалобами за медицинской помощью, при обследовании выявлена артериальная гипертензия (максимальное повышение АД до 160/100 мм рт. ст.), сахарный диабет 2-го типа, по поводу которых назначена медикаментозная терапия. В том же году больная была однократно консультирована эндокринологом, впервые у нее было зарегистрировано повышение уровня общего тестостерона – 25,1 нмоль/л (0,29–1,67 нмоль/л). Однако от дообследования пациентка отказалась, выполняла только рекомендации терапевта по гипотензивной и гипогликемизирующей терапии. В 2013 г. при проведении абдоминального ультразвукового исследования (УЗИ) была выявлена ангиомиолипома правой почки (гиперэхогенное объемное образование 15 мм в диаметре).
Наследственный анамнез не отягощен, гинекологический анамнез включал три беременности, одни роды, два медицинских аборта.
Текущая медикаментозная терапия (2018): метформин по 1700 мг/сут, гликлазид с модифицированным высвобождением по 90 мг/сут, лозартан по 100 мг/сут, индапамид по 1,5 мг/сут, бисопролол по 10 мг/сут, розувастатин по 20 мг/сут.
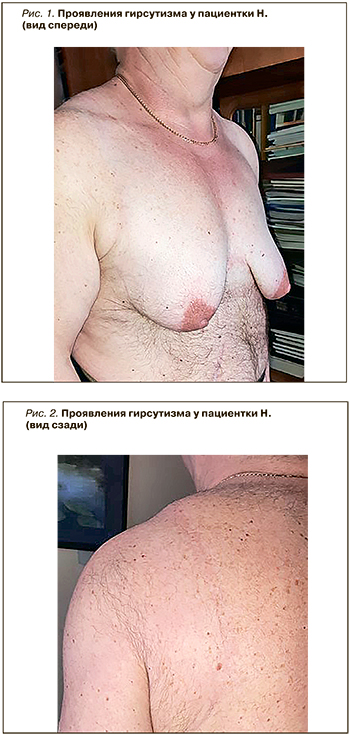
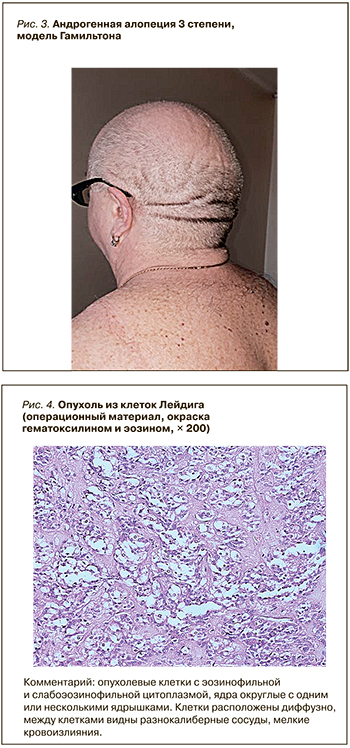
Данные осмотра (особенности): рост 172 см, масса тела 104 кг, индекс массы тела (ИМТ) 35,2 кг/м2, низкий голос, избыточный рост волос в андрогензависимых зонах (рис. 1, 2), диффузная алопеция 3-й степени, модель Гамильтона (рис. 3), гирсутное число 29 по шкале Ферримана–Голлвея, маскулинизация.
Результаты исследования на гормоны: тестостерон общий – 69,5 нмоль/л, тестостерон свободный – 2,12 нмоль/л, индекс свободных андрогенов – 234,1% (0,5–4,7). Глобулин, связывающий половые гормоны (ГСПГ), андростендион, 17-гидроксипрогестерона и дегидроэпиандростерон сульфат (ДГЭA-C), в пределах референсных значений.
Данные гинекологического осмотра: гипертрофия клитора, придатки с обеих сторон не определяются.
При УЗИ органов малого таза впервые выявлено: левый яичник – 1,04 мл, правый яичник – 10,77 мл, структура неоднородная за счет жидкостного включения – 15 мм.
На основании жалоб и анамнеза, данных лабораторно-инструментальных методов, обследования установлен диагноз гиперандрогении яичникового генеза, кисты правого яичника. При этом рассматривалось проведение дифференциальной диагностики между андрогенпродуцирующей опухолью правого яичника и гипертекозом яичников в сочетании с истинной кистой правого яичника. Учитывая возраст пациентки, было рекомендовано проведение двусторонней овариэктомии, от которой пациентка отказалась.
В 2018 г. в связи с подозрением на злокачественное новообразование пациентке проведена резекция правой почки (гистологическое исследование: ангиомиолипома).
Повторное обращение пациентки в клинику состоялось в 2020 г. в связи с прежними жалобами и результатами обследований: тестостерон общий – 71,97 нмоль/л (0,46–1,18 нмоль/л), УЗ-признаки гиперплазии эндометрия, киста правого яичника. Диагноз и рекомендации 2018 г. были продублированы, с пациенткой проведена беседа о настоятельной необходимости рекомендованной тактики лечения. В марте 2020 г. проведена операция – тотальная гистерэктомия (экстирпация матки) с придатками лапаротомическая.
Макроскопическое описание (рис. 4, 5): правый яичник 6×5×3 см, с полостью в 2 см в диаметре, стенка рыхлая, красно-бурого цвета.

Микроскопическое описание: новообразование в яичнике представлено клетками с обильной пенистой эозинофильной, светлой и слабо эозинофильной цитоплазмой, клетки расположены диффузно, есть некоторая тенденция к альвеолярности, между клетками видны разнокалиберные сосуды, мелкие кровоизлияния.
Иммуногистохимическое исследование: опухолевые клетки экспрессируют Androgen (Clon AR 441), Inhibin, Calretinin, CD56, Melan-A, PgR, PAX8. Экспрессия ER, S100, CD99 (слабо) оценена как неспецифическая. Негативная экспрессия опухолевыми клетками CK7, EMA. Индекс пролиферативной активности по Ki67 1–2%.
Заключение: гистологическое строение и иммунофенотип соответствует опухоли из клеток Лейдига.
ОБСУЖДЕНИЕ
Вирилизирующие опухоли яичников – это все гистологические типы опухолей, обладающие андрогенпродуцирующей активностью и обусловливающие развитие вирильного синдрома у женщин [7]. Они встречаются у одной из 30 тыс. женщин с одинаковой частотой во всех возрастных группах. Морфологические признаки злокачественности обнаруживаются в одной из пяти опухолей яичников, однако многочисленные наблюдения показывают, что эти новообразования крайне редко метастазируют и отличаются благоприятным клиническим прогнозом [7, 8].
К опухолям, обладающим андрогенпродуцирующей активностью, относят текомы, гранулезоклеточные опухоли, опухоли из клеток Сертоли–Лейдига, липидоклеточные опухоли и неспецифические (или неклассифицируемые) стромально-клеточные опухоли [7, 9]. Стромально-клеточные опухоли яичников с элементами полового тяжа включают: гранулезоклеточные опухоли яичников взрослого типа; гранулезоклеточные опухоли яичников ювенильного типа; опухоли яичников из клеток Сертоли и Лейдига; гинандробластому яичников; опухоль стромы полового тяжа яичников с кольцевидными трубочками [10].
Один из наиболее редких вариантов гормонопродуцирующих опухолей яичников – андробластома (опухоль из клеток Сертоли и Лейдига). Опухоли, состоящие только из клеток Лейдига, чаще всего наблюдаются в постменопаузальном периоде [11]. В подавляющем большинстве случаев такие опухоли доброкачественные, однако описаны случаи метастазирования подобных новообразований, ставших причиной смерти пациенток [9, 12]. Как правило, опухоль из клеток Сертоли–Лейдига ассоциирована с носительством мутации гена DICER1, которая может приводить к развитию целого ряда злокачественных и доброкачественных новообразований [13].
Вирилизирующая опухоль яичников выступает редкой причиной гиперандрогении, при этом гиперандрогения является важным ключом к ранней диагностике этих потенциально злокачественных опухолей. Клинические проявления вирилизирующих опухолей яичников складываются из ряда андрогензависимых и эстрогензависимых симптомов [9, 10, 14]. К наиболее характерным проявлениям гиперандрогении относятся андрогенная алопеция, гирсутизм, дермопатия, барифония, маскулинизация фигуры, гипертрофия клитора. При гинекологическом осмотре часто выявляется уменьшение размеров матки, иногда удается пропальпировать асимметричное увеличение одного яичника. В ряде случаев наблюдается инволюция молочных желез [12, 14]. У всех больных репродуктивного возраста нарушается менструальная функция (чаще по типу вторичной аменореи, реже олигоменореи). У большинства женщин менструации прекращаются внезапно на фоне предшествующих регулярных менструальных циклов [14], наблюдается раннее наступление менопаузы, совпадающее с появлением первых признаков вирилизации [7]. В перименопаузальном периоде у больных с вирилизирующими опухолями яичников повышается риск развития артериальной гипертензии, сахарного диабета и гиперпластических процессов в эндометрии и молочных железах. Характерно быстрое прогрессирование симптомов вирилизации.
Заподозрить вирилизирующую опухоль при выраженной клинической картине нетрудно, однако выявить источник гиперандрогении (надпочечники или яичники) зачастую достаточно сложно. Опорный признак гиперандрогении яичникового генеза – изолированное повышение тестостерона, что в сочетании с визуализаций в ряде случаев оказывается достаточным для верификации диагноза. Повышение ДГЭA-C значительно чаще встречается при патологии надпочечников [10]. Подозрение на опухоль служит показанием для проведения трансвагинального УЗИ с целью оценки состояния яичников, а также компьютерной томографии для исключения патологии надпочечников.
Лейдиг-клеточная опухоль яичников – редкая опухоль полового тяжа, которая составляет менее 0,5–1,0% опухолей яичников. Позитронная эмиссионная томография (ПЭТ) с фтордезоксиглюкозой может быть использована как альтернативный метод для выявления малых очагов Лейдиг-клеточных опухолей яичников. Отсутствие признаков, характерных для вирилизации и маскулинизации, не исключает Лейдиг-клеточного новообразования яичников, так как в 25–30% случаев не наблюдается повышения уровня андрогенов [10]. 90% случаев Лейдиг-клеточной опухоли яичников классифицируются как рак I стадии в соответствии с FIGO-системой. После оперативного лечения прогноз положительный, выживаемость составляет 84–95%. Для результатов гистопатологического исследования характерны стероидные клетки, заполненные светлой или эозинофильной цитоплазмой с кристаллами Рейнке, которые представляют собой белковые включения и цитоплазматические включения липофусцина. Важно положительное иммуногистохимическое окрашивание: альфа-ингибин, виментин, цитокератин CAM 5.2, цитокератин AE1/AE3, актин, EMA, белок S100 [10].
При обнаружении вирилизирующей опухоли яичников проводится оперативное лечение – удаление опухоли с максимальным сохранением здоровой овариальной ткани и обязательной биопсией второго яичника. Большинство случаев постменопаузальных вирилизирующих опухолей яичников доброкачественны, и двусторонняя сальпингоофорэктомия является оптимальным методом лечения. После хирургического вмешательства у больных наблюдается практически полное выздоровление. Рецидивов заболевания или поздних метастазов обычно не наблюдается. Для того чтобы быстрее установить диагноз и внедрить правильный метод лечения, крайне важна междисциплинарная команда врачей, специализирующихся в области эндокринологии, гинекологии и онкологии.



