ВВЕДЕНИЕ
Миастения является хроническим аутоиммунным заболеванием, при котором поражаются нервно-мышечные синапсы [1, 2]. В результате нарушения нервно-мышечной передачи у пациентов развиваются слабость и патологическая утомляемость поперечнополосатых мышц. По мере прогрессирования болезни в патологический процесс вовлекается все больше мышечных групп, возникают не только затруднения общей двигательной активности, но и трудности глотания и жевания пищи, расстройства речи, дыхательные нарушения. Заболевание поражает лиц всех возрастных групп, имеет прогрессирующий характер, может приводить к нарушению трудоспособности и способности к самообслуживанию [3, 4].
Миастения относится к редким заболеваниям, ее распространенность колеблется от 2,2 до 36,7 случаев на 100 тыс населения [1, 5]. Тем не менее в последние годы во всем мире отмечается рост числа больных миастенией, что может быть связано с общим нарастанием количества аутоиммунной патологии, увеличением длительности жизни больных миастенией и улучшением диагностики этого заболевания [5]. За последние 50 лет произошло коренное изменение подходов к лечению и прогнозу миастении, основанное на понимании ее патогенетических механизмов, что позволило существенно снизить летальность, продлить жизнь пациентов и улучшить ее качество [6]. Основой лечения миастении служат антихолинэстеразные препараты, а также иммуносупрессивная и иммуномодулирующая терапия [7].
Кортикостероиды рекомендуются в качестве иммуносупрессивных препаратов первой линии при миастении гравис. Они проявляют выраженный ингибирующий эффект на иммунную систему, особенно за счет иммуносупрессии Т-клеток, в том числе препятствуя взаимодействию факторов транскрипции, ответственных за экспрессию различных провоспалительных цитокинов в клеточном ядре, нарушают иммуностимулирующую функцию линии моноцитов-макрофагов и уменьшают количество циркулирующих Т-клеток [8]. Эта группа препаратов в лечении миастении гравис используется для долгосрочной иммуносупрессии [9]. Традиционно пероральные кортикостероиды применялись в высоких дозах в режиме повышения и понижения. Однако существуют многочисленные системные побочные эффекты, связанные с длительной терапией кортикостероидами, в том числе повышенный риск развития инфекции, остеопороз, увеличение веса, нарушение толерантности к глюкозе, диабет, артериальная гипертензия, заболевания глаз (катаракта и глаукома) и нервно-психические расстройства [10]. В научной литературе высказываются зачастую противоположные мнения о дозах и длительности лечения пероральными кортикостероидными гормонами [11, 12]. В клинических рекомендациях Британского общества неврологов, опубликованных в 2015 г., предложена схема постепенного повышения дозы кортикостероидов до 0,75–1,0 мг/ кг массы тела, сохранения максимальной дозы до достижения медикаментозной ремиссии (4–12 нед) и медленного (2,5 мг в 14 дней) снижения дозировки [13]. Однако в международном консенсусе по лечению миастении гравис, опубликованном в 2016 г., отсутствует общепризнанный стандартный режим дозирования пероральных кортикостероидов [14]. В этом консенсусе определена цель оптимальной терапии миастении – достижение полной безмедикаментозной ремиссии или статуса минимальных проявлений заболевания. Таким образом, схема и длительность назначения стероидных препаратов, позволяющая достичь максимального эффекта, но свести к минимуму нежелательные явления, остается предметом активного научного поиска и обсуждения.
Цель исследования – сравнение эффективности альтернативных схем назначения стероидных гормонов у пациентов с генерализованной формой миастении гравис путем изучения корреляции между режимом дозирования и достижением оптимальной цели терапии.
МАТЕРИАЛ И МЕТОДЫ
С 1999 г. на базе ГБУЗ «Самарская областная клиническая больница им. В.Д. Середавина» работает областной миастенический центр. К 2009 г. был создан электронный регистр больных миастенией Самарской области. Регистр позволяет быстро вносить, изменять и обрабатывать информацию при осуществлении длительного наблюдения за большой группой больных. К настоящему времени база данных регистра содержит информацию более чем о 700 пациентах с миастенией гравис.
Настоящая работа носит ретроспективный характер и основана на анализе данных регистра больных миастенией Самарской области. В исследование было включено 43 больных (25 женщин и 18 мужчин) c генерализованной формой миастении гравис в возрасте от 57 лет до 81 года. Диагноз у всех пациентов верифицировался на основании клинического обследования, электромиографического исследования (декремент-теста), прозериновой пробы, исследования титра антител к ацетилхолиновым рецепторам, компьютерной или магнитно-резонансной томографии средостения. У больных, включенных в исследование, не имелось данных в пользы тимомы. Степень тяжести миастении соответствовала 2–4-му классу по шкале MGFA (Myasthenia Gravis Foundation America – Barohn R.J., 1996).
В зависимости от режима дозирования перорального кортикостероида пациенты были разделены на две группы. В 1-ю группу было включено 22 человека, наблюдавшихся в 2015–2017 гг. и получавших лечение преднизолоном или метилпреднизолоном по поводу прогрессирования миастении гравис. Схема предусматривала быстрое повышение дозы препарата (за 10–14 дней) и быстрое снижение после достижения максимальной дозировки (0,6– 1 мг/кг массы тела) – по 5 мг в 10–14 дней до полной отмены. Пациенты принимали препарат через день, и только трое (13,6%) ежедневно. 2-ю группу исследования составил 21 больной, получавший терапию преднизолоном или метилпреднизолоном по схеме через день в 2018–2020 гг. Схема назначения предусматривала повышение дозы гормона в течение 3–4 нед по 8–10 мг каждые 6 дней до максимальной (0,6–1 мг/кг массы тела). Максимальная доза препарата не снижалась в течение 4–12 нед в зависимости от достигнутого эффекта – снижения потребности в антихолинэстеразных препаратах, исчезновения симптомов миастении. Далее дозировку уменьшали по 2–2,5 мг в 14 дней, что занимало от 10 до 16 мес.
Обе группы больных были сопоставимы по полу, возрасту, длительности и тяжести миастении гравис на момент начала терапии.
Степень тяжести заболевания оценивалась по международной шкале оценки тяжести миастении, разработанной Американским фондом изучения миастении гравис (MGFA), согласно которой к 1-му классу относят больных с изолированными глазодвигательными нарушениями, ко 2-му – больных с генерализованной слабостью легкой степени выраженности, к 3-му – среднетяжелой, 4-му – тяжелой степени выраженности, к 5-му классу – пациентов в кризисном состоянии. Пациенты, относящиеся ко 2, 3 и 4-му классу, в свою очередь, делятся на подгруппы: а – без значимых бульбарных и дыхательных нарушений; в – с выраженными бульбарными и/или дыхательными нарушениями [15].
Также использовалась шкала повседневной активности больных миастенией MG-ADL (The Myasthenia Gravis Activities of Daily Living – Wolfe G.I. et al., 1999). Оценка по этой шкале проводится врачом на основании ответов пациента. Шкала состоит из 8 пунктов, каждый из которых оценивается от 0 (норма) до 3 баллов (максимальная степень выраженности). Исследователь получает представление о симптомах миастении и функциональных ограничениях со стороны глазодвигательных мышц, бульбарных мышц, дыхательной мускулатуры, мышц конечностей. Различия в 2 балла считаются клинически значимыми и четко коррелируют с показателями гораздо более трудоемких количественных шкал оценки состояния больных миастенией гравис [16]. В обеих группах оценивалась тяжесть состояния по шкалам MGFA и MG-ADL в момент назначения стероидных гормонов и через 1–3 мес после окончания курса лечения.
Статистическую обработку полученных данных производили на персональном компьютере, оснащенном соответствующим программным обеспечением. Соответствие распределения признаков нормальному закону проверяли с помощью критерия Шапиро–Уилка. Для количественных признаков, распределение которых соответствовало нормальному закону, определяли среднее и стандартное отклонение – M (SD). Для количественных признаков, распределение которых было отлично от нормального, вычисляли медиану, первый и третий квартиль – Me (Q1; Q3). Для качественных признаков указывались абсолютное и относительное значения. Для сравнения признаков применялись критерии Стьюдента, Манна–Уитни и Хи-квадрат Пирсона с поправкой Йетса.
РЕЗУЛЬТАТЫ
Основные характеристики исследованных групп пациентов представлены в таблице 1. Из нее видно, что группы больных не отличались ни по одному из представленных параметров: они были сопоставимы по возрасту, полу, титру антител к ацетилхолиновым рецепторам, длительности болезни, тяжести состояния по классу MGFA и шкале MG-ADL к моменту начала терапии. Максимальная доза стероидных гормонов в обеих группах была сходной и составила в среднем 0,8 мг на 1 кг массы тела пациента.

При сравнении показателей шкал MGFA и MG-ADL через 1–3 мес после окончания терапии по критериям Стьюдента, Манна–Уитни и Хи-квадрату Пирсона с поправкой Йетса были выявлены существенные отличия: во 2-й группе показатели, характеризующие тяжесть состояния, были значительно лучше, что следует из данных таблицы 2.

В ходе исследования было выполнено сравнение вероятности наступления ремиссии в 1-й и 2-й группах. Различия между группами по этому параметру оказались достоверными (р=0,047). Данные сравнительного анализа наступления ремиссии в группах представлены в таблице 3 и на рисунке.
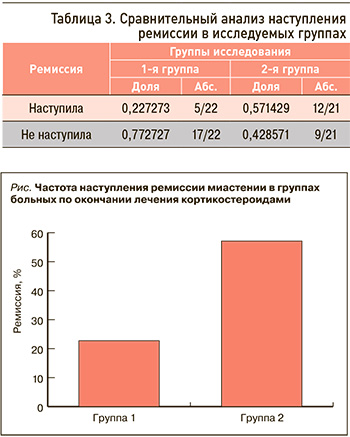
В обеих группах стероидная терапия переносилась пациентами достаточно хорошо. Побочные эффекты глюкокортикоидной терапии в виде набора веса более 5 кг, ухудшения контроля артериальной гипертензии, снижения толерантности к углеводам, декомпенсации сахарного диабета, прогрессирования катаракты были отмечены у 4 пациентов 1-й группы и 5 больных 2-й группы. Подробный анализ побочных эффектов стероидной терапии не входил в цель и задачи данного исследования.
ОБСУЖДЕНИЕ
Основные принципы терапии миастении гравис были введены в клиническую практику более 40 лет назад. Они включают применение пиридостигмина, кортикостероидов, азатиоприна и проведение тимэктомии. Однако основные схемы лечения основаны на клинической практике и опыте ретроспективных исследований. К настоящему времени, по сути, отсутствуют хорошо спланированные клинические исследования, сравнивающие доступные на современном этапе варианты терапии миастении гравис. Ввиду отсутствия контролируемых исследований не удивительно, что неврологи придерживаются разных взглядов на схемы назначения тех или иных препаратов.
Кортикостероиды являются наиболее доступными, надежными и быстродействующими препаратами для иммунотерапии миастении гравис. Вместе с тем такой терапевтический подход основан на общем клиническом опыте, а не на контролируемых исследованиях. В последние годы все большее число специалистов выступает за длительное лечение малыми дозами стероидных гормонов в противовес «агрессивным» схемам быстрого наращивания дозы препарата до уровня 1–1,5 мг на 1 кг массы тела пациента [12, 17, 18]. Тем не менее эксперты признают, что во многих случаях, особенно при тяжелом состоянии больного, достичь компенсации на небольших дозах стероидных гормонов не представляется возможным [18].
Проведенное нами исследование показало, что стероидная терапия миастении гравис служит эффективным методом лечения. Подавляющее большинство пациентов хорошо откликается на терапию, демонстрируя значительное улучшение состояния и снижение потребности в антихолинэстеразной терапии или полный отказ от таковой. Постепенное наращивание дозы позволяет избежать выраженных вегетативных реакций на прием стероидных препаратов. Доза гормонов 0,8–1,0 мг на 1 кг массы тела является достаточной. Сравнительный анализ исходов лечения продемонстрировал преимущество более медленного снижения дозы кортикостероидов. Состояние пациентов этой группы через 1–3 мес после окончания приема препарата было значительно лучше, чем в 1-й группе, а наступление и сохранение ремиссии после окончания действия стероидов фиксировалось в 2,5 раза чаще.
Безусловно, оптимальная тактика лечения миастении гравис – разработка для каждого пациента индивидуального плана лечения, который обязательно должен подвергаться коррекции в зависимости от ответа на проводимую терапию. Современный спектр вариантов лечения миастении позволяет большинству пациентов вести полноценную жизнь. У 30–35% больных с антителами к ацетилхолиновым рецепторам может быть достигнута полная стабильная безмедикаментозная ремиссия [18, 19]. В то же время опыт показывает, что терапевтические ошибки все же случаются. Например, быстрое снижение дозы иммуносупрессантов приводит иногда к опасным для жизни обострениям заболевания. Также следует учитывать, что многим пациентам с миастенией требуется пожизненная иммуносупрессивная терапия [19].
ЗАКЛЮЧЕНИЕ
В настоящее время ведется активный поиск новых таргетных методов лечения миастении гравис. Некоторые из них, вероятно, будут доступны уже в ближайшем будущем. Однако традиционные способы иммуносупрессивной терапии не теряют своего значения. Обоснованные и тщательно подобранные схемы стандартной терапии существенно улучшают перспективы пациентов. При оптимально спланированном лечении прогноз с точки зрения повседневных функций, качества жизни и выживаемости у большинства пациентов с миастенией гравис является благоприятным.



