Хроническая болезнь почек (ХБП) является серьезной проблемой общественного здравоохранения во всем мире. По данным на 2013 г., ее распространенность среди населения составляла от 8 до 16% [1, 2]. Только в США число пациентов, имеющих диагноз терминальной стадии почечной недостаточности, увеличилось с примерно с 10 000 человек в 1973 г. до 703 243 человек в 2015 г. [3].
Одной из основных причин терминальной почечной недостаточности служит хронический гломерулонефрит (ХГН). Тактика его лечения полностью основана на результатах нефробиопсии и оценке гистологического материала, но эта инвазивная процедура сопряжена со множеством рисков и часто не в состоянии предсказать клиническое течение или реакцию на лечение. Сегодняшние достижения в области генетики и молекулярной биологии позволяют выяснить новые патогенные механизмы развития иммунологических нарушений в почечной ткани. Эти открытия способствуют появлению новых биомаркеров и открывают перспективы неинвазивной диагностики для улучшения прогнозирования заболеваний почек.
Таким образом, помимо гистопатологической оценки, клинические биомаркеры специфических патогенных процессов помогут облегчить терапевтический выбор препаратов в процессе лечения гломерулопатий [4]. Гепарансульфат (Heparan sulfate) – один из видов гликозаминогликанов, входящих в состав базальной мембраны клубочков (БМК). При гломерулярных повреждениях снижение уровня гепарансульфата ведет к утере отрицательного заряда мембраны и, как следствие, повышению ее проницаемости для альбумина и других белков. Гепарансульфат относится к профиброгенным факторам. Он связывает экстрацеллюлярные матриксные компоненты и молекулы клеточной поверхности. Белок взаимодействует с ламинином, пролоргином, коллагеном IV типа, транстиретином, факторами роста и участвует в большом количестве биологических процессов в организме человека: ангиогенезе, свертывании крови и метастазировании, а также является ключевым компонентом сосудистого экстрацеллюлярного матрикса, выполняющего функцию эндотелиального барьера. Вследствие этого протеогликаны, в том числе и гепарансульфат, могут быть рассмотрены как профиброгенные факторы. Но в то же время в течение последнего десятилетия стало очевидно, что гепарансульфат имеет решающее значение для накопления лейкоцитов на эндотелии. Из этого можно сделать вывод, что гепарансульфат обладает не только профиброгенным действием, но и служит одним из факторов, влияющих на адгезию иммунокомпетентных клеток на эндотелии, тем самым ухудшая эндотелиальную дисфункцию.
Измерение сывороточных уровней гепарансульфата может дать ценную информацию в отношении оценки активности воспалительного процесса, выраженности эндотелиальной дисфункции, а также оценить риск развития тубулоинтерстициального фиброза.
Цель исследования – определить взаимосвязь уровня гепарансульфата в сыворотке крови больных с различными формами ХГН с различными морфологическими проявлениями в почечной ткани.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 80 больных с ХГН в стадии обострения (48 мужчин и 32 женщины, средний возраст 35,6±10,8 лет). Медиана продолжительности ХГН составила 3 года [1, 2, 11, 12]. В группы были включены больные со следующими морфологическими формами ХГН: IgA-нефропатия – 40 человек; IgM-нефропатия – 2 человека; фокально-сегментарный гломерулосклероз – 16 человек; мембранозная нефропатия – 10 человек; мембрано-пролиферативный гломерулонефрит – 2 человека; болезнь минимальных изменений – 10 человек.
Больных с нефротическим вариантом течения заболевания было 62,5%, с нефритическим – 37,5%. ХБП распределялась по стадиям следующим образом: ХБП 1 стадии – 1 человек; ХБП 2 стадии – 25 человек; ХБП 3А стадии – 11 человек; 3Б стадии – 4 человека; ХБП 4 стадии – 39 человек.
Было проведено детальное физическое обследование: подробно собирался анамнез заболевания, оценивались длительность течения и клинические проявления нефрита, наличие сопутствующих заболеваний, особенности лечения. Из лабораторных методов обследования при подготовке данной статьи проводилось определение сывороточного уровня гепарансульфата методом количественного иммуноферментного анализа (ИФА) (Luminex MAGPIX, США). Выполнялась пункционная нефробиопсия под местной инфильтрационной анестезией, делался забор трех биоптатов для гистологического исследования с помощью люминесцентного микроскопа Leica DM 6000 (Германия).
 При определении морфологического варианта гломерулонефрита учитывали признаки повреждения эпителиального, мезангиального, эндотелиального паттерна. Оценивались признаки изменения подоцитов (дистрофия, гипертрофия клеток, сглаживание отростков), повреждения мезангиальных клеток (расширение матрикса, гиперклеточность), развитие фокального сегментарного гломерулосклероза (сегментарный гиалиноз, утолщение базальных мембран, адгезия капилляров клубочка, сращение капиллярных петель с капсулой Боумена), наличие полулуний, признаков активного процесса воспаления в почечной ткани, таких как свечение С3-компонента, а также отложение депозитов IgA и IgG в мезангиуме,
При определении морфологического варианта гломерулонефрита учитывали признаки повреждения эпителиального, мезангиального, эндотелиального паттерна. Оценивались признаки изменения подоцитов (дистрофия, гипертрофия клеток, сглаживание отростков), повреждения мезангиальных клеток (расширение матрикса, гиперклеточность), развитие фокального сегментарного гломерулосклероза (сегментарный гиалиноз, утолщение базальных мембран, адгезия капилляров клубочка, сращение капиллярных петель с капсулой Боумена), наличие полулуний, признаков активного процесса воспаления в почечной ткани, таких как свечение С3-компонента, а также отложение депозитов IgA и IgG в мезангиуме,
Статистический анализ полученных результатов проводился с помощью программ Microsoft Office Excel 2010 (Microsoft Corp., США) и STATISTICA 10.0 (StatSoft Inc., США). С целью оценки типа распределения показателей в группе применяли критерии Колмогорова–Смирнова и Шапиро–Уилка. При значениях p >0,05 распределение считали не отличающимся от нормального. Корреляционный анализ осуществлялся с помощью коэффициента Спирмена и Kendall Tau. Коэффициент корреляции (r) считался значимым при р <0,05. Для категориальных признаков при анализе связей между признаками использовали критерий Фишера с расчетом χ2.
РЕЗУЛЬТАТЫ
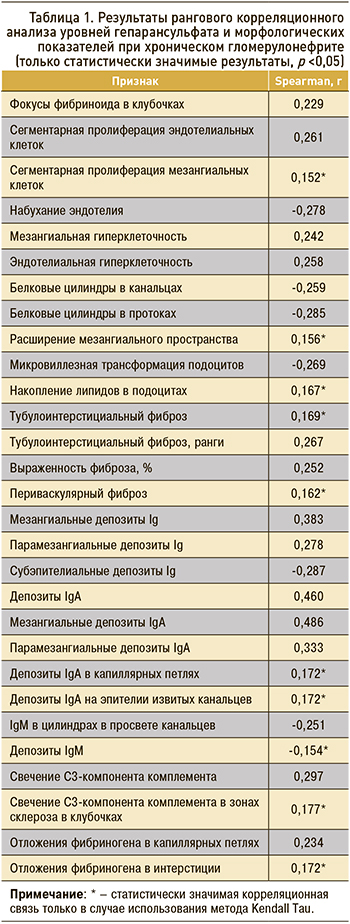
Ранговый корреляционный анализ по Spearman и Kendall Tau значений гепарансульфата и параметров, характеризующих морфологические особенности ХГН, выявил изменения, отраженные в таблице 1.
Повышение уровня гепарансульфата ассоциировалось с сегментарными воспалительными изменениями в клубочке в виде фокусов фибриноида, фокальной пролиферации эндотелиальных и мезангиальных клеток, что, вероятно, свидетельствует о гиперпродукции этого вещества при пролиферативных процессах в клубочках. Об этом также свидетельствует мезангиальная и эндотелиальная гиперклеточность в целом и расширение мезангиального пространства.
Помимо этого, наличие белковых цилиндров в канальцах, сопровождающих нефротические формы нефрита, чаще ассоциируется со снижением уровня гепарансульфата, что соотносится с клиническими данными. Важно отметить, что нарастание гепарансульфата сопровождается снижением обнаружения набухания эндотелия. Данный признак является свидетельством компенсаторно-репаративных процессов в эндотелии в ответ на повреждение/воспаление. Реже на фоне повышения уровня гепарансульфата встречалась микровиллезная трансформация подоцитарных клеток, указывающая на нарушение репаративных процессов со стороны подоцитов в ответ на воспаление. Дополнением к этому факту служит накопление липидов в подоцитах при повышении уровня гепарансульфата, наблюдаемое несмотря на то что повышение этого вещества более характерно для нефритичесчких форм гломерулонефрита, при которых подоцитопатии встречаются редко.
Важным представляется обнаружение ассоциации высоких значений гепарансульфата с явлениями тубулоинтерстициального фиброза, в том числе с его выраженностью, а также наличием отдельных проявлений тубулоинтерстициального фиброза в виде периваскулярного фиброза. Свечение С3-компонента комплемента, наблюдаемое при повышенном уровне гепарансульфата, свидетельствовало о вовлечении системы комплемента и активации ее по альтернативному пути, чему способствует гепарансульфат. Отложения фибриногена следует рассматривать как проявление более тяжелого повреждения капиллярных петель клубочков и интерстиция в условиях повышенного уровня гепарансульфата. Наличие отрицательной корреляционной связи с депозитами IgM означает, что по мере снижения активности воспалительного процесса происходит и снижение уровня гепарансульфата в крови.
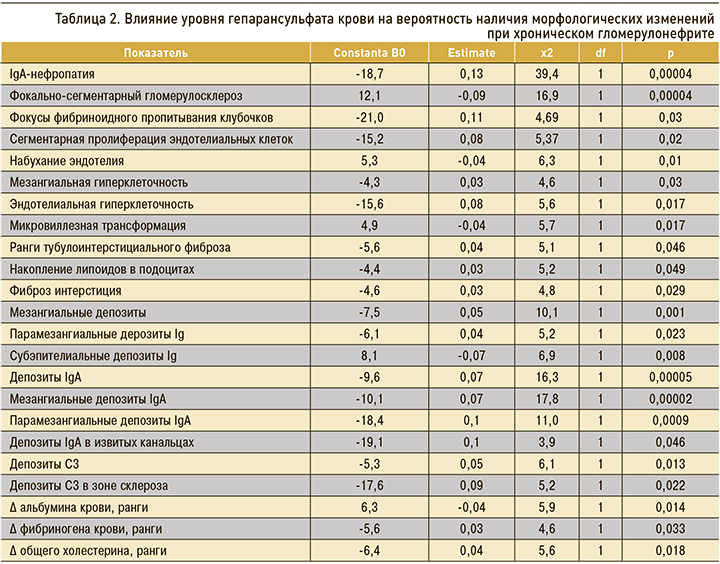
Помимо этого, была рассчитана вероятность наличия различных клинических и морфологических проявлений ХГН в зависимости от уровня гепарансульфата в крови больных (табл. 2).
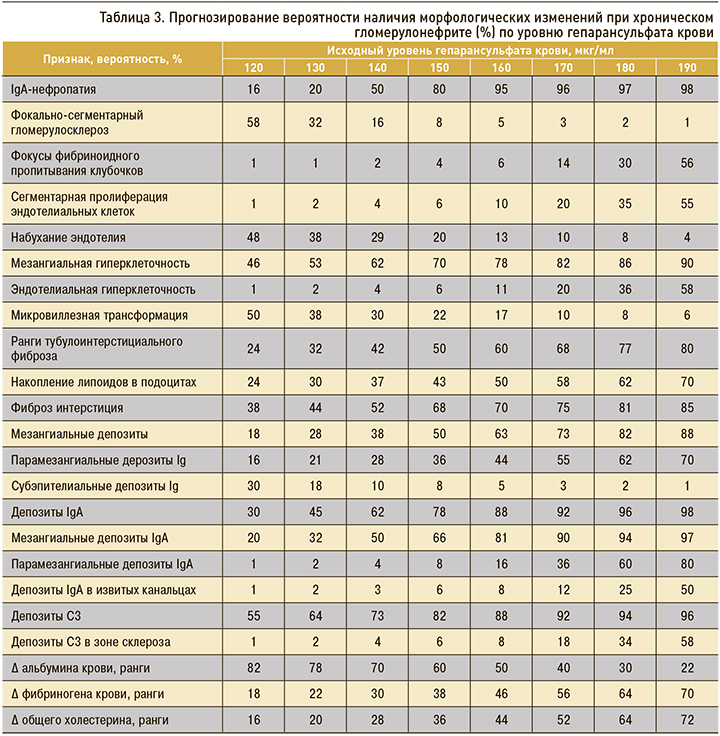
На основании полученных данных в зависимости от исходного уровня гепарансульфата был рассчитан прогноз вероятности наличия тех или иных лабораторных показателей и морфологических проявлений при ХГН (табл. 3).
ОБСУЖДЕНИЕ
В результате проведенного исследования была выявлена взаимосвязь высоких концентраций гепарансульфата крови у пациентов с нефритическим синдромом и IgA-нефропатией, также было установлена взаимосвязь повышения этого показателя с выраженностью тубулоинтерстициального фиброза. В исследовании H. Rienstra et al. было продемонстрировано, что изменения в степени экспрессии протеогликанов тесно связаны с ремоделированием ткани почек после трансплантации. [5, 6]. Роль гепарансульфата в развитии IgA-нефропатии подтверждается в пилотном исследовании, в ходе которого было установлено, что группа мочевых биомаркеров, таких как 8-гидроксигуанозин, додеканал, лейкотриен C4, α1-антитрипсин, комплекс IgA-уромодулин и гепарансульфат, выявлялась у пациентов с IgА-нефропатией. Кроме того, авторы отметили, что в будущем следует оценить, имеют ли эти биомаркеры прогностическое значение, и определить возможность их использования для оценки ответа на терапию [7, 8].
При протеинурических заболеваниях, включая мембранную гломерулопатию, болезнь минимальных изменений, а также IgА-нефропатию и волчаночный нефрит, наблюдается повышенное связывание L-селектина и моноцитарного хемотаксического фактора-1 (МСР-1) с гепарансульфатом. Это обусловливает выраженные тубулоинтерстициальные изменения, опосредованные действием гепарансульфата при первичном заболевании почек, которые могут влиять на выраженность воспалительного ответа. Эти данные демонстрируют роль гепарансульфата не только как профиброгенного агента, но и как фактора, влияющего на развитие и выраженность эндотелиальной дисфункции, что может стать предметом дальнейших исследований [9, 10].
Роль протеогликанов в развитии IgA-нефропатии также подтверждаеся в исследовании Ebefors et al., где избыточная экспрессия белка декорина была обнаружена в склеротических клубочках, но отсутствовала в неповрежденных клубочках у пациентов с IgA-нефропатией или в контрольной группе. Как выяснили авторы, активация бигликана и декорина, а также самого трансформирующего фактора роста бета (ТФР-β) указывает на то, что регуляция TФР-β и других профибротических маркеров играет роль в развитии IgA-нефропатии. ТФР-β, который, как известно, взаимодействует с перлеканом, декорином и бигликаном, был активирован как на уровне генов, так и на уровне белка в клубочках. Было показано, что перлекан выступает возможным прогностическим маркером для пациентов с IgA-нефропатией. Это исследование дает дополнительное понимание молекулярных механизмов, участвующих в расширении мезангиального матрикса при IgA-нефропатии [11].
Эти изменения, выявленные при проведении различных исследований, согласуются с патологическими процессами и клинико-лабораторными изменениями у больных с ХГН, обнаруженными при повышении концентрации гепарансульфата в ходе нашего исследования.
ЗАКЛЮЧЕНИЕ
Установлено, что повышение уровня гепарансульфата крови наблюдается преимущественно при IgA-нефропатии и нефритическом варианте ХГН и ассоциируется с развитием клинико-морфологических проявлений этих форм и проявлений гломерулопатий.
Результаты исследования демонстрируют важную роль гепарансульфата в процессе ремоделирования тубулоинтерстиция, подтверждают его роль как маркера повреждения почек в большей степени при IgA-нефропатии и нефритическом синдроме. Изученный показатель служит маркером тубулоинтерстициального фиброза, а определение уровня гепарансульфата в сыворотке крови может стать информативным неинвазивным методом, позволяющим оценивать активность заболевания и прогноз течения ХГН.



