Хронические заболевания легких и дыхательных путей представляют собой серьезную проблему для здравоохранения как в развитых странах, так и в странах с формирующейся рыночной экономикой [1–3]. Такие хронические респираторные заболевания, как бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ), являются одними из основных драйверов роста медицинских расходов, а также снижения производительности труда [1, 4].
Стратегия ведения пациентов с респираторными заболеваниями должна быть направлена на облегчение симптомов и предотвращение прогрессирования патологического процесса, поскольку до сих пор не существует эффективных методик, приводящих к излечению [12, 13]. Наиболее важными фундаментальными направлениями в ведении пациентов признаны прекращение курения, вакцинация против гриппа и пневмококковой инфекции, реабилитация и фармакологическая терапия, которая должна проводиться с учетом тяжести симптомов и риска возникновения обострения [12, 14].
ЗНАЧЕНИЕ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ИММУННОЙ СИСТЕМЫ В РАЗВИТИИ ПУЛЬМОНОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И ПРОБЛЕМЫ АНТИБИТИКОТЕРАПИИ
Важная роль в развитии патологии органов дыхания принадлежит функциональному состоянию иммунной системы. Многократные вирусные и бактериальные атаки при острых респираторных инфекциях вызывают напряжение, а затем и истощение иммунной системы, срыв компенсаторно-адаптационных механизмов, что, в свою очередь, ведет к снижению иммунорезистентности и хронизации процесса [15]. У пациентов выявляется снижение количества Т- и В-лимфоцитов, дисбаланс субпопуляций Т-клеток (Т-хелперы/Т-эффекторы), снижение функциональной активности моноцитарно-макрофагальной системы. Наличие вторичного иммунодефицита и недостаточная эффективность традиционной терапии у больных с рецидивирующими инфекциями дыхательных путей создают предпосылки для включения в схемы комплексного лечения таких пациентов иммуномодулирующих препаратов [15].
Бактериальные инфекции занимают важное место в структуре заболеваний респираторной системы. Длительное время сохраняется устойчивая тенденция к повышению заболеваемости и смертности от внебольничных пневмоний, несмотря на активную антибактериальную терапию. У пожилых пациентов смертность от внебольничных пневмоний превышает 30% [4]. В значительной мере эта ситуация связана с формированием антибиотикорезистентности бактериальных агентов. Вклад госпитальных пневмоний в повышение летальности не вызывает сомнения, особенно у пациентов, страдающих хроническими заболеваниями (сахарным диабетом, сердечной и почечной недостаточностью и др.), а также у лиц, перенесших сосудистые катастрофы (инфаркт миокарда, инсульт) [4]. Особое место занимают вентилятор-ассоциированные пневмонии, развивающиеся вследствие бактериальной контаминации при проведении инвазивной вентиляции легких.
Совершенствование имидж-диагностики, в частности, широкое применение компьютерной томографии легких позволило существенно расширить возможности распознавания бронхоэктазов. Известно, что формирование бронхоэктазов происходит в раннем неонатальном периоде из-за развития бронхолегочной дисплазии вследствие аспирации околоплодной жидкости и активных реанимационных мероприятий при асфиксии новорожденного или во взрослом периоде как следствие нарушения структуры легких (тракционные бронхоэктазы при пневмосклерозе, характерные для интерстициальных или деструктивных заболеваний легких) или при длительном течении ХОБЛ с частыми бактериальными осложнениями. Наличие бронхоэктазов предопределяет рецидивирующее течение бактериальных инфекций дыхательных путей у детей и взрослых, что влечет за собой частое использование антибиотиков.
Для ХОБЛ характерно неуклонно прогрессирующее течение. Темпы снижения качества жизни пациентов, развития дыхательной недостаточности и летальности напрямую коррелируют с частотой ежегодных обострений этого заболевания [5, 12–14, 16, 18, 22]. Обострения ХОБЛ неоднородны и не всегда причинно связаны с усилением бронхиальной обструкции, которая фигурирует, скорее, как следствие этих обострений. Важнейшую роль в развитии обострений ХОБЛ играет бактериальная инфекция, проявляющаяся в форме пневмонии или в форме гиперпродукции и инфицирования бронхиального секрета с измененными вязкостными характеристиками, закупоривающего дыхательные пути. В этой ситуации изолированное применение антибиотиков нередко становится недостаточным для разрешения процесса и, главное, для профилактики повторных эпизодов.
Несмотря на значительные успехи в лечении БА, она по-прежнему остается одной из ключевых проблем современной пульмонологии. В настоящее время не принято выделять инфекционно-зависимую БА как отдельный фенотип [6–11], однако не вызывает сомнения роль респираторной инфекции в развитии обострений (инфекционно-зависимые обострения) и ее влияния на течение заболевания в целом. Относительно чаще обострения БА связаны с респираторной вирусной инфекцией, провоцирующей гиперчувствительность и гиперреактивность бронхов, однако бактериальная инфекция (особенно на фоне высокодозной ингаляционной или пероральной стероидной терапии), как правило, протекает дольше и тяжелее. При этом во многих случаях использование антибиотиков может быть существенно ограничено вследствие нередких аллергических реакций у больных БА.
Отдельную проблему составляют острые респираторные вирусные инфекции и острый бронхит, в подавляющем числе случаев имеющий вирусную этиологию. Международный консенсус не предполагает использование антибактериальной терапии при этих заболеваниях, однако в ряде случаев через несколько дней от начала заболевания наступает вторая волна интоксикации, сопровождаемая изменением характера отделяемой мокроты, что с высокой долей вероятности предполагает присоединение бактериальной инфекции. В этих ситуациях использование антибактериальной терапии актуально и оправданно.
Конечно во всех рассмотренных ситуациях антибиотики сохраняют приоритет, однако нельзя не отметить ряд существенных позиций, ограничивающих их роль. Среди этих позиций можно выделить антибиотикорезистентность, токсические и аллергические побочные эффекты, нарушения естественной микробиоты пищеварительного и респираторного тракта и отсутствие превентивного эффекта в отношении рецидивов инфекции.
РОЛЬ ИММУНОМОДУЛЯТОРОВ В ТЕРАПИИ ПУЛЬМОНОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Поиски альтернативного, а чаще аддиктивного варианта антибактериальной терапии привели к разработке целой группы препаратов, относящихся к иммуномодуляторам, включая бактериальные лизаты.
В этой многочисленной группе препаратов выделяется Ликопид (глюкозаминилмурамилдипептид), не являющийся бактериальным лизатом, но близкий к ним по механизму действия, поскольку он представляет собой синтетический аналог структурного фрагмента оболочки (пептидогликана) бактериальных клеток. Глюкозаминилмурамилдипептид (ГМДП) служит активатором врожденного и приобретенного иммунитета, усиливает защиту организма от бактериальных инфекций, оказывает адъювантное действие в развитии иммунологических реакций.
Биологическая активность препарата реализуется посредством связывания ГМДП с внутриклеточным рецепторным белком NOD2, локализованным в цитоплазме фагоцитов (нейтрофилов, макрофагов, дендритных клеток). Препарат стимулирует функциональную (бактерицидную, цитотоксическую) активность фагоцитов, усиливает презентацию ими антигенов, пролиферацию Т- и В-лимфоцитов, повышает синтез специфических антител, способствует нормализации баланса Th1-/Th2-лимфоцитов в сторону преобладания Th1. Фармакологическое действие Ликопида осуществляется посредством усиления выработки ключевых интерлейкинов (IL-1, IL-6, IL-12), фактора некроза опухоли α, γ-интерферона (γ-ИФН), колониестимулирующих факторов. Препарат повышает активность естественных киллерных клеток [15].
Эти свойства Ликопида позволяют обоснованно предполагать его эффективность в профилактике и лечении рецидивирующих бактериальных инфекций, в том числе и в ситуациях, когда эти инфекции становятся триггером обострений хронических респираторных заболеваний (ХОБЛ, БА, бронхоэктатической болезни и др.). Применение препарата может позволить не только снизить вероятность развития обострений, роль которых в прогрессировании заболеваний и снижении качества жизни пациентов чрезвычайно высока, но и существенно сократить использование антибиотиков, что, в свою очередь, способствует уменьшению риска развития токсических, аллергических реакций и формирования антибиотикорезистентности бактериальных агентов.
Рассмотрим возможности использования препарата Ликопид при различных респираторных заболеваниях.
ГЛЮКОЗАМИНИЛМУРАМИЛДИПЕПТИД И БРОНХИАЛЬНАЯ АСТМА
БА является одной из основных глобальных проблем здравоохранения. Поскольку она больше распространена среди молодых людей трудоспособного возраста, экономические последствия снижения производительности труда, обусловленного этим заболеванием, особенно серьезны [1, 6]. По оценкам ВОЗ, количество больных астмой к 2025 г. должно составить порядка 100 млн человек, а общее число людей, испытывающих на себе бремя этого заболевания, включая родителей и членов семей пациентов, – 300 млн [10]. Помимо увеличения распространенности БА, неуклонно возрастают и расходы на ведение одного пациента, что означает драматическое увеличение экономического давления на систему здравоохранения [1, 11].
Эффективность применения ГМДП при БА была продемонстрирована в нескольких клинических исследованиях с участием пациентов с неатопической, в том числе вирус-индуцированной БА, а также с атопической БА в сочетании с синдромом вторичной иммунной недостаточности.
Н.И. Баранова с соавт. изучали возможности иммунотерапии у больных с БА и аллергическим ринитом [23]. В проспективном сравнительном контролируемом открытом исследовании участвовало 188 взрослых пациентов с сочетанием указанных заболеваний, которых распределили в три группы:
- I группа (n=72) получала курс антиген-специфической иммунотерапии (АСИТ) аллергенами золотистого стафилококка или Neisseria perflava;
- пациентам II группы (n=68) предварительно проводили курс лечения препаратом Ликопид (по 10 мг сублингвально 1 раз/сут в течение 10 дней), а затем назначали АСИТ;
- III группу (n=48) составили больные, у которых наблюдались положительные кожные реакции немедленного или замедленного типов на аллерген золотистого стафилококка. Им проводили лечение препаратом Рузам, который представляет собой продукт, приготовленный из термофильного штамма Staphylococcus aureus;
- контрольную группу (n=40) составили практически здоровые лица 18–56 лет.
Клиническую эффективность лечения аллергенами оценивали по 4-балльной шкале, предложенной А.Д. Адо.
После проведенного лечения клиническая эффективность с учетом отличных, хороших и удовлетворительных результатов составила у больных I группы 77,8%, II группы – 92,9%, у больных III группы – 74,8%. При этом, как видно из таблицы 1, у больных I группы эффективность возросла в основном за счет хороших (29,2%) и удовлетворительных результатов (26,4%). Однако неудовлетворительных результатов также оказалось достаточно много (22,2%). В этой группе было выявлено 11,5% побочных реакций на препарат.
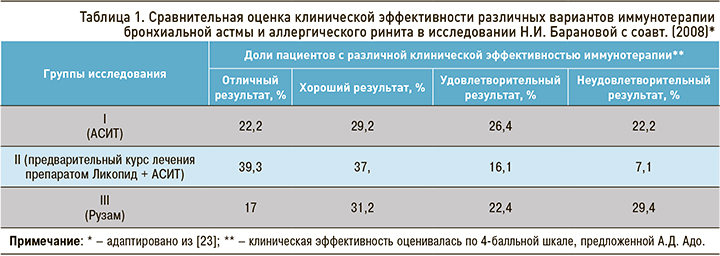
У больных II группы эффективность оказалась выше: возросло количество отличных (39,3%) и хороших (37,5%) результатов. Со стороны дыхательных путей произошло значительное улучшение основных показателей: снизились частота и тяжесть обострений основного заболевания, значительно сократилась потребность в базисной терапии, возросли показатели внешнего дыхания, уменьшилась гиперреактивность бронхов. По данным риноскопии, после лечения во II группе нормализовался цвет слизистой оболочки у 67% пациентов, исчезли слизисто-гнойные выделения у 92%, уменьшилась отечность слизистых оболочек носовых раковин у 82% пациентов. Существенных различий в характере этих изменений у больных разных групп не отмечено.
При включении в комплексную терапию при проведении АСИТ препарата Ликопид (II группа) отмечено снижение побочных реакций (обострений хронических инфекционно-воспалительных заболеваний органов респираторного тракта) с 11,5 до 6%.
По результатам кожных проб с бактериальными аллергенами было обнаружено снижение их интенсивности вплоть до полного исчезновения после проведенного лечения у больных I и II групп. Предварительное лечение препаратом Ликопид значительно снижало частоту побочных реакций при проведении АСИТ. В то же время оба метода лечения в равной степени влияли на механизмы аллергического воспаления, снижая кожную реактивность.
В.Н. Новикова с соавт. [24] исследовали применение ГМДП в комплексном лечении БА у детей. Ими наблюдалось 24 ребенка 8–12 лет с БА, которую исследователи характеризовали как неатопическую, «иммунодефицитную инфекционно-зависимую». Диагноз БА у всех пациентов был верифицирован после аллергологического обследования, включавшего скарификационные пробы, пикфлуометрический мониторинг, определение уровня общего IgE в сыворотке крови, обследование на наличие специфических антител классов IgE к бытовым аллергенам домашней пыли различных серий, шерсти животных, перо подушки. В группу наблюдения (24 больных) были включены дети с отрицательными или слабо положительными («+» у 11 детей) кожными пробами на бытовые аллергены и отсутствием или низким (I класс) уровнем IgE-антител к указанным аллергенам.
Из клинических симптомов наиболее типичным признаком БА у детей было наличие приступов экспираторного удушья, которые, как правило, развивались на фоне ОРВИ или в связи с обострением очага хронической инфекции (ЛОР-патология, желчевыводящая система). Приступы БА возникали только в период острых респираторных инфекций (от 6 до 10 раз в год). Тяжесть течения БА была оценена от среднетяжелой (n=14) до тяжелой формы (n=10).
По мнению авторов работы, представление о том, что IgE-антитела в основном являются причиной многих аллергических заболеваний, не полностью отражает патофизиологию БА; на это указывает связь обострений заболевания у детей, вошедших в исследование, с инфекцией. Исследователи предположили, что в таких случаях пусковым фактором может быть комплекс инфекционных стимулов. Этим они обосновали использование в комплексной терапии основного заболевания препарата Ликопид (ГМДП), который в рамках исследования применялся с конца приступного периода по 1–2 мг (в зависимости от массы тела и возраста) в течение 10 дней 2 раза/сут и далее в поддерживающей дозе 1 раз/сут в течение 10 дней. Контрольную группу составляли 29 детей с БА, получавших обычное лечение без добавления ГМДП.
В основной группе пациентов, получающих терапию с ГМДП, уменьшилась частота повторной заболеваемости после проведенного основного и поддерживающего курсов лечения более чем в 2 раза за период наблюдения в 6 мес. У большинства больных детей этот период совпал с сезонами «осень–зима». Также, у 19 из 24 детей уменьшилась степень удушья во время приступов БА, улучшились показатели пикфлуометрии, вдвое снизился уровень общего IgE в крови.
Основываясь на полученных результатах, авторы исследования сделали вывод, что включение Ликопида в комплекс базисной терапии неатопической БА у детей показано с целью стимуляции иммунитета, уменьшения обострения инфекции и нормализации показателей иммунного статуса. При этом частота сезонных обострений астмы снижается более чем в 2 раза.
Полученные результаты согласуются с результатами другого исследования эффективности иммунотропной терапии у детей с БА, имеющих вирус-индуцированные обострения [25]. В нем приняли участие 60 детей в возрасте от 3 до 11 лет с верифицированным диагнозом вирус-индуцированного фенотипа БА средней тяжести течения, которые были рандомизированных в три сопоставимые по возрасту и полу группы по 20 человек (контрольную группу составили 30 здоровых сверстников). Верификация фенотипов БА проводилась согласно рекомендациям международного согласительного документа PRACTALL (2008) с учетом наследственного и анамнеза заболевания, аллергологического обследования, цитологического исследования мокроты и назального секрета и ПЦР-анализа РНК и ДНК вирусов в соскобе со слизистой оболочки зева. Критериями исключения из исследования были тяжелое течение БА и применение иммунокорригирующих препаратов в предшествующие 6 мес.
Пациентам I группы назначалась только базисная противовоспалительная терапия (антилейкотриеновые препараты в сочетании с низкими дозами ингаляционных глюкокортистероидов). Пациенты II группы в дополнение к базисной терапии получали препарат лизатов бактерий Staphylococcus aureus, Streptococcus pyogenes, Streptococcus viridans, Streptococcus pneumoniae, Klebsiella pneumoniae, Klebsiella ozaenae, Haemophilus influenzae B, Neisseria catarrhalis (по 1 подъязычной таблетке 7 мг 1 раз/ сут в течение 10 дней с перерывом в 20 дней, три курса). Пациенты III группы в дополнение к базисной терапии получали ГМДП (Ликопид) в форме таблеток по 1 мг 1 раз/сут в течение 10 дней с перерывом в 20 дней, три курса.
Основные результаты этого исследования представлены в таблице 2. Отметим, что в группах детей с БА, получавших иммунотропные препараты, при исследовании в динамике определялось увеличение спонтанной и митоген-индуцированной способности клеток к синтезу γ-ИФН, которое было более значимым при использовании Ликопида (p <0,01). В первой группе на фоне противовоспалительной базисной терапии в течение 3 мес сохранялись, а у 25% детей усугубились нарушения митоген-индуцированной способности клеток синтезировать γ-ИФН.

Исследование продемонстрировало, что включение ГМДП (Ликопида) в программы терапии таких детей корректирует дисбаланс продукции клетками периферической крови γ-ИФН и ИЛ-4, показателей клеточного звена иммунитета, определяет увеличение числа Т-лимфоцитов с цитотоксическими функциями и экспрессии активационных маркеров. Клинически это проявляется уменьшением триггерной значимости вирусных инфекций, частоты и тяжести обострений БА и повышением контроля болезни.
Одно из первых клинических исследований, в рамках которого изучалась роль ГМДП в контроле БА с сопутствующим синдромом вторичной иммунной недостаточности (ВИН), было проведено в 2004 г. [29]. В нем приняли участие дети 6–16 лет с БА и сопутствующим синдромом ВИН, который проявлялся частыми ОРВИ, хронической ЛОР-патологией, рецидивирующим лабиальным герпесом и дисбиозом кишечника. Общее количество эпизодов инфекций составило от 6 до 14 в год. Длительность заболевания составила от 2 лет и более.
I (контрольную) группу составили 25 детей, получавших только стандартную терапию БА: противовоспалительную (ИГКС и/или кромоны), а также симптоматическую (β2-агонисты короткого действия, препараты метилксантинового ряда, муколитики).
Во II группу (n=30) вошли больные, получавшие дополнительно к стандартной терапии Ликопид. Иммунокоррекция этим препаратом проводилась по схеме: по 1 мг 2 раза/сут 10 дней, 2 курса с интервалом в 1 мес. Оценку результатов наблюдения осуществляли на протяжении 6 мес.
В контрольной группе детей со среднетяжелым течением БА, осложненной синдромом ВИН, терапия практически не изменила частоту и тяжесть интеркуррентных инфекций (у 100% обследуемых больных). В то же время курсы медикаментозной иммуномодулирующей терапии дали положительные клинические результаты, которые выражались в достоверном снижении количества эпизодов ОРВИ в год с 8,6±1,07 исходно до 6,4±0,7 в I подгруппе основной группы (пациенты с лучшим контролем над заболеванием) и с 10,2±1,15 исходно 7,1±0,2 во II подгруппе (пациенты с более тяжелым течением БА).
Также проведение иммунокорригирующей терапии привело к значительному уменьшению продолжительности обострения бронхообструктивного синдрома на фоне ОРВИ – до 2,9±0,09 дней в подгруппе с лучшим контролем над заболеванием и до 5,1±0,09 дней в подгруппе с более тяжелым течением. Уменьшение выраженности инфекционного синдрома отчетливее прослеживалось у детей с лучшим контролем над течением заболевания. При этом в контрольной группе частота ОРВИ и продолжительность обострения бронхообструктивного синдрома оставалась на прежнем уровне.
В основной группе исследования отмечался позитивный сдвиг микробного пейзажа: удельный вес нормальной микрофлоры возрос более чем в 1,75 раза в I подгруппе и в 2 раза – во II подгруппе. Положительная динамика клинических проявлений БА была сопоставима с результатами группы пациентов, получавших только комбинированную базисную терапию. Сравнительный анализ показателей функционального состояния бронхов в процессе лечения как в контрольной группе, так и на фоне иммунокорригирующей терапии выявил достаточно быстрое и стойкое восстановление бронхиальной проходимости. Так, на фоне приема Ликопида у детей в I и II подгруппах основной группы ПОВ увеличился на 22,5 и 31,2% соответственно. Жизненная емкость легких (ЖЕЛ) возросла в 1,3 раза в обеих подгруппах. Во всех группах, включая контрольную, как до лечения, так и после преобладали среднетяжелые приступы. До лечения тяжелые приступы БА наблюдались в 2 раза чаще, чем легкие. Во всех группах удельный вес легких приступов возрос примерно в 2 раза, в то время как число тяжелых сократилось также вдвое.
Благодаря проведению иммунокоррекции у части пациентов стало возможным сначала снизить дозу ИГКС, а затем перейти на базисную терапию препаратами кромогликанового ряда.
Проведение превентивной иммунокоррекции у детей со среднетяжелым течением БА привело к восстановлению Т-клеточного звена иммунной системы за счет улучшения процессов дифференцировки с преобладанием зрелых форм, увеличению количества CD4+-лимфоцитов. Принципиально важным моментом в действии иммунокорригирующей терапии является возрастающая ФГА-стимулированная пролиферативная активность лимфоцитов. Достоверные позитивные изменения в аллерген-индуцированной пролиферации лимфоцитов были отмечены в подгруппах больных, получавших иммунокоррекцию Ликопидом, тогда как у пациентов контрольной группы этот показатель существенных изменений не претерпевал. Анализ динамики изменений уровня основных маркеров аллергического воспаления продемонстрировал снижение уровня общего IgE у всех пациентов, принимавших Ликопид.
В исследовании была отмечена прямая корреляционная связь между содержанием IgE и уровнем сывороточного IL-4. Так, было выявлено достоверное снижение IL-4 на фоне применения Ликопида в 1,6 и 1,2 раза в I и II подгруппах соответственно. Снижение уровня общего IgE и IL-4 сопровождалось изменением соотношения субпопуляций Т-лимфоцитов (Th1/Th2): достоверное уменьшение уровня Th2 наблюдалось у детей на фоне лечения Ликопидом, уровень Th1 статистически достоверных изменений не претерпел. Показатели контрольной группы оставались на исходном уровне. Также было зарегистрировано достоверное повышение CD20+-лимфоцитов, что сопровождалось более интенсивным процессом антителогенеза IgG.
Пациенты с атопической БА в сочетании с клиническими проявлениями синдрома ВИН также были изучены в более позднем сравнительном клиническом исследовании О.В. Скороходкиной и А.В. Лунцова [31]. Всего под наблюдением находилось 44 пациента. Критериями включения в исследование являлись неконтролируемое течение БА на фоне базисной терапии ингаляционными ГКС (эквивалент беклометазона дипропионата 500–1000 мкг/сут) и ассоциация обострений атопической БА с рецидивирующими инфекционными процессами дыхательных путей.
Анализ причин отсутствия контроля БА показал, что у всех обследованных пациентов первично были исключены нарушения техники ингаляции лекарственных препаратов и низкий комплаенс. Также у них отсутствовали признаки активности ряда заболеваний, влияющих на уровень контроля БА, таких как аллергический ринит персистирующего течения, синусит, гастроэзофагеальная рефлюксная болезнь и др. Элиминационные мероприятия с учетом выявляемой сенсибилизации к аэроаллергенам выполнялись в стандартном объеме. При этом у всех пациентов потеря контроля над БА развивалась в четкой причинно-следственной связи с клинической манифестацией респираторных инфекций: признаками ринита, фарингита, воспалительными явлениями со стороны трахеи и бронхов в виде возникновения продуктивного кашля, при этом часто с признаками бактериальной инфекции (гнойный характер мокроты) и системными симптомами (интоксикация, повышение температуры тела). В соответствии с рекомендациями диагноз синдрома ВИН у обследованных пациентов устанавливался на основе характерной клинической картины инфекционных проявлений: в исследование вошли больные, имевшие острые респираторные инфекции чаще 5 раз в год, а при наличии диагностических критериев сопутствующего хронического бронхита – с его обострениями более 2 раз в год [32].
В процессе исследования все наблюдаемые пациенты были разделены на 2 группы, сопоставимые по возрасту, длительности и характеру течения БА, а также объему проводимой базисной терапии.
Для подтверждения фенотипа атопической БА проводилось аллергологическое обследование, включавшее постановку скарификационных кожных проб с неинфекционными аллергенами, определение общего и аллерген-специфических IgE. По результатам проведенного этого обследования у пациентов I и II групп преобладала сенсибилизация к группе бытовых аллергенов (91,7 и 100% соответственно), у 56,8% наблюдалась сочетанная сенсибилизация. Кроме того, у пациентов I и II групп определяли показатели иммунного статуса: CD-типирование популяций и субпопуляций лимфоцитов с подсчетом относительных и абсолютных величин, уровень сывороточных IgA, M, G, процент фагоцитоза, фагоцитарное число, НСТ-тест.
Всем пациентам I и II групп назначалась базисная противовоспалительная терапия (согласно рекомендациям GINA, 2017) в виде фиксированной комбинации будесонид по 160 мкг + формотерол по 4,5 мг в режиме единого ингалятора. В комплексную терапию пациентам I группы был включен ГМДП (Ликопид) в дозе 10 мг внутрь 1 раз/сут в течение 10 дней. Контроль клинического течения БА (частота дневных и ночных симптомов, потребность в экстренном приеме бронхолитика, ограничение активности), параметров спирографии и иммунного статуса осуществлялись через 10 дней, 1 и 3 мес в динамике, частота инфекционных эпизодов и связанных с ними обострений БА оценивалась через 3 мес после начала наблюдения.
У 33,3% пациентов I группы и у 40% больных II группы была обнаружена абсолютная и/или относительная лимфопения (со снижением уровня CD4-, CD19-клеток). Снижение уровней сывороточных иммуноглобулинов наблюдалось у 16,7% больных I группы и у 15% пациентов II группы. Нарушение функциональной активности фагоцитов отмечалось в 83,3% случаев у больных I группы и у 85% пациентов II группы, что послужило дополнительным лабораторным критерием диагноза ВИН и обоснованности включения в комплексную терапию больных I группы ГМДП (Ликопида).
Параметры иммунного статуса у пациентов II группы значимо не изменялись. В свою очередь, у больных I группы, получавших ГМДП, уже через 10 дней от начала лечения возрастали показатели фагоцитарной активности, фагоцитарного числа. Важно подчеркнуть, что положительные изменения фиксировались и через 1 мес лечения, а через 3 мес только у 45,8% больных отмечалось снижение приведенных параметров (p <0,001). Положительная динамика также наблюдалась со стороны количества лимфоцитов и уровней сывороточных иммуноглобулинов.
Анализ течения инфекционного синдрома у наблюдаемых пациентов показал, что характерные признаки острых инфекционных процессов дыхательных путей у пациентов I группы не фиксировались или отмечались значительно реже. При этом частота обострений БА в ассоциации с респираторными инфекциями, потребовавших изменения базисной терапии, за весь период наблюдения у пациентов I группы была также ниже, чем у больных II группы (8,3 и 45% соответственно, p <0,001). Исследователи связали это с уменьшением проявлений инфекционного синдрома на фоне проводимой адекватной иммунотропной терапии препаратом ГМДП (Ликопид).
Через месяц от начала лечения частота дневных приступов удушья у пациентов I группы не превышала 0,4, что было достоверно ниже аналогичных показателей II группы – 1,2 (р <0,05). Частота ночных приступов затрудненного дыхания также уменьшилась, однако достоверных различий по данному показателю у пациентов I и II групп установить не удалось. Улучшение клинической симптоматики в целом привело и к уменьшению использования пациентами агонистов β2-адренорецепторов короткого действия.
Таким образом, пациенты I группы, получавшие в комплексной терапии Ликопид, характеризовались достижением лучших показателей контроля БА к концу 1-го месяца терапии. При этом именно у пациентов I группы наблюдалось еще и значимое уменьшение частоты респираторных инфекций и соответственно связанных с ними обострений БА. Это обстоятельство может определять достижение лучших параметров контроля БА у таких пациентов.
Авторы работы сделали вывод, что применение ГМДП может рассматриваться как эффективный метод коррекции синдрома ВИН с клиническими проявлениями рецидивирующих респираторных инфекций у пациентов с атопической БА.
ГЛЮКОЗАМИНИЛМУРАМИЛДИПЕПТИД И ХРОНИЧЕСКИЙ БРОНХИТ
И.Д. Баранова и И.А. Снимщикова [35] изучили эффективность бактериальных иммуномодуляторов в исследовании с участием 563 детей в возрасте от 2 до 10 лет с хроническими заболеваниями респираторного тракта с неотягощенным аллергологическим анамнезом. Авторы выполнили сравнительный анализ клинико-иммунологической эффективности препаратов Рибомунил и Ликопида.
В исследование были включены дети, страдающие частыми (более 3 раз в год) и длительными (21 день и более) обострениями хронического бронхита или частыми ОРВИ (5–6 раз в год). Рибомунил назначали по схеме (независимо от возраста): 3 таблетки утром натощак 4 раза в неделю в течение 3 нед, затем по 3 таблетки 4 дня в неделю на протяжении последующих 5 мес. Ликопид назначали натощак по 1 мг 1 раз/сут в течение 10 дней детям с 2 до 6 лет и по 1 мг 2 раза в день детям с 7 до 10 лет; затем независимо от возраста препарат применялся по 1 мг 1 раз/сут по 10 дней 1 раз в месяц в течение последующих 5 мес.
Клинический эффект оценивался по количеству и длительности эпизодов обострения хронического бронхита или ОРВИ на фоне лечения и после завершения курса приема препарата. При этом использовались следующие градации:
- хороший эффект – отсутствие обострений хронического бронхита или ОРВИ за весь период наблюдения в течение года после начала лечения;
- удовлетворительный эффект – уменьшение количества и длительности обострений;
- отсутствие эффекта – сохранение частых и длительных обострений, несмотря на проводимое лечение.
В общей сложности Ликопид получали 340 детей, Рибомунил – 223. Как показало проведенное исследование, дети хорошо переносили оба препарата. Стойкая ремиссия в течение года после окончания лечения Ликопидом отмечалась у 50 % (170) детей, в течение 2 лет – у 10 % (34). У 45 % (153) детей наблюдалось снижение частоты и длительности обострений, отсутствие эффекта — только у 5 % (17).
При изучении иммунного статуса детей до назначения соответствующей терапии было выявлено снижение функциональной активности фагоцитирующих клеток (у 81 % детей), снижение уровней IgA (у 3%), CD4 (у 3%). После приема как Рибомунила, так и Ликопида регистрировалась нормализация функциональной активности фагоцитирующих клеток, уровня IgA, CD4-лимфоцитов. Все это позволило заключить, что Ликопид и Рибомунил являются эффективными средствами профилактики обострений хронических инфекций респираторного тракта у часто и длительно болеющих детей [31, 33, 34].
ГЛЮКОЗАМИНИЛМУРАМИЛДИПЕПТИД И ПНЕВМОНИЯ
Возможности применения ГМДП при затяжном течении пневмонии были продемонстрированы в рамках исследования Ш.М. Курьязовой [36]. Была произведена оценка эффективности применения препарата Ликопид с целью повышения иммунологической реактивности в составе комплексной терапии у детей 1–5 лет (n=45) с затяжным течением пневмонии, получавших второй и более курс антибиотиков.
Основная группа исследования (n=25) в дополнение к базисной, антибактериальной, инфузионной и посиндромной терапии получала Ликопид в дозе 1 мг 1 раз/сут в течение 10 дней. У пациентов контрольной группы (n=20) применялась только стандартная схема лечения.
Применение Ликопида в комплексной терапии при затяжном течении пневмонии приводило к достоверно значимому сокращению длительности болезни (по клинико-лабораторным данным и результатам рентгенографии грудной клетки) на 2–3 дня. На фоне терапии Ликопидом сокращалась продолжительность периода, когда состояние больного ребенка расценивалось как тяжелое, уменьшалось количество необходимых антибактериальных препаратов (курсов антибактериальной терапии). Длительность антибактериальной терапии также уменьшалась в группе детей, получавших Ликопид в дополнение к базисной терапии. У детей с затяжным течением пневмонии при приеме Ликопида в динамике отмечалось купирование воспалительных изменений и нормализация количества лейкоцитов в периферической крови с достоверным уменьшением до возрастной нормы абсолютного и относительного числа палочкоядерных и сегментоядерных нейтрофилов, достоверным увеличением абсолютного и относительного количества лимфоцитов. Включение Ликопида в комплексную терапию пневмонии у детей приводило к активации клеток моноцитарно-макрофагального ряда, что подтверждалось достоверным увеличением уровня спонтанной хемилюминесценции по сравнению с контрольной группой.
Также было продемонстрировано достоверное увеличение абсолютного и относительного количества зрелых Т-лимфоцитов (CD3), нормализация иммунорегуляторного индекса (ИРИ=CD4/CD8), достоверное увеличение сывороточного уровня IgM к концу курса лечения Ликопидом по сравнению с показателями иммунного статуса до начала терапии.
Важно отметить и то, что во время исследования не было зарегистрировано ни одной нежелательной реакции, связанной с приемом Ликопида, что подтверждает его высокий профиль безопасности.
ГЛЮКОЗАМИНИЛМУРАМИЛДИПЕПТИД И ТУБЕРКУЛЕЗ ОРГАНОВ ДЫХАНИЯ
К началу 60-х гг. XX в. сложилась концепция о туберкулезе (ТБ) как исчезающей болезни. К сожалению, этот прогноз не оправдался: по-прежнему ежегодно 10 млн человек заболевают различными формами ТБ, и 3–4 млн человек умирают от этого заболевания.
Существенной проблемой последних лет стало распространение множественной лекарственной устойчивости (МЛУ) микобактерий туберкулеза и осложненного течения ТБ у лиц с выраженными иммунодефицитными состояниями (ВИЧ и др.), для которых характерно относительно более частое развитие диссеминированных форм и гнойно-деструктивных процессов. В значительной мере это предопределило поиск иммуномодулирующей терапии в дополнение к традиционной антимикобактериальной терапии [37–39].
Особое значение приобрела проблема лечения больных ТБ, особенно детей, которое, как правило, бывает длительным и не всегда эффективным. Это объясняется как изменением свойств возбудителя (развитием лекарственной резистентности), так и снижением реактивности иммунной системы.
В настоящее время принято расценивать хронические, вялотекущие, рецидивирующие инфекции как вторичные иммунодефицитные состояния, даже если отсутствуют какие-либо изменения в иммунном статусе больного. Поэтому комплексная эффективная терапия детей, больных ТБ, обязательно должна включать препараты, обладающие выраженными иммуномодулирующими свойствами. При этом иммуномодуляторы должны соответствовать следующим требованиям:
- быть безопасными, хорошо переноситься больными, не вызывать серьезных побочных эффектов;
- воздействовать на все звенья иммунной системы: макрофагально-фагоцитарное, гуморальное, клеточное;
- обладать иммунокорригирующими свойствами, т.е. повышать иммунитет при иммунодефиците и угнетать избыточную иммунную реакцию;
- обладать четким механизмом действия на молекулярном и клеточном уровне;
- иметь удобную лекарственную форму.
В методических рекомендациях Ю.А. Фомина с соавт. [40] указано, что Ликопид в комплексном лечении детей, больных ТБ органов дыхания, дает положительный клинический эффект в виде более быстрого исчезновения симптомов интоксикации, ускоряет рассасывание инфильтративных изменений в легких.
Ликопид показал выраженную лейкопоэтическую активность, что проявилось в достоверном увеличении общего числа лейкоцитов у детей при развитии лейкопении. Иммуномодулирующий эффект Ликопида проявился в повышении уровня СD4-лимфоцитов и восстановлении иммунного статуса детей. Ликопид рекомендовано использовать в комплексном лечении ТБ органов дыхания у детей, в том числе у ВИЧ-инфицированных пациентов с этой патологией.
В исследовании Е.А. Лугиновой [41] впервые были выявлены клинико-лабораторные проявления и особенности реакции иммунной системы у детей при инфицировании штаммами микобактерий туберкулеза с МЛУ, показана однотипность этих реакций, определена симптоматика иммунобиологических нарушений у таких пациентов. По результатам этого исследования было обосновано применение превентивного лечения в усиленном режиме в комплексе с иммунокорректором Ликопидом для предупреждения заболевания. Такая методика оказалась более эффективной по сравнению со стандартной схемой химиопрофилактики, о чем свидетельствовали снижение туберкулиновой чувствительности по всем параметрам, существенная прибавка годового прироста весоростового показателя, снижение частоты острых респираторных инфекций, нормализация показателей иммунного статуса у больных детей.
Также в работе Е.А. Лугиновой с соавт. отмечено, что при инфицировании лекарственно-устойчивыми штаммами микобактерий туберкулеза отмечается достоверное снижение в 1,5 раза уровня CD3, CD16, CD20 и иммунорегуляторного соотношения по сравнению с показателями здоровых неинфицированных детей. Применение двух противотуберкулезных препаратов в лечебных дозировках в комплексе с иммунокорректором Ликопидом также позволяет достичь снижения туберкулиновой чувствительности, нормализации показателей иммунитета, снижения частоты заболеваемости острыми респираторными заболеваниями, годового прироста весоростового показателя и предупредить у детей развитие лекарственно-устойчивого туберкулеза.
Применение Ликопида в противотуберкулезной практике у детей, инфицированных лекарственно-устойчивыми штаммами возбудителя, показало его высокую эффективность в профилактике заболевания. Препарат хорошо переносится детьми, не вызывая побочных эффектов.
Для решения вопроса о подключении Ликопида к лечению ТБ органов дыхания решающее значение могут иметь клиническая картина заболевания, данные исследования иммунного статуса и анамнеза, позволяющие заподозрить наличие вторичного иммунодефицита, а также показатели общего анализа крови, подтверждающие снижение относительного уровня лимфоцитов в периферической крови.
При сравнении показателей эффективности лечения двух групп больных фиброзно-кавернозным ТБ легких в работах В.М. Сухова с соавт. [42, 43] были обнаружены статистически значимые различия в уменьшении числа бацилловыделителей: их стало меньше в группе, применявшей Ликопид. При этом среди лиц с сохранившимся бацилловыделением в группе Ликопида стало меньше больных, выделяющих микобактерии с высокой жизнеспособностью.
В свою очередь, результаты проведенного А.С. Борзенко и соавт. исследования показали, что Ликопид хорошо сочетается с этиотропными средствами лечения ТБ органов дыхания, не имеет побочных эффектов, приводит к быстрому уменьшению симптомов туберкулезной интоксикации.
При включении Ликопида в схему лечения больных казеозной пневмонией, инфильтративным, диссеминированным и фиброзно-кавернозным ТБ легких наблюдается стабилизация специфического процесса и значительное улучшение клинико-рентгенологической картины заболевания в виде более раннего закрытия полостей распада легочной ткани, рассасывания остаточных изменений в виде очагов и фокусов.
На фоне приема препарата начинаются положительные изменения содержания форменных элементов периферической крови, которое полностью нормализуется в течение первого месяца и остается стабильным на протяжении 3–4 мес после окончания курса лечения.
По данным А.С. Свистуновой с соавт. [44–47], включение Ликопида в комплексную терапию больных ТБ легких дало выраженный клинический эффект в виде прекращения бактериовыделения у 80% больных, резкого уменьшения количества гнойной мокроты, исчезновения симптомов интоксикации через 2–3 нед, ускорения процессов рассасывания инфильтративных изменений. Выраженный иммунологический эффект при этом проявился увеличением общего числа Т-лимфоцитов, усилением поглотительной и бактерицидной функций фагоцитов.
В диссертации З.Ш. Дусматовой [48] отмечено, что по характеру воздействия на иммунную систему больных ТБ Ликопид проявляет себя как истинный иммуномодулятор, поскольку повышает пониженные и снижает повышенные показатели функциональной активности фагоцитов, не влияя на неизмененные параметры. В этой же работе была продемонстрирована эффективность воздействия на иммунологические показатели комплексного применения противотуберкулезных препаратов и Ликопида у детей с деструктивными формами ТБ.
ЗАКЛЮЧЕНИЕ
Таким образом, представленные в настоящем кратком обзоре данные исследований позволяют заключить, что иммуномодулятор глюкозаминилмурамилдипептид (Ликопид) может быть эффективным средством дополнительной терапии заболеваний органов дыхания в тех ситуациях, когда инфекционный процесс имеет затяжное течение или когда бактериальная или вирусная инфекция выступают в роли триггера обострений хронического респираторного заболевания.



