АКТУАЛЬНОСТЬ
Цирроз печени входит в число шести основных причин смертности людей трудоспособного возраста (35–60 лет) в экономически развитых странах: в них, по разным данным, показатель смертности, ассоциированной с этим заболеванием, составляет от 14 до 30 человек на 100 тыс. населения [1–6].
В России в структуре смертности от болезней органов пищеварения на цирроз и фиброз печени в исходе хронических заболеваний печени (ХЗП) вирусного, алкогольного, аутоиммунного, метаболического генеза приходится более 50% смертей [7–9]. Фиброз и цирроз печени чаще выявляются у людей трудоспособного возраста, приводя к длительным периодам временной нетрудоспособности и инвалидизации [7, 10–13]. Ранняя диагностика ХЗП и фиброза печени представляется на данный момент серьезной проблемой, решение которой может способствовать своевременному и успешному лечению пациентов с гепатопатологией и снижению их смертности.
Фиброз печени – процесс, возникающий в результате альтерации ткани печени и сопровождающийся активацией воспалительного процесса, продукцией медиаторов межклеточного взаимодействия и, как следствие, трансформацией звездчатых клеток печени в миофибробласты [14–18]. Основными средствами диагностики фиброза печени служат неинвазивные методы (фиброэластометрия, фибротесты, ультразвуковое исследование с эластографией) и пункционная биопсия печени [19–21]. Исследования свидетельствуют, что различные методы оценки фиброза печени демонстрируют сопоставимые результаты, что подтверждает возможность использования каждого из способов по отдельности или в комбинациях в случаях, когда результаты не противоречат друг другу [22–25].
Несмотря на наличие в клинической практике различных методов оценки фиброза печени, определение функционального состояния этого органа остается серьезной проблемой для специалистов различных направлений клинической медицины. В настоящее время в клинической практике для определения функционального резерва печени используются клиренс-тесты, среди которых наиболее изучен метод с индоцианином зеленым. Однако данный тест не показал связи с прогнозом и риском летальности при циррозе печени, что ограничивает его применение в повседневной практике [26–29].
13C-дыхательные «печеночные» тесты, в отличие от методов диагностики фиброза печени, предоставляют информацию о функциональной активности и метаболической емкости органа и могут отражать динамику процесса, являясь неинвазивными, безопасными и легко воспроизводимыми. Имеются работы, указывающие на сильную прямую положительную корреляцию (r=0,706) между показателями 13C-метацетинового дыхательного теста (13C-МДТ) и результатами динамической гепатосцинтиграфии у больных с первичным и метастатическим поражением печени [30–33]. В то же время отсутствуют убедительные данные о взаимосвязи 13C-МДТ и стадии фиброза печени. Указывается, что дыхательные тесты могли бы сыграть важную роль в диагностике и лечении ХЗП различной этиологии, а также в трансплантологии, гепатобилиарной хирургии в дои послеоперационном периодах [32, 34, 35].
Таким образом, представляется актуальным изучение возможностей применения 13C-МДТ для скрининга и ранней диагностики нарушений функции печени при различных стадиях ее фиброза, что могло бы способствовать более эффективному проведению лечебно-профилактических мероприятий у пациентов данной категории.
Цель – оценка и сравнение результатов лабораторных и инструментальных методов исследования с неинвазивным дыхательным тестом для оценки функции печени 13C-МДТ.
МАТЕРИАЛ И МЕТОДЫ
В ходе проведенного исследования нами был комплексно обследован 101 пациент с ХЗП. Средний возраст больных составил 48±14 лет. В исследовании приняли участие 55 (54,45%) мужчин и 46 (45,55%) женщин. Среди участников преобладали пациенты в возрасте 30–59 лет (табл. 1): их количество составило 68 человек (67,32%), что соответствует трудоспособному возрасту и подтверждает актуальность проблемы для России. Исходя из установленной стадии фиброза печени, пациенты были разделены на 5 групп: стадия фиброза F0 – 26 (25%), F1 – 23 (23%), F2 – 23 (23%), F3 – 12 (12%), F4 – 17 человек (17%).
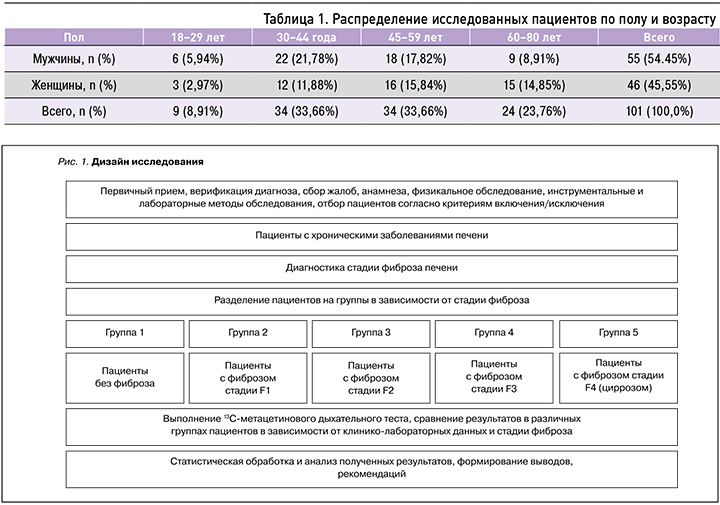
Из распределения пациентов в зависимости от пола и стадии фиброза среди выделенных групп следует, что группы 1, 2, 3, 4 были сопоставимы по полу. В группе 5 (стадия фиброза F4) преобладали мужчины. Следует отметить, что в исследование были включены пациенты с циррозом печени класса А по Чайлд–Пью; больные с другими классами цирроза не участвовали в исследовании в связи с тяжестью состояния.
Дизайн исследования представлен на рисунке 1. Критериями включения в исследование служили наличие ХЗП (на основании результатов комплексного обследования в соответствии с существующими стандартами – лабораторных данных, маркеров генетических и аутоиммунных заболеваний печени, данных ультразвукового исследования, эластометрии, фибротестов, биопсии печени и т.д.); наличие информированного согласия.
Критериями исключениями были отказ от участия в исследовании; острый гепатит; ко-инфекция ВИЧ; возраст менее 18 и более 80 лет; тяжелая коморбидная патология.
Всем пациентам выполнялось общеклиническое исследование: клинический анализ крови, исследование биохимических показателей, во всех случаях выполнялось ультразвуковое исследование (УЗИ) органов брюшной полости с определением наличия асцита, диаметра воротной вены. Эзофагодуоденоскопия осуществлялась при наличии показаний, таких как необходимость уточнения эндоскопических признаков портальной гипертензии (варикозно расширенные вены пищевода, портальная гастропатия).
Лабораторные исследования проводились в образцах сыворотки крови, полученной из венозной крови, стандартными методами. Оценка клинического и биохимического анализа крови производилась на приборе «Спектрум» фирмы Abbott и аппарате Technicon. В клиническом анализе крови у больных определяли уровень гемоглобина, количество эритроцитов, лейкоцитов, тромбоцитов. В биохимическом анализе крови оценивалось общее содержание глюкозы, креатинина, аспартатаминотрасферазы (АСТ), общего билирубина, щелочной фосфатазы, гамма-глутамилтрансферазы (ГГТП), альбумина как биохимических маркеров поражения печени. Исследование выполнялось на биохимическом анализаторе Olympus-480 (Япония) стандартными наборами фирмы Roche (Швейцария).
УЗИ органов брюшной полости осуществлялось на аппаратах Medison SonoAce X8 компании Samsung с конвексным датчиком (частота 2 и 5 МГц). Методом УЗИ оценивались размеры печени и диаметр воротной вены, контуры, структура и эхогенность печени, а также внутрипеченочные протоки и наличие образований печени.
Методы оценки фиброза печени
Пункционная биопсия печени (ПБП) в ходе исследования не выполнялась. Использовались данные биопсии печени, выполненной ранее, но не более чем за 6 мес до включения в исследование. Оценка фиброза в используемых материалах биопсии печени проводилась в соответствии с полуколичественной шкалой METAVIR (F0 – фиброз отсутствует, F1 – портальный фиброз без септ, F2 – портальный фиброз с небольшим количеством септ, F3 – многочисленные септы без цирроза, F4 – цирроз). Также по этой шкале оценивалась активность воспаления (A0 – активность отсутствует, А1 – минимальная активность, А2 – умеренная активность, А3 – выраженная активность) [36].
В случае отсутствия данных ПБП выполнялись другие методы определения степени фиброза печени, такие как Фибротест, эластометрия печени с функцией оценки стеатоза по скорости затухания ультразвуковой волны (CAP). При использовании методов Фибротесты применялись патентованные методы расчета степени фиброза по патентованным формулам компании BioPredictive.
Фибротест относится к биохимическим способам определения выраженности поражения печени и активности воспалительного процесса в ней. Считается, что Фибротест может быть некорректным при диффузных заболеваниях соединительной ткани (ревматизме, ревматоидном артрите, системной красной волчанке, склеродермии и др.), наследственных гипербилирубинемиях, например при синдроме Жильбера, приеме любых лекарственных средств. Это ограничивает применение указанного метода у пациентов данной категории [37].
Фибротест – это специальный биохимический анализ крови, основанный на определении биомаркеров фиброза в крови пациента. Метод включает 5 биохимических показателей: альфа2-макроглобулин (АМГ), гаптоглоблин (Нр), аполипопротеин А1 (Апо А1), ГГТП, общий билирубин. АктиТест – метод оценки активности воспаления, включающий перечисленные выше 5 показателей и дополнительно аланинаминотрансферазу (АЛТ) [38, 39]. На основе перечисленных показателей с учетом возраста пациента и пола рассчитывается значение, позволяющее при высокой чувствительности и специфичности определить стадию фиброза и степень активности воспаления [37]. При проведении Фибротеста и Актитеста используются математические формулы, которые для получения результата теста обрабатывают данные биохимических параметров поражения печени.
Показаниями к проведению Фибротеста и Актитеста являются не только ХЗП, но и подозрение на НАЖБП при повышении массы тела и сахарном диабете, частое употребление алкоголя, длительный прием лекарственных препаратов и т.д. Эластометрия выполнялась на аппарате Fibroscan 502 touch. Соноэластография сдвиговой волной с применением аппарата проводилась натощак. Замеры печеночной ригидности осуществлялись в правой доле печени в положении пациента лежа на спине с максимально отведенной правой рукой. Было получено четыре измерения, результат выражен медианой измерений в килопаскалях (кПа, kPa). Для оценки стадии фиброза по шкале METAVIR использовалась следующая система критериев (при этом результаты фиброэластометрии, выраженные в килопаскалях, переводились в баллы): показатели эластичности печени ≤5,8 кПа соответствовали стадии фиброза F0, 5,9– 7,2 кПа – F1, 7,3–9,5 кПа –F2, 9,6–12,5 кПа – F3, ≥2,6 кПа – F4.
Первичное определение стадии фиброза печени осуществлялась следующими методами: сочетание эластометрии с фибротестами или биопсия печени. Также пациентам для оценки функции печени проводился тест 13C-МДТ: он выполнялся на газовом анализаторе IRIS согласно стандартной схеме выполнения дыхательного теста. Принцип дыхательного теста основан на метаболизме метацетина: субстрат принимают перорально, он всасывается в желудочно-кишечном тракте, проходит через кровоток, метаболизируется в печени, а затем выводится через легкие в виде 13CО2. По скорости вывода углеродной метки определяют скорость и объем метаболизма в системе CYP450 1A2 [40, 41].
Методика проведения 13C-метацетинового дыхательного теста
Забор образцов выдыхаемого воздуха производится в течение 120 мин – перед приемом препарата, затем каждые 10 мин в первый час исследования и через каждые 20 мин в течение второго часа [42].
Первым метаболическим процессом, которому подвергается 13C-метацетин, является О-деметилирование – отщепление меченной изотопом 13C-метильной группы, происходящее при каталитическом воздействии энзимов системы цитохромов печени Р450 с синтезом формальдегида. В дальнейшем метка входит в состав муравьиной кислоты и бикарбонат-иона и выводится через легкие в виде 13CО2. Когда субстрат 13C-метацетин попадает в организм, он проходит через кровоток, метаболизируется в печени (проходит деметилирование) с образованием ацетаминофена (парацетамола) и летучего соединения (формальдегида), который затем выводится через легкие в виде 13CО2. Скорость и объем выведения субстрата определяют метаболическую функцию печени [33]. Таким образом, измеряя изотопный состав углерода в углекислоте выдыхаемого воздуха, получают информацию о скорости печеночного метаболизма.
Исследование проводится на инфракрасном (ИК) газовом анализаторе IRIS (Германия). Результаты каждого исследования представляют в виде зависимостей скорости вывода экзогенной углеродной метки (PDR) от времени и суммарной доли выведенной метки от времени [8, 9].
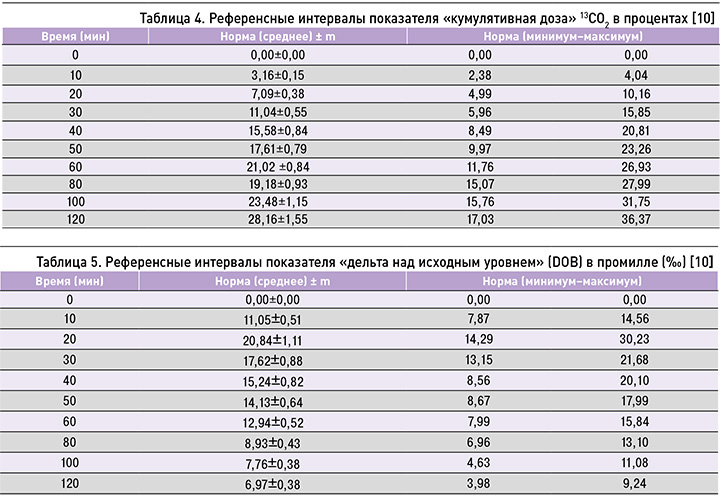
Учитывались такие показатели теста, как кумулятивная доза (CUM) 13C (отражает объем метаболизированного субстрата, измеряется в процентах), доза в час (dose/h) (процент от введенной дозы метацетина) и дельта над исходным уровнем (DOB), выраженная в промилле, в течение 120 мин. С помощью 13C-МДТ у пациентов с ХЗП оценивали микросомальное окисление в печени, степень фиброза. Далее параметры 13C-МДТ сравнивали с клинико-лабораторными параметрами больных.
В ходе изучения 13C-МДТ исследователями выделены референсные значения данного теста (табл. 2–5) [43–46].

РЕЗУЛЬТАТЫ
Распределение исследованных пациентов в зависимости от этиологии ХЗП представлено на рисунке 2. Из представленных данных следует, что в исследование вошли 47 пациентов (46%) с хроническими вирусными гепатитами В и С, 16 человек (16%) – с неалкогольной жировой болезнью печени (НАЖБП), 16 (16%) – с токсическими (алиментарными) гепатитами, 11 человек (11%) – с аутоимунными заболеваниями печени, 11 человек (11%) – с хроническими холестатическими заболеваниями печени, лекарственно-индуцированными поражениями печени (ЛИПП).

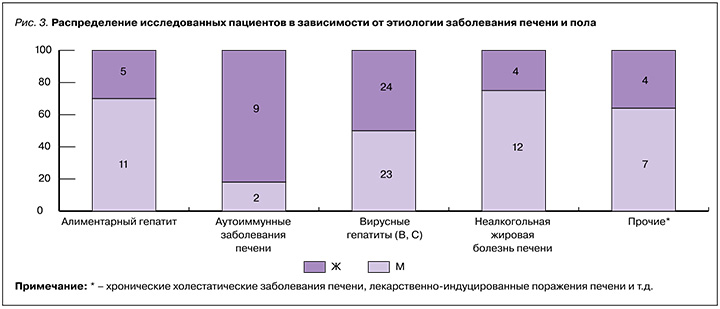
Распределение ХЗП по этиологии среди исследованных пациентов характеризовалась гендерными различиями, отраженными на рисунке 3. Алиментарный гепатит чаще встречался у мужчин (n=11; 68,75%), среди пациентов с аутоиммунными заболеваниями печени отмечалось преобладание женщин (n=9; 81,81%). В группе вирусных гепатитов В и С соотношение женщин и мужчин было примерно равным – 51% и 49% соответственно. В группе с НАЖБП превалировали мужчины (n=12; 75%).
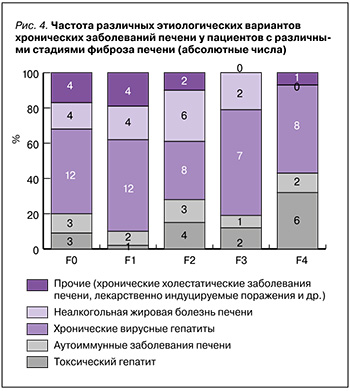
Из данных рисунка 4 видно, что распределение этиологических вариантов ХЗП среди пациентов с различными стадиями фиброза соответствовало нормальному (р >0,05), с закономерным преобладанием вирусных гепатитов, НАЖБП. Следует отметить, что в группе с циррозом печени (F4) численно доминировали пациенты с хроническими вирусными гепатитами и отсутствовали больные с НАЖБП. Корреляция результатов лабораторного обследования и фиброза печени
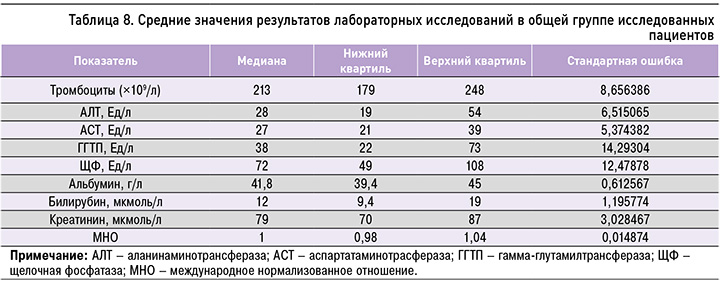
В ходе исследования нами проводились сравнения в группах пациентов с различными стадиями фиброза по следующим показателям: уровень тромбоцитов, АЛТ, АСТ, ГГТП, щелочной фосфатазы (ЩФ), альбумина сыворотки, билирубина общего, билирубина непрямого, креатинина, международное нормализованное отношение (МНО). Средние значения лабораторных показателей при начальных стадиях фиброза печени (F0–F2) представлены в таблице 6, при выраженном фиброзе – в таблице 7. В таблице 8 приведены средние значения в общей группе пациентов.
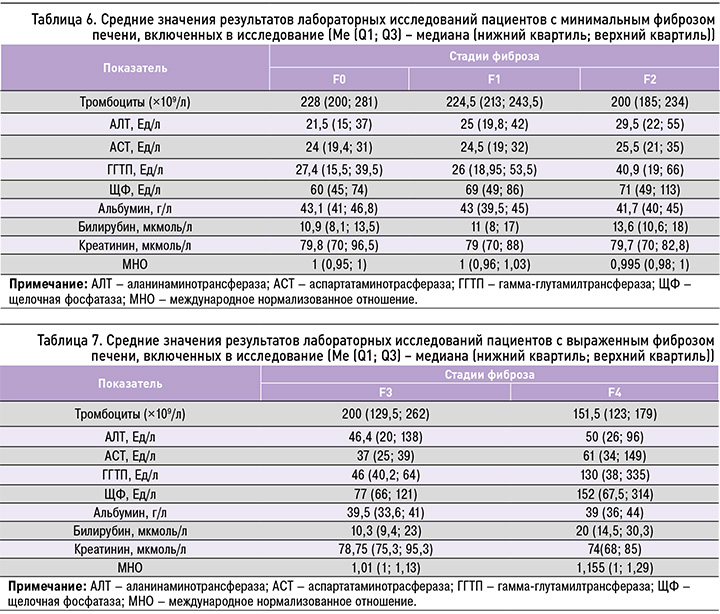
Далее проводился анализ полученных результатов и попарное сравнение групп пациентов с различными стадиями фиброза печени. В результате него нами был получен перечень лабораторных показателей, которые достоверно отличались в группах с различными стадиями фиброза.
Между группами 1 и 2 достоверных отличий по лабораторным данным не было. Достоверные различия при попарном сравнении групп наблюдались по следующим параметрам:
- между группами 1 и 3 – по уровню тромбоцитов;
- между группами 1 и 4 – по АЛТ, АСТ, ЩФ, альбумину, МНО;
- между группами 1 и 5 – по всем исследуемым показателям, за исключением непрямого билирубина и креатинина;
- между группами 2 и 3 – по уровню тромбоцитов, непрямого билирубина;
- между группами 2 и 4 – по уровню альбумина, непрямого билирубина;
- между группами 2 и 5 – по всем исследованным лабораторным данным, за исключением тромбоцитов, альбумина, креатинина;
- между группами 3 и 4 – по уровню альбумина, МНО;
- между группами 3 и 5 – по всем исследованным лабораторным данным, кроме тромбоцитов, креатинина;
- между группами 4 и 5 – по уровням ГГТП, непрямого билирубина.
Учитывая обнаруженные отличия между группами, определенные пороговые значения таких лабораторных показателей, как АЛТ, АСТ, тромбоциты, ГГТП, ЩФ, альбумин, билирубин общий, МНО, могут использоваться (наряду с другими методами) как дифференциально-диагностические маркеры для диагностики начальных стадий фиброза и выраженного фиброза печени при обследовании больных с ХЗП.
Для оценки значения лабораторных показателей, полученных в результате исследования при различных стадиях фиброза печени, а также возможности прогнозирования выраженного фиброза печени была построена лог-регрессионная модель. В наибольшей степени с развитием выраженного фиброза печени коррелировали такие показатели, как МНО, уровни тромбоцитов и альбумина. С использованием статистического метода «построение классификационных деревьев» были установлены пороговые значения указанных показателей и выявлены следующие закономерности: вероятность наличия выраженного фиброза при МНО >1,2 выше в 42,3 раза, при уровне тромбоцитов <180×109/л – в 8,7 раз, при уровне альбумина <38 г/л – в 52,2 раза.
Анализ результатов 13C-метацетинового дыхательного теста
В первых трех группах (пациенты без фиброза, со стадиями фиброза F1, F2) достоверных различий в показателях 13C-MДT выявлено не было. Вместе с тем наблюдалась тенденция к появлению различий в ухудшении функционального резерва с нарастанием фиброза печени при укрупнении выборки. Данный факт можно трактовать как возможность наличия дисфункции печени при любой стадии фиброза. Установлены статистически значимые различия между группой без фиброза печени (группа F0) и с фиброзом 3-й стадии (группа F3) по показателям дельты над исходным уровнем на 40-й (DOB-40; p=0,019), на 80-й (DOB-80; p=0,020), 100-й минуте (DOB-100; p=0,028).
Между пациентами из группы без фиброза (F0) и с фиброзом 4-й стадии (F4), а также между группами F1 и F4 обнаружены статистически значимые различия по всем показателям 13C-MДT. В группах F1 и F3 достоверно отличались показатели дозы в час на 40-й минуте теста (p=0,025), DOB-40 (p=0,016). Группы F2 и F4 статистически значимо отличались по всем показателям и временным параметрам 13C-MДT, кроме показателей дозы в час на 80-й минуте, дозы в час на 120-й минуте, DOB-80 и DOB-120. Между группами пациентов с фиброзом печени 1-й стадии (F1) и 4-й стадии (F4) были выявлены достоверные различия во всех показателях 13C-MДT по всем временным интервалам (p <0,01).
Между группами F2 и F3 значимых различий по результатам 13C-MДT установлено не было (p >0,05). У пациентов групп F3 и F4 различия были значимы по следующим параметрам 13C-МДТ: кумулятивная доза (CUM) от 30-й до 120-й минуты теста, доза в час (dose/h) – на 20, 30, 50-й минуте теста, DOB-20.
В таблицах 9–11 отражены результаты попарного сравнения параметров 13C-МДТ между группами по следующим показателям: кумулятивная доза (CUM), доза в час (dose/h), DOB.
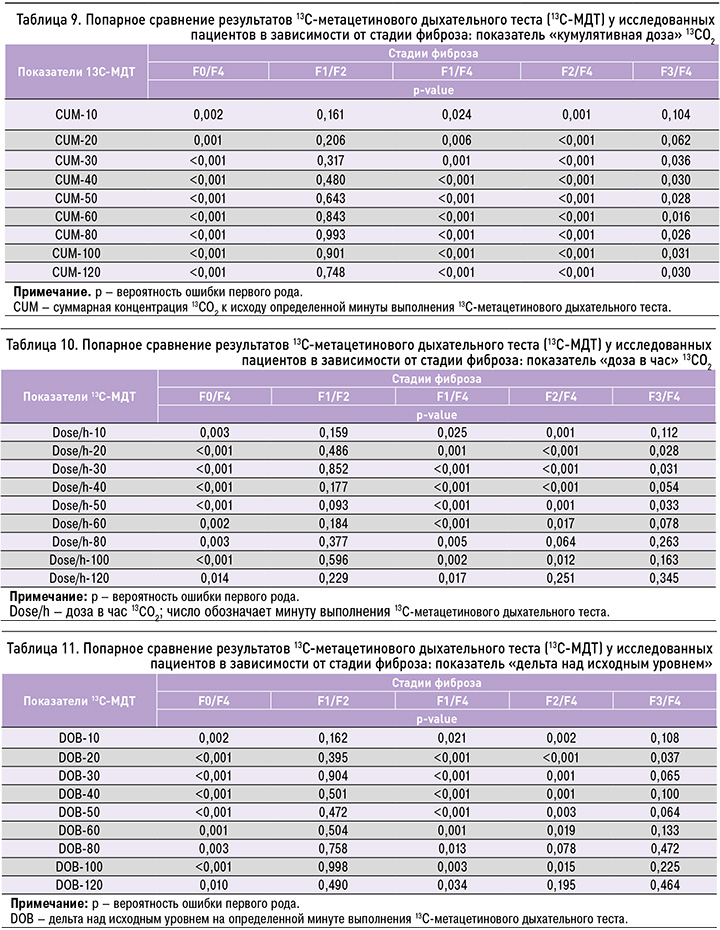
Пороговые значения кумулятивной дозы 13CО2 при проведении 13C-МДТ получены с помощью статистического алгоритма «построение классификационных деревьев» (classification tree analysis statistics) и унивариантного анализа (ANOVA). Пороговые значения кумулятивной дозы в первые 30 мин теста, свидетельствующие о наличии риска фиброза печени, указаны в таблице 12.

ОБСУЖДЕНИЕ
ХЗП представляют серьезную проблему для здравоохранения как в России, так и за рубежом. Это связано с тем, что при всех ХЗП существует риск развития и прогрессирования фиброза печени, что в дальнейшем может приводить к циррозу печени, необходимости трансплантации печени, быть предпосылкой трансформации в гепатоцеллюлярную карциному, причиной развития осложнений и летального исхода. Таким образом, наличие и выраженность фиброза печени может определять продолжительность и прогноз жизни пациентов с ХЗП.
Для подбора адекватной и своевременной ХЗП необходима точная и быстрая оценка тяжести заболевания, а именно стадии фиброза печени. В последнее время ведется поиск «золотого» стандарта диагностики ХЗП с использованием как клинических, лабораторных, так и инструментальных данных. Кроме того, разработаны математические модели определения стадии фиброза.
В ходе нашей работы была выявлена взаимосвязь функционального резерва и дисфункции печени и стадии фиброза. Вопрос соответствия клинической картины, лабораторных, инструментальных данных, полученных при использовании современных методов, и стадии фиброза является до сих пор дискутабельным, однозначного мнения среди российских и зарубежных авторов на этот счет нет. Ни один из современных способов диагностики стадии заболевания печени не способен выявить выраженность нарушения функции печени. Определение функционального состояния представляется важным при ведении пациентов с патологией печени. На основании литературных данных и полученных нами результатов представляется значимым введение 13C-МДТ в клиническую практику. Этот метод не уступает в эффективности выявления и определения выраженности фиброза печени существующим методам диагностики, при этом он лишен присущих им недостатков, так как является неинвазивным, безопасным, репрезентативным и простым в исполнении.
Основным результатом проведенной нами работы можно считать совершенствование метода диагностики фиброза печени, предложение неинвазивного метода определения его стадии, а также способа диагностики цирроза печени; все это позволяет избежать выполнения инвазивных процедур, исключить риск осложнений, присущих пункционной биопсии печени.
Следует отметить, что нежелательных явлений за время проведения исследования, связанных с выполнением 13C-МДТ, нами зарегистрировано не было.
ЗАКЛЮЧЕНИЕ
Различия, выявленные в результатах клиниколабораторных методах исследования между группами, можно использовать как дифференциальнодиагностические критерии выраженного фиброза и цирроза печени. В дальнейшем, при использовании полученных данных планируется выделение лабораторных маркеров, с помощью которых возможна ранняя диагностика выраженной стадии фиброза. Возможно использование лабораторных маркеров фиброза в сочетании с 13C-МДТ для ранней диагностики выраженного фиброза и цирроза печени.



