ВВЕДЕНИЕ
В последнее время интерес исследователей прикован к изучению содержания магния в ротовой жидкости [1–3]. Метод является неинвазивным и весьма информативен при оценке магниевого статуса пациента [3, 4]; его проводят для ранней диагностики дефицита магния (ДМ) в организме [1, 3, 5]. Из литературных источников известно, что ДМ способствует развитию дисплазии соединительной ткани (ДСТ) [3, 6–8] — генетически детерминированного состояния, характеризующегося дефектами волокнистых структур и основного вещества СТ, приводящему к нарушению формообразования органов и систем, имеющему прогредиентное течение, определяющего особенности ассоциированной патологии, а также фармакокинетики и фармакодинамики лекарственных средств [9]. В свою очередь, ДСТ делят на дифференцированные формы, когда известен генетический дефект и его тип наследования, и недифференцированные (НДСТ), возникающие в результате большого числа генных мутаций в различных сочетаниях и воздействия разнообразных факторов внешней среды [9–11]. Морфологической основой НДСТ служит снижение содержания отдельных видов коллагена или нарушение соотношения между ними, что ведет к снижению прочности СТ многих органов и систем [6, 9, 10], отсюда многочисленные внешние и внутренние проявления этого заболевания [6, 8, 10, 11]. В биохимическом аспекте высокая степень организованности и упорядоченности межклеточного матрикса выражается специфическими количественными соотношениями образующих его биополимеров [10, 12, 13]. Таким образом, ДМ сопровождается увеличением общей активности матриксных металлопротеиназ (семейства внеклеточных эндопептидаз, способных разрушать все типы белков внеклеточного матрикса) и ведет к более активному разрушению коллагеновых, эластиновых волокон, усиливает деградацию полисахаридных нитей гиалуронана, что ослабляет механическую прочность СТ. С другой стороны, усиление поперечных сшивок уже «зрелого» коллагена приводит к грануляризации СТ и уменьшению его механической прочности [1, 2, 10, 14].
Клинические проявления ДМ довольно разнообразны. Он наблюдается при артериальной гипертензии, ишемической болезни сердца, сахарном диабете, инсульте, дислипидемии, сердечной недостаточности, при формировании НДСТ, пролапсе митрального клапана [5, 7, 12, 15, 16].
Таким образом, имеющиеся данные позволяют сделать вывод, что ДМ влияет на прочность СТ; вызывает интерес зависимость между количественным ДМ и тяжестью клинических проявлений НДСТ. В данном случае неинвазивный метод исследования магния в ротовой жидкости информативен и позволяет прогнозировать степень повреждения СТ.
Цель исследования – изучить корреляцию между количеством фенов НДСТ и уровнем магния в ротовой жидкости.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 56 женщин, давших информированное согласие, в возрасте от 26 до 51 года, которые были разделены на 3 группы в зависимости от количества внешних и внутренних фенов НДСТ [9–11] с анализом признаков соединительнотканной дисплазии кожи [16, 17]. В группах проводили сбор анамнеза, физикальное обследование и выделение ведущих клинических синдромов, ЭКГ, ЭхоКГ, ультразвуковое исследование органов брюшной полости, фиброгастродуоденоскопию при наличии соответствующих жалоб. В первой группе (n=18) преобладали женщины, у которых при исследовании было <6 фенов НДСТ; эта группа была контрольной, средний возраст группы составил 35,7±1,4 года. Во второй группе женщин (n=22), имеющих от 6 до 10 фенов НДСТ, средний возраст составлял 39,1±3,1 года. В третьей группе (n=16), где средний возраст составлял 38,8±2,9 года, преобладали женщины, имеющие >10 фенов НДСТ.
Критерии включения: женский пол, возраст от 21 до 45 лет, индекс массы тела от 17 до 25 кг/м2. Из исследования исключались беременные, лактирующие, женщины с наступившей менопаузой для исключения влияния гормональных изменений на результаты исследования.
Ротовую жидкость у всех пациенток собирали в количестве 4 мл после прополаскивания рта без использования раздражающих веществ. За 12 ч до сбора ротовой жидкости исключали прием пищи, алкоголя и лекарственных препаратов. Исследование ротовой жидкости проведено на биохимическом фотометрическом анализаторе АБхФк 02 БИАН. Использовался набор для определения магния Magnesium liquicolor HUMAN [4].
Статистическая обработка данных была проведена с помощью пакета программ Statistica 6,0 (Starsoft, версия 6, США) с использованием критерия Шапиро–Уилка. Распределение показателей соответствовало нормальному; эти данные были представлены в виде средних величин и их сравнения с использованием t-критерия Стьюдента. Наличие корреляционной связи между двумя признаками определялось по коэффициенту ранговой корреляции Спирмена. При использовании коэффициента корреляции применялись следующие критерии: |r|<0,20 – очень слабая корреляция; 0,2<|r|<0,5 – слабая корреляция; 0,5<|r|<0,7 – средняя (умеренная) корреляция; 0,7<|r|<0,9 – сильная корреляция; 0,9<|r|<1,0 – очень сильная корреляция. Различия и связи между показателями считались статистически достоверными, если уровень значимости p для соответствующего статистического критерия не превышал 0,05 [18].
 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
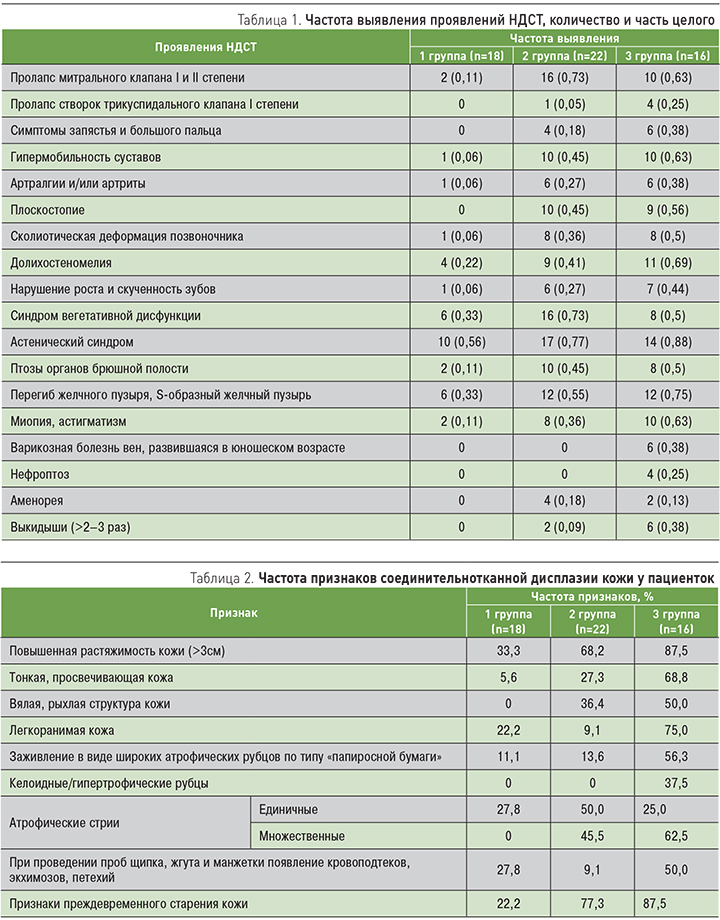
В результате исследования в группах пациенток чаще всего встречались кардиологические, костные и мышечно-суставные фены НДСТ, которые были выявлены практически у всех женщин. Данные представлены в табл. 1.
Из таблицы видно, что во 2-й и 3-й группах пациенток чаще всего встречались кардиологические фены НДСТ, которые проявлялись постоянными кардиалгиями, хроническими гипотензиями, при проведении УЗИ сердца наиболее часто обнаруживались аномально расположенные хорды левого желудочка. На втором месте находились астенический синдром и синдром вегетативной дисфункции, которые были приоритетными у пациенток контрольной группы, и проявлялись во всех группах снижением работоспособности, ухудшением переносимости физических и психоэмоциональных нагрузок, повышенной утомляемостью, вертебробазилярной недостаточностью, вегетососудистой дистонией и паническими атаками. Также часто встречались костно-мышечные, суставные и гастроэнтерологические фены.
Более пристальное внимание было уделено наличию кожных и косметологических фенов. Поскольку кожа содержит множество разнообразных клеток СТ и является самым большим по площади органом человеческого тела, то можно предположить, что первые признаки НДСТ, которые проявляются в основном слабо выраженными гетерогенными симптомами и синдромами, чаще других можно выявить, внимательно исследуя кожные покровы (табл. 2).
Из табл. 2 видно, что доминирующим признаком во всех группах была повышенная растяжимость кожи (>3 см), а во 2-й и 3-й группах с высокой частотой присутствовали также признаки преждевременного старения кожи (углубленные носогубные складки, выраженная носослезная борозда). Практически все кожные и косметические фены (в большем или меньшем проценте случаев) были представлены у пациенток 3-й группы. Во 2-й группе исключение составило наличие келоидных или гипертрофических рубцов.
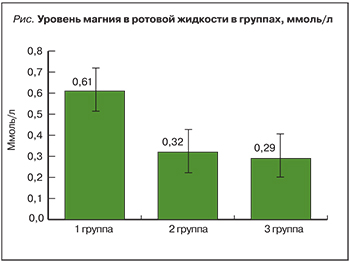
Далее был проанализирован уровень магния в ротовой жидкости у пациенток, данные представлены на рисунке.
По уровню магния в ротовой жидкости пациентки существенно различались: в 1-й группе уровень магния в ротовой жидкости был 0,61±0,09 ммоль/л, во 2-й группе – 0,32±0,01 ммоль/л (р <0,05) по сравнению с 1-й группой, а в 3-й группе – 0,29±0,01 ммоль/л (р <0,05) по сравнению с 1-й группой. В результате исследования выявлена обратная связь между количеством фенов НДСТ и уровнем магния в ротовой жидкости. Она характеризовалась снижением концентрации магния в ротовой жидкости по мере увеличения количества фенов НДСТ. Как представлено на рисунке, самое большое количество фенов НДСТ (≥10) и самый низкий уровень магния в ротовой жидкости (0,29±0,01 ммоль/л) наблюдались у пациенток 3-й группы. Анализ корреляционной зависимости показал, что во 2-й и 3-й группах пациенток выявлена отрицательная корреляционная связь умеренной силы между этими показателями: r=–0,55 (p <0,05) во 2-й группе, r=–0,62 (p <0,01) в 3-й группе. Более того, с увеличением количества фенов НДСТ возрастала и степень отрицательной корреляции.
ЗАКЛЮЧЕНИЕ
Подводя итоги проведенного исследования можно отметить, что пациентки из 2-й и 3-й групп чаще всего имели кардиологические фены, астению и мышечно-суставные деформации, различные кожные проявления НДСТ. Известно, что НДСТ – распространенное состояние, имеющее различные фенотипические и висцеральные проявления, также это системная патология с прогрессивным течением, основную роль в которой играет генетический дефект синтеза или катаболизма элементов внеклеточного матрикса [9–11, 17]. Изучая биохимию матрикса, можно с уверенностью сказать, что высокая степень его организованности и упорядоченности определяется специфическими количественными соотношениями образующих матрикс биополимеров [10, 12, 13]. Известно, что ДМ приводит к замедлению синтеза всех структурных молекул СТ (включая протеогликаны, глюкозаминогликаны, коллагены и эластин). Поскольку синтез структурных молекул, столь необходимых для восстановления СТ, замедляется, то процессы восстановления также тормозятся, и это приводит к ухудшению механических характеристик ткани [1, 2, 6–8]. С другой стороны, можно предположить, что низкая концентрация магния в ротовой жидкости является фактором риска дефицита других макро- и микроэлементов, таких как цинк, медь, калий, кремний и другое, что еще больше усугубляет ситуацию. Известно также, что магний уравновешивает поступление кальция и препятствует его выведению [7, 12, 19, 20]. Участие магния в синтезе и катаболизме СТ приводит в случае ДМ к продукции неполноценного коллагена, утрачивающего свойства нормальных волокон [2, 6–9, 13].
Таким образом, в результате исследования выявлена взаимосвязь между нарастанием количества внутренних и внешних фенов НДСТ у пациенток и снижением концентрации магния в ротовой жидкости. Полученные нами данные позволяют предположить, что большее количество выявляемых фенов НДСТ и выявление «раннего» ДМ важно для прогнозирования дальнейшего усугубления созревания неполноценного коллагена, утрачивающего свойства нормальных волокон.



