ВВЕДЕНИЕ
Легочная артериальная гипертензия – клиническая группа редких заболеваний, характеризующихся наличием прекапиллярной легочной гипертензии, при условии отсутствия других причин для ее развития [1]. Легочная гипертензия (ЛГ) определяется при среднем давлении в легочной артерии (ДЛАср) более 25 мм рт.ст. в покое [2, 3].
В клинической классификации ЛГ (Ницца, 2018) [2] выделено 5 групп заболевания, и идиопатическая легочная артериальная гипертензия (ИЛАГ) относится к первой группе. По функциональной классификации ЛГ (классификация ВОЗ) выделяют 4 функциональных класса болезни, что соответствует классификации сердечной недостаточности Нью-Йоркской ассоциации кардиологов (NYHA 1998). При морфологической оценке легочной артериальной гипертензии описаны 6 классов (степеней) выраженности изменений в стенках ветвей легочной артерии: 1-й класс – гипертрофия мышечной оболочки ветвей легочной артерии и мускуляризация стенок артериол; 2-й класс – пролиферация интимы ветвей легочной артерии; 3-й класс – фиброэластоз интимы в артериях мышечного типа; 4-й класс – расширение мелких артерий и развитие плексусов; 5-й класс – наличие плексусов и перифокальный ангиоматоз, появление сидерофагов в просветах альвеол; 6-й класс – некротический артериит (Heath, Edwards 1958) [4]. При ИЛАГ морфологически выделяют плексогенную легочную артериопатию, тромботическую легочную артериопатию, легочную веноокклюзивную болезнь, капиллярный гемангиоматоз [5].
Распространенность ИЛАГ варьируется от 1 до 5,9 на 1 млн взрослых [6]. В Регистре легочной артериальной гипертензии во Франции на долю ИЛАГ приходится 39,2%, при этом семейная форма зарегистрирована у 3,9% пациентов [7]. По данным Jang S.Y. et al. (2022), средний возраст пациентов с ИЛАГ, проанализированных в Южной Корее за период с 2006 по 2017 г., составляет 62,3 года, а 10-летняя выживаемость – 57% [8]. По данным Hoeper V.V. et al (2018), средний возраст больных с ИЛАГ в регистре Германии 2014 г. равнялся 65, в Швеции – 69 годам, при этом риск смерти на фоне этого заболевания выше в группе пациентов старше 65 лет [9]. При анализе 150 пациентов с ИЛАГ в Китае за период с 2007 по 2010 г. средний возраст пациентов составил 36 лет, а СДЛА – 61 мм рт.ст., а гипертрофия правого желудочка при эхокардиографии (ЭхоКГ) была обнаружена у 93,1% пациентов [10]. В то же время сравнительные данные эпидемиологических исследований о распространенности различных типов легочной артериальной гипертензии в настоящее время отсутствуют [1].
Плексиформная легочная артериопатия встречается в 28–71% наблюдений при ИЛАГ; чаще она диагностируется у женщин и преобладает в молодом возрасте [11, 12]. В начальные периоды болезни возникает гипертрофия мышечной оболочки ветвей легочной артерии без сужения просветов, в дальнейшем при прогрессировании болезни фиброэластоз интимы приводит к сужению просветов артерий. Иногда концентрический фиброз средней оболочки вызывает разволокнение эластических волокон стенки, напоминая разрезанную луковицу. Такие изменения в конечном итоге вызывают облитерацию просветов сосудов [13].
Плексиформные структуры формируются проксимальнее участков облитерации или тромбоза. Плексусы ветвей бронхиальных артерий описывают в стенках хрящевых бронхов и терминальных бронхиол; считается, что это отражение изменений в артериовенозных анастомозах [14]. Сама структура плексуса представляет собой ветвящиеся сосуды с одиночной эластической мембраной и пролиферирующими эндотелиальными клетками. Предполагают, что плексусы возникают на стадии пролиферативной регенерации после фибриноидного некроза и, возможно, являются анастомозами между артерией и веной либо аневризмой ветви легочной артерии [1]. Считается, что выраженность изменений стенок ветвей легочной артерии при плексиформной артериопатии не зависит от длительности заболевания и нарастает при увеличении систолического давления в легочной артерии более 60 мм рт.ст. [15].
ОПИСАНИЕ СОБСТВЕННОГО КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ
Пациент М., 55 лет, наблюдался в городской поликлинике. В июле 2018 г. в Национальном медицинском исследовательском центре сердечно-сосудистой хирургии (НМИЦ ССХ) им. А.Н. Бакулева пациенту впервые была диагностирована ИЛАГ. При этом были исключены другие причины ЛГ, такие как ЛГ на фоне приема лекарств и токсинов, наследственная легочная артериальная гипертензия, ЛГ на фоне заболеваний соединительной ткани, портолегочная гипертензия, ЛГ на фоне врожденных пороков сердца и шистозомоза, ЛГ, развивающаяся на фоне заболеваний левого желудочка и легких, хроническая тромбоэмболическая ЛГ и другие редко встречающиеся формы заболевания.
По данным катетеризации правых отделов сердца (КПОС), ДЛАср составило 61 мм рт.ст., легочное сосудистое сопротивление (ЛСС) – 6 ед. Вуда, сердечный выброс (СВ) – 4,2 л/мин, давление в правом предсердии (ДПП) – 12 мм рт.ст., а давление заклинивания легочных капилляров – 7 мм рт. ст. Во время проведения КПОС была получена положительная фармакологическая проба на вазореактивность (с ингаляционным оксидом азота в дозе 20 ppm).
В течение месяца после госпитализации пациент принимал антагонисты кальция (дилтиазем 80 мг 2 раза/сут), однако у него отмечалась стойкая гипотензия, вследствие чего препарат был отменен. В ходе обследования в начале 2019 г. в поликлинике по месту жительства по поводу одышки на фоне физических нагрузок при ЭхоКГ ДЛАср составило 105 мм рт.ст., отмечалась дилатация правого предсердия и правого желудочка. Больному было рекомендовано обратиться в экспертный центр ЛГ для подбора специфической терапии. Однако повторная госпитализация в НМИЦ ССХ им. А.Н. Бакулева состоялась только в мае 2019 г.
При повторной КПОС ДЛАср равнялось 84 мм рт.ст. Больному была инициирована ЛАГ-специфическая терапия антагонистом эндотелиновых рецепторов мацитентаном в дозе 10 мг/сут, позже к лечению добавлен спиронолактон в дозе 25 мг/сут.
При контрольном ЭхоКГ в поликлинике в августе 2019 г. ДЛАср составило 76 мм рт.ст., в сентябре – 66 мм рт.ст., при этом наблюдалось уменьшение объема правого желудочка. Пациент отмечал уменьшение одышки, увеличение переносимости физических нагрузок. Весной 2022 г. он в легкой форме перенес новую коронавирусную инфекцию (СOVID-19), в июне того же года стал вновь отмечать нарастание одышки, появление отеков нижних конечностей.
При проведении ЭхоКГ в июне 2022 г. были выявлены дилатация правых отделов сердца, признаки гипертрофии правого желудочка, регургитация на легочном и трикуспидальном клапанах III степени, снижение тотальной сократительной функции миокарда. Значение ДЛАср достигло 110 мм рт. ст.
Пациенту была предложена экстренная госпитализация, от которой он категорически отказался. Больной умер дома в августе 2022 г.
Заключительный клинический диагноз:
- основное заболевание. ИЛАГ: ДЛАср от 61 до 84 мм рт.ст., адаптивное ремоделирование и гипертрофия миокарда правого желудочка со снижением тотальной сократительной функции миокарда;
- осложнения. Дилатация правых камер сердца. Хроническая сердечная недостаточность 2Б, функциональный класс 3 по ВОЗ. Трикуспидальная недостаточность 2–3 ст.
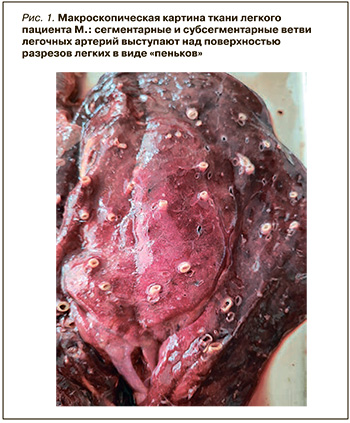
Данные аутопсии: труп мужчины правильного телосложения, удовлетворительного питания, с умеренным отеком голеней и стоп. Наблюдались признаки отека и набухания головного мозга с вклинением в большое затылочное отверстие. Сердце массой 520 г, размерами 14×15×7,5 см, под эпикардом правого желудочка определяется большое количество жировой ткани. Периметр трехстворчатого клапана – 15 см. Миокард плотный, на разрезе красно-коричневый, однородный. Правое предсердие и желудочек расширены, гипертрофия сосочковых и трабекулярных мышц правого желудочка, толщина миокарда правого желудочка – 1 см. Масса миокарда правого желудочка с соответствующей частью межжелудочковой перегородки составила 153 г, левого – 127 г, желудочковый индекс – 1,2. В интиме венечных артерий – циркулярные атеросклеротические бляшки, занимающие 25% площади артерий без стеноза просветов. В интиме правой и левой легочных артерий и их сегментарных ветвях – умеренное число фиброзных бляшек, занимающих 50% площади артерий со стенозом просветов последних на 25%. Сегментарные ветви легочных артерий выступают над поверхностью разрезов легких (рис. 1). Масса легких составила 1130 г. Выявлен умеренно выраженный отек легких. Печень массой 1100 г, плотная, с гладкой поверхностью, на разрезе – с выраженным мускатным рисунком строения. Почки массой 340 г, с гладкой темно-вишневой поверхностью. Цианотическая индурация селезенки.
При гистологическом исследовании выявлена выраженная гипертрофия кардиомиоцитов правого желудочка с перинуклеарным отложением липофусцина, жировая инфильтрация миокарда. В печени – расширение и полнокровие центральных вен, расширение и полнокровие синусоидов вокруг центральных вен с некрозом части гепатоцитов, зернистая дистрофия части гепатоцитов.
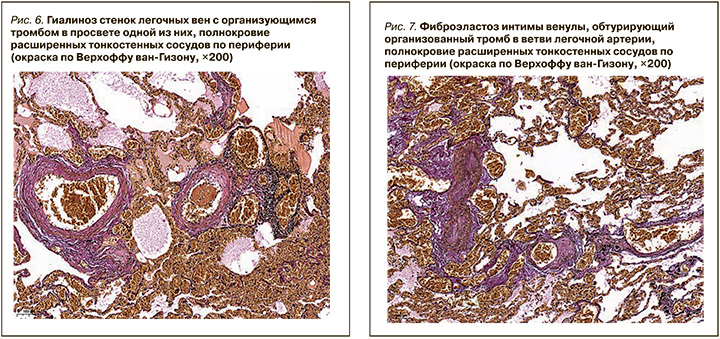
В интиме долевой и сегментарных ветвях легочных артерий наблюдались фиброзные бляшки, местами суживающие просветы сегментарных ветвей на 25%, гипертрофия и фиброэластоз интимы ветвей легочных артерий. В ткани легких встречались плексусы с выраженным расширением и полнокровием тонкостенных сосудов вокруг (рис. 2–4), гипертрофия мышечной оболочки ветвей легочной артерии, мускуляризация стенок артериол с сужением части просветов, гиалиноз части стенок артериол (рис. 5). В части просветов ветвей легочной артерии и в ветвях легочных вен были обнаружены обтурирующие организующиеся и организованные тромбы (рис. 6). Также были выявлены фиброэластоз интимы ветвей легочных вен с сужением или полным закрытием просветов (рис. 7), полнокровие расширенных капилляров межальвеолярных перегородок, очаговый внутриальвеолярный отек. По классификации Хета–Эдвардса обнаруженные изменения соответствуют 4–5-й стадии легочной артериальной гипертензии.

Патологоанатомический диагноз:
- основное заболевание. ИЛАГ в виде плексиформной артериопатии в сочетании с тромботической артериопатией (4–5-й класс по Хету–Эдвардсу) с легочным сердцем: ДЛАср при катетеризации правых отделов сердца 81 мм рт.ст., при ЭхоКГ от 66 до 107 мм рт.ст., атеросклероз легочных артерий (2-я стадия, 1-я степень, стеноз просветов сегментарных ветвей на 25%), гипертрофия сосочковых, трабекулярных мышц и стенки правого желудочка, толщина миокарда правого желудочка 1 см, масса миокарда правого желудочка с соответствующей частью межжелудочковой перегородки 153 г, желудочковый индекс (ЖИ) = 1,2;
- осложнения. Венозное полнокровие и дистрофия внутренних органов: отеки голеней и стоп, цианотическая индурация почек и селезенки, мускатная печень. Недостаточность трехстворчатого клапана (периметр 15 см). Слабо выраженный отек легких. Отек и набухание головного мозга с вклинением в большое затылочное отверстие.
Непосредственная причина смерти – хроническая легочно-сердечная недостаточность.
ОБСУЖДЕНИЕ
Тромботическая артериопатия (ТА) клинически, рентгенологически, при катетеризации правых отделов сердца и при ЭхоКГ практически неотличима от плексиформной артериопатии [1]. ТА встречается у мужчин и женщин старшего возраста, страдающих ИЛАГ, в 20–51% наблюдений [16]. В случае ТА в просветах артериол, ветвях легочной артерии и венулах встречаются обтурирующие тромбы на разных стадиях организации, часть из которых реканализована. В ряде наблюдений реканализованные тромбы довольно трудно отличить от плексусов. Гипертрофия мышечной оболочки ветвей легочной артерии при ТА возникает вторично и менее выражена, чем при плексиформной артериопатии. По мнению Pietra G. et al. (1989), ТА и плексиформная артериопатия являются составляющими одного типа ИЛАГ, которую авторы называют «идиопатическая легочная артериопатия» [17]. Исходя из описания изменений в ветвях легочных артерий и вен, можно предположить, что разделение на плексогенную и ТА формы ИЛАГ во многом искусственно, поскольку зачатую они выступают стадиями единого процесса.
Известно, что пусковым механизмом легочной артериальной гипертензии служит повреждение эндотелия. По данным Wagenvoort C., Mulder P. [18], частота тромбозов достаточно высока при плексиформной артериопатии, следовательно, развитие тромбоза при этом типе ИЛАГ, вероятнее всего, является вторичным. Двукратное утолщение интимы легочных вен при морфометрическом исследовании плексиформной артериопатии аналогично утолщению при вторичной артериальной легочной гипертензии [19].
ЗАКЛЮЧЕНИЕ
Особенность представленного наблюдения заключается в том, что ИЛАГ была впервые выявлена у мужчины в возрасте 50 лет. По всей видимости, использованное лечение позволило продлить его жизнь на 4 года. Кроме того, течение ИАЛГ носило до момента диагностики благоприятное течение с медленным развитием ремоделирования правого желудочка.



