АНЦА-ассоциированные васкулиты (ААВ) – гетерогенная группа системных заболеваний, характеризующихся воспалением и некрозом сосудов преимущественно мелкого и реже среднего калибра и циркуляцией в кровотоке антител к цитоплазме нейтрофилов (АНЦА) [1]. Различают три основные клинико-морфологические формы ААВ: гранулематоз с полиангиитом, эозинофильный гранулематоз с полиангиитом и микроскопический полиангиит, которые характеризуются широким спектром разнообразных клинических проявлений. Нередко в патологический процесс вовлекается кожа и слизистые оболочки полости рта. При этом наиболее частыми вариантами вовлечения кожи и слизистых являются пальпируемая пурпура, язвенное поражение, сетчатое ливедо. Ниже представлено клиническое наблюдение течения АНЦА-ассоциированного васкулита, осложнившегося развитием гангрены языка и пальцев.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
В конце января 2019 г. пациентка 69 лет проходила стационарное лечение по поводу хронической венозной недостаточности, инфицированной трофической язвы левой голени. При обследовании у нее были выявлены лейкоцитоз до 11,5×109/л, повышение скорости оседания эритроцитов (СОЭ) до 40 мм/ч; изменений в анализах мочи и снижения функции почек выявлено не было. После проведенного курса терапии цефтриаксоном и местного лечения антисептиками был получен эффект в виде купирования признаков острого воспаления, очищения и эпителизации язвенного дефекта. Однако 02.02.2019 пациентка впервые отметила слабость и онемение в левой кисти, к которым через два дня присоединились аналогичные ощущения в правой кисти и нижних конечностях. Еще через два дня наступило онемение кончика языка. После выписки из хирургического стационара неврологическая симптоматика нарастала, больная начала испытывать трудности в самообслуживании, перестала самостоятельно передвигаться, вынужденно стала пользоваться креслом-коляской. Для обследования и лечения 27.02.2019 пациентка была госпитализирована в неврологическое отделение.
На момент поступления состояние соответствовало средней степени тяжести. Пациентка имела гиперстеническое телосложение, индекс массы тела (ИМТ) 41 кг/м2. При осмотре обращали на себя внимание петехиально-геморрагические высыпания диаметром до 1,5 см на левом предплечье, зарубцевавшаяся язва на левой голени, язва в стадии эпителиальной трансформации на правой голени. На момент госпитализации язык влажный, розовый, не обложен, без язвенных дефектов. Впервые было зафиксировано повышение температуры тела до 38 °С.
При оценке неврологического статуса на момент поступления в стационар у пациентки были выявлены рефлексы орального автоматизма (хоботковый, Маринеску–Радовичи справа положительные), в остальном краниальная иннервация интактна. Отмечен периферический тетрапарез: в проксимальных отделах рук мышечная сила до 4–5 баллов, в предплечьях – до 3–5 баллов, в левой кисти – 1 балл, в правой – 2 балла, в ногах – 2 балла в проксимальных отделах, в левой стопе – до 0 баллов, в правой – 1 балл. Сухожильные рефлексы ослаблены. Патологических стопных знаков нет. Ходьба невозможна. Обнаружено нарушение поверхностной чувствительности в ногах по полиневропатическому типу в виде «носка» слева и «гольфа» справа с явлением гиперестезии с элементами аллодинии, в руках – по типу «перчаток» в виде незначительной гипестезии. Мышечно-суставное чувство нарушено в руках и ногах, вибрационная чувствительность снижена. Тазовые функции контролирует. По данным электронейромиографии определялись множественные мононевриты (смешанный аксонально-демиелинизирующий тип поражения). Выполнена люмбальная пункция, ликвор без изменений.
При лабораторном обследовании впервые выявлено выраженное повышение острофазовых показателей (СОЭ – до 79 мм/ч, С-реактивного белка – до 308 мг/л, фибриногена – до 11,1 г/л), нейтрофильный лейкоцитоз до 25,5×109 /л с нейтрофильным сдвигом (90%), тромбоцитоз до 790×109 /л, нормохромная анемия (гемоглобин 91 г/л). Уровень D-димера составил 5,77 мкг/мл. Уровни антинуклеарных антител, С3 и С4 компонентов комплемента были в пределах референсных значений. Впервые отмечены признаки поражения почек (мочевой синдром, представленный эритроцитурией до 30–40 в п/зр, следовой протеинурией до 0,24 г/л), нарастание азотемии (креатинин 238 мкмоль/л, азот мочевины 50 ммоль/л без снижения диуреза).
При компьютерной томографии (КТ) органов грудной клетки 01.03.2019 свежих очаговых и инфильтративных изменений не отмечено, наблюдались участки фиброза в базальных отделах. Инициированы лечение цефтриаксоном (2 г/ сут), карбамазепином, антигипертензивными препаратами, инфузионная терапия, которые не дали существенного эффекта.
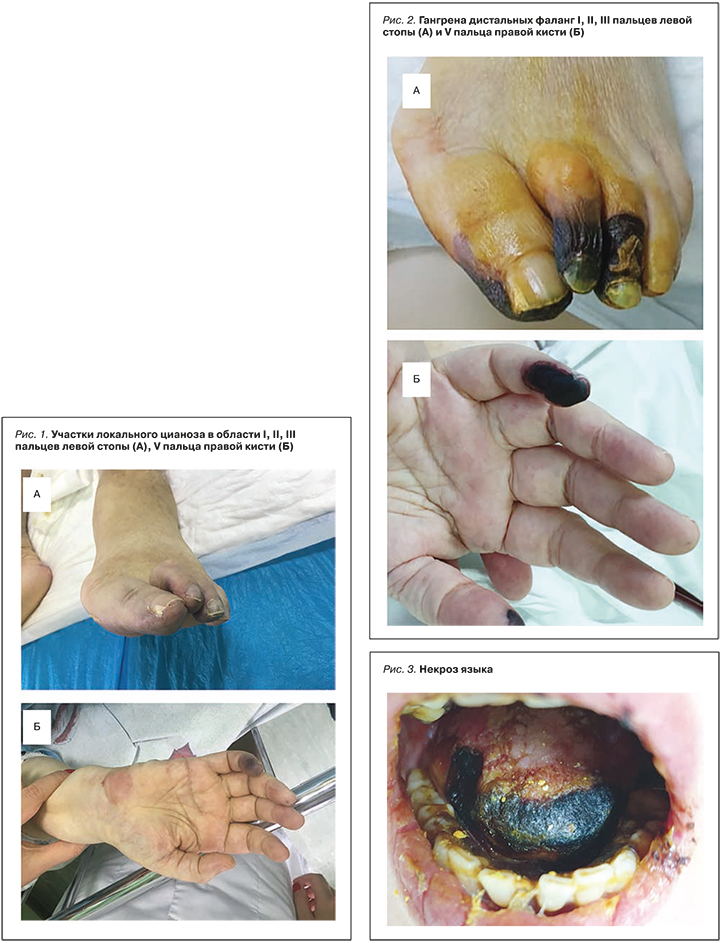
В связи с нарастающей одышкой и десатурацией (SpO2 85–88%) 01.03.2019 начата кислородотерапия, 05.03.2019 больная переведена в отделение реанимации и интенсивной терапии № 1 клиники ревматологии, нефрологии и профпатологии им. Е.М. Тареева. При осмотре в отделении впервые отмечены участки локального цианоза в области I, II, III пальцев левой стопы, V пальца правой кисти, ладонной поверхности левой кисти (рис. 1). При этом трофические язвы на коже голеней без гнойного отделяемого, в стадии эпителизации, с грануляциями. При аускультации дыхание в нижние и средние отделы правого легкого не проводилось. К лечению были добавлены ванкомицин и эноксапарин.
Несмотря на проводимую терапию, состояние пациентки продолжало ухудшаться. Через двое суток сформировался сухой некроз дистальных фаланг I, II, III пальцев левой стопы и V пальца правой кисти (рис. 2), передней трети языка (рис. 3). Появились зрительные галлюцинации. Сохранялись признаки выраженного системного воспалительного ответа: лейкоцитоз на уровне 23×109 с нейтрофильным сдвигом до 93%, повышение СОЭ до 75 мм/ч, С-реактивного белка – до 358 мг/ дл. Прогрессировала почечная недостаточность: 06.03.2019 креатинин сыворотки крови составил 423 мкмоль/л, мочевина 57,7 ммоль/л. При этом электролитных нарушений не отмечалось, диурез сохранен, моча по катетеру светло-желтая. При повторной КТ органов грудной клетки выявлен правосторонний гидроторакс и ателектаз. Было инициировано лечение гемодиализом.
Фульминантное развитие сенсомоторной нейропатии, острого почечного повреждения (ОПП), а также некротических поражений кожи и языка требовало включения в спектр дифференциально-диагностического поиска системных заболеваний, в первую очередь системных васкулитов с поражением мелких и средних сосудов (АНЦА-ассоциированные васкулиты, криоглобулинемический васкулит, узелковый полиартериит). В связи с этим в план обследования было включено определение АНЦА к протеиназе-3 и миелопероксидазе, криоглобулинов, криофибриногена. Учитывая гематологические нарушения, повышение СОЭ, изменения при электрофорезе, развитие ОПП без выраженного мочевого синдрома, также проводился дифференциальный диагноз с лимфо- и миелопролиферативными заболеваниями, антифосфолипидным синдромом, генерализованными инфекциями.
Было выполнено иммунохимическое исследование сыворотки крови и мочи с определением свободных легких цепей методом Freelite: на фоне воспалительной диспротеинемии выявлен следовой клон Gκ, белок Бенс–Джонса не обнаружен. Проведена стернальная пункция: в препарате пунктата наблюдались признаки реактивных изменений костного мозга. По результатам иммунологического обследования обнаружены антитела к протеиназе-3 в высоком титре (75 МЕ/мл, норма 0–5 МЕ/мл). Маркеры других аутоиммунных заболеваний, включая антифосфолипидный синдром (волчаночный антикоагулянт, антитела к кардиолипинам и бета-2-гликопротеину-1), выявлены не были. В анамнезе не было указаний на прием сосудосуживающих препаратов или тяжелый атеросклероз периферических артерий, которые могли объяснить формирование некротических изменений.
Таким образом, принимая во внимание анамнестические и клинические данные (острый дебют заболевания с быстрым развитием сенсомоторной полинейропатии, тяжелое поражение почек с развитием ОПП, потребовавшего лечения гемодиализом, поражение легких с формированием дыхательной недостаточности, некротические изменения кожных покровов и языка), наиболее вероятным диагнозом являлась генерализованная форма АНЦА-ассоциированного васкулита фульминантного течения. Учитывая отсутствие эозинофилии, бронхиальной астмы, а также суррогатных критериев гранулематозного воспаления, более вероятным представлялось развитие у пациентки микроскопического полиангиита.
Была инициирована иммуносупрессивная терапия метилпреднизолоном в дозе 1000 мг/сут внутривенно капельно в течение 5 дней с последующим снижением дозы до 500–250–120 мг/сут. 12.03.2019 сделано первое введение циклофосфамида в дозе 400 мг внутривенно. Течение болезни осложнилось рецидивирующим геморроидальным кровотечением 08.03, 10.03, 20.03.
Проводилась гемостатическая и антибактериальная терапия: с 05.03.2019 применялись цефепим 1 г/сут с последующей заменой на меропенем 1 г/сут в комбинации с ванкомицином в дозе, скорректированной по функции почек (1 г один раз в 3 дня), омепразол внутривенно, оксигенотерапия. Продолжена неинвазивная вентиляция легких через лицевую маску в режиме Constant Positive Airway Pressure (СРАР), лечение гемодиализом, неоднократно проводились трансфузии свежезамороженной плазмы и эритроцитной массы. В результате лечения температура нормализовалась, лейкоцитоз снизился до 11×109/л, уровень С-реактивного белка – до 12 мг/л.
Несмотря на проводимое лечение, отмечено развитие синдрома диссеминированного внутрисосудистого свертывания (стойкая тромбоцитопения, повышенный уровень D-димера, кожный геморрагический синдром). После очередного сеанса гемодиализа 25.03.2019 развилась острая сердечно-сосудистая недостаточность со стойкой артериальной гипотензией, резистентной к терапии. Реанимационные мероприятия, выполняемые в полном объеме, не имели эффекта. 25.03.2019 констатирована биологическая смерть пациентки.
Клинический диагноз основного заболевания был сформулирован следующим образом: АНЦА-ассоциированный васкулит, АНЦА позитивный (антитела к протеиназе-3), генерализованная форма, с поражением почек (быстро прогрессирующий гломерулонефрит), легких (очаговые изменения, ателектаз правого легкого), периферической нервной системы (сенсомоторная полинейропатия), кожи (некротические изменения I, II, III пальцев левой стопы и V пальца правой кисти), языка, суставов (артралгии), высокой активности, лечение сверхвысокими дозами глюкокортикостероидов и циклофосфамида.
При аутопсии выявлена картина некротизирующего васкулита сосудов легких (геморрагический альвеолит) и почек (экстракапиллярный гломерулонефрит с клеточными и фиброзными полулуниями). При этом не обнаружено гранулем и эозинофильной инфильтрации в пораженных тканях, что с учетом клинических данных позволило верифицировать микроскопический полиангиит. При морфологическом исследовании отмечен некротизирующий васкулит артериол языка, подтвердивший патогенетическую связь некротических изменений с основным заболеванием.
ОБСУЖДЕНИЕ
В представленном клиническом наблюдении классическое фульминантное течение АНЦА-ассоциированного васкулита осложнилось развитием необычного клинического проявления – гангрены пальцев и языка, что усложнило процесс дифференциально-диагностического поиска. Хотя некротические изменения мягких тканей описаны при системных васкулитах, наиболее часто их наблюдают при васкулитах с поражением средних и крупных сосудов: гангрену пальцев – при узелковом полиартериите, некроз языка – при гигантоклеточном артериите [2–4].
Некроз языка – крайне редкое проявление АНЦА-ассоциированного васкулита. Ранее в литературе было описано три подобных наблюдения [5–7]. Во всех трех случаях был диагностирован гранулематоз Вегенера (по современной классификации, гранулематоз с полиангиитом). В двух из них определялись антитела к протеиназе-3, как и в описанном выше наблюдении. Также два случая окончились летальным исходом. Принципиальная возможность развития этого проявления заболевания следует из того, что и гранулематоз с полиангиитом, и микроскопический полиангиит, помимо мелких сосудов, способны поражать сосуды среднего калибра, к которым можно отнести сосуды языка [1]. Редкость подобного проявления обусловлена в первую очередь богатым кровоснабжением языка. Симметричное расположение сосудов и наличие анастомозов объясняет особенную редкость билатерального и апикального расположения очагов некроза [8].
ЗАКЛЮЧЕНИЕ
АНЦА-ассоциированные васкулиты – системные заболевания с полиморфными клиническими проявлениями, с которым могут столкнуться в своей практике врачи различных специальностей. ААВ следует включить в спектр дифференциального диагноза у всех пациентов с сочетанным воспалительным поражением нескольких органов и систем. Гангрена выступает редким, но возможным проявлением тяжелых форм заболевания, свидетельствующим о неблагоприятном прогнозе.



