Диагностика

1.
• Ведущим клиническим симптомом деформирующего артроза коленного сустава является боль, усиливающаяся при движениях или нагрузке на сустав, к концу дня, при охлаждении и в сырую погоду. На ранней стадии ОА болевой синдром носит непостоянный характер и может самопроизвольно купироваться (в том числе после периода покоя или циклических низкоинтенсивных нагрузок, таких как велотренажер без сопротивления), с развитием заболевания он приобретает постоянный характер. Кроме того, на выраженных стадиях ОА пациента может беспокоить ночная боль. Боль при гонартрозе может быть как диффузной, так и локальной, с умеренным отеком и легкой крепитацией. Отдельно следует подчеркнуть, что интенсивность болевого синдрома при ОА прямо не коррелирует со стадией заболевания и степенью морфологических изменений в суставе.
2.
• При обследовании взрослого пациента с подозрением на гонартроз для постановки диагноза рекомендован тщательный сбор анамнеза и проведение полноценного клинического осмотра. Рекомендовано учитывать следующие особенности суставного синдрома при ОА (уровень убедительности рекомендаций (УУР) – В, уровень достоверности доказательств (УДД) – 3):
– постепенное начало боли;
– боль в течение большинства дней предыдущего месяца;
– усиление боли при ходьбе;
– «стартовые» боли, которые возникают после периодов покоя и проходят на фоне двигательной активности;
– ночную боль (чаще развивается при более выраженных стадиях ОА и свидетельствует о присоединении воспалительного компонента);
– припухлость сустава (за счет небольшого выпота или утолщения синовиальной оболочки);
– утреннюю скованность длительностью менее 30 мин.;
– крепитацию в суставе;
– ограничение движений в суставе;
– изменение походки.
• На фоне прогрессирования гонартроза ограничение амплитуды движений (контрактура) в начале сгибания, а затем и разгибания, крепитация, деформация сустава (варусная или вальгусная) и увеличение его в размерах, периодические синовиты.
• Хроническая боль приводит к миостатическому дисбалансу и нарушению сенсомоторной функции, в результате чего развивается атрофия мышц, вызывающая вторичные функциональные нарушения. Ухудшение проприоцепции влечет мышечную слабость в сочетании с повышением чувства «разболтанности» сустава. В результате этого пациенты испытывают затруднения при приседании или опоре на колено, при подъеме или спуске по лестнице, а также при подъеме со стула или кресла. Постепенно появляются хромота и необходимость в дополнительной опоре при ходьбе.
3.
Рекомендовано выполнить для постановки диагноза ОА коленных суставов ортопедический осмотр и оценку функции сустава: оценку общего состояния пациента, функции пораженных суставов, а также измерение его роста и массы тела: УУР – С, УДД – 5. Объективное обследование выявляет пальпаторную болезненность в проекции суставной щели, максимально выраженную в области пораженного отдела коленного сустава. При преимущественной локализации процесса в бедренно-надколенниковом сочленении болезненность может превалировать при пальпации и смещении надколенника. Постоянная ирритация периферической и центральной нервной системы становится причиной формирования хронического болевого синдрома, характеризующегося механической аллодинией и гипералгезией. Далее по мере прогрессирования заболевания появляются фронтальная деформация конечности (варусная или вальгусная) и ограничение движений (в начале сгибания, а затем и разгибания коленного сустава), выраженность которых уточняется во время осмотра. В дальнейшем деформация и контрактура принимают фиксированный характер. При синовите коленного сустава положительным становится симптом баллотирования надколенника.
• Лабораторные исследования крови или синовиальной жидкости непосредственно для верификации ОА коленных суставов не требуются. Вместе с тем они рекомендованы в следующих клинических ситуациях:
– при наличии у пациента клинически значимой сопутствующей патологии (сердечно-сосудистой, эндокринной) для выявления возможных противопоказаний для назначения лекарственных средств (УУР – С, УДД – 4). С этой целью проводятся общий (клинический) анализ крови, анализ крови биохимический общетерапевтический, исследование уровня холестерина липопротеидов высокой и низкой плотности в крови;
– при сопутствующем поражении мелких суставов кисти (дифференциальная диагностика) – определение содержания ревматоидного фактора (РФ), антител к циклическому цитрулиновому пептиду (АЦЦП) в крови (УУР – С, УДД – 5). При ОА, в отличие от ревматоидного артрита, РФ преимущественно не обнаруживают, антитела к АЦЦП чаще соответствуют норме или лишь немного повышены;
– при сопутствующем поражении стопы (дифференциальная диагностика) – исследование уровня мочевой кислоты в крови (УУР – С, УДД – 5). В случае ОА, в отличие от большинства случаев подагры, уровни этого маркера чаще соответствуют норме или лишь немного повышены;
– при выраженном синовите коленного сустава (дифференциальная диагностика) – исследование скорости оседания эритроцитов, уровня C-реактивного белка в сыворотке крови (УУР – С, УДД – 4). Умеренное
повышение этих показателей может наблюдаться при синовите, тогда как выраженное повышение свидетельствует о другом заболевании;
– только при наличии синовита (дифференциальная диагностика) – исследование химических свойств синовиальной жидкости, уровня белка в синовиальной жидкости, физических свойств синовиальной жидкости (УУР – С, УДД – 4).
Для ОА характерен не воспалительный характер синовиальной жидкости: она стерильная, прозрачная или слегка мутная, вязкая, с концентрацией лейкоцитов менее 2000/мм3. Более высокие показатели типичны для других воспалительных заболеваний суставов. Обнаружение кристаллов в синовиальной жидкости для ОА не характерно.
4.
• Рекомендовано всем пациентам с подозрением на ОА выполнить рентгенографию коленного сустава в двух проекциях как наиболее простой скрининговый метод обследования для оценки стадии развития заболевания и определения его этиологического типа: УУР – А, УДД – 1. Рентгенография коленного сустава проводится в прямой (переднезадней) и боковой проекциях. Для дополнительной оценки бедренно-надколенникового сочленения используется аксиальная проекция надколенника в положении лежа на спине или функциональная рентгенография – аксиальная проекция стоя. При наличии явных рентгенологических признаков гонартроза дальнейшего инструментального обследования для его диагностики не требуется. Широко используемая рентгенологическая классификация стадий ОА по Kellgren – Lawrence приведена в таблице 1. На I–II стадиях пациентам рекомендована консервативная терапия или, в случае ее неэффективности (невозможности купирования болевого синдрома), оперативное лечение (УУР – С, УДД – 5), на III–IV стадиях – хирургическое вмешательство (УУР – С, УДД – 5).
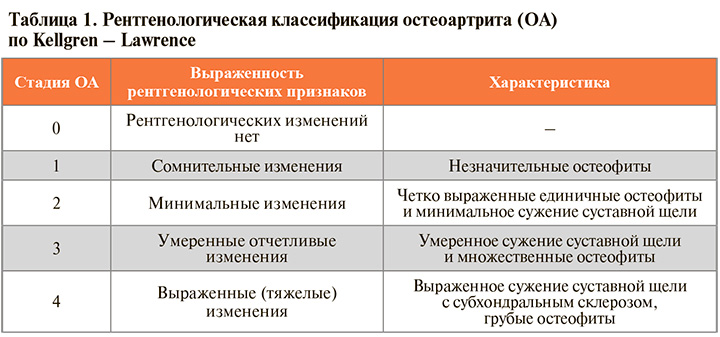
• Вместе с тем следует учитывать, что рентгенологические признаки гонартроза появляются намного позже морфологических изменений, в связи с чем диагностика раннего гонартроза с помощью рентгенографии весьма затруднена.
Рентгенографические изменения не коррелируют с выраженностью боли и нарушения функции коленного сустава. Существенным ограничением этого метода является и то, что с его помощью возможна лишь косвенная оценка состояния суставного хряща – по сужению рентгенологической суставной щели, на высоту которой в бедренно-большеберцовом сочленении влияет в том числе степень экструзии мениска к периферии.
• При наличии клинических, но отсутствии рентгенологических признаков гонартроза для выявления ранних этапов патологического процесса рекомендована магнитнорезонансная томография (МРТ) коленного сустава (один сустав), позволяющая определить начальные патологические изменения в суставном хряще (истончение, нарушение целостности, появление хрящевых и костно-хрящевых разрастаний), субхондральной кости (участки отека, кистовидной перестройки, остеонекроза) и менисках (дегенеративные изменения), а также в синовиальной оболочке (гипертрофия, наличие избыточного содержания синовиальной жидкости), связках, сухожилиях и мышцах: УУР – А, УДД – 1. МРТ суставов (один сустав) дает возможность визуализировать все степени изменения хряща от отека до истончения, разволокнения и растрескивания, состояние субхондральной костной ткани, изменения в менисках, «хондрофиты», воспаление синовиальной оболочки и т.п. Возможен расчет общего объема пораженного хряща и измененных участков субхондральной кости, а также оценка состояния связок коленного сустава.
• Показания к МРТ суставов (один сустав) также включают подозрение на травматическое повреждение менисков, сухожилий, связок, мышц или развитие остеонекроза. Кроме того, этот метод может использоваться для уточнения выраженности синовита и при подозрении на наличие/разрыв кисты Бейкера.
Лечение
1.
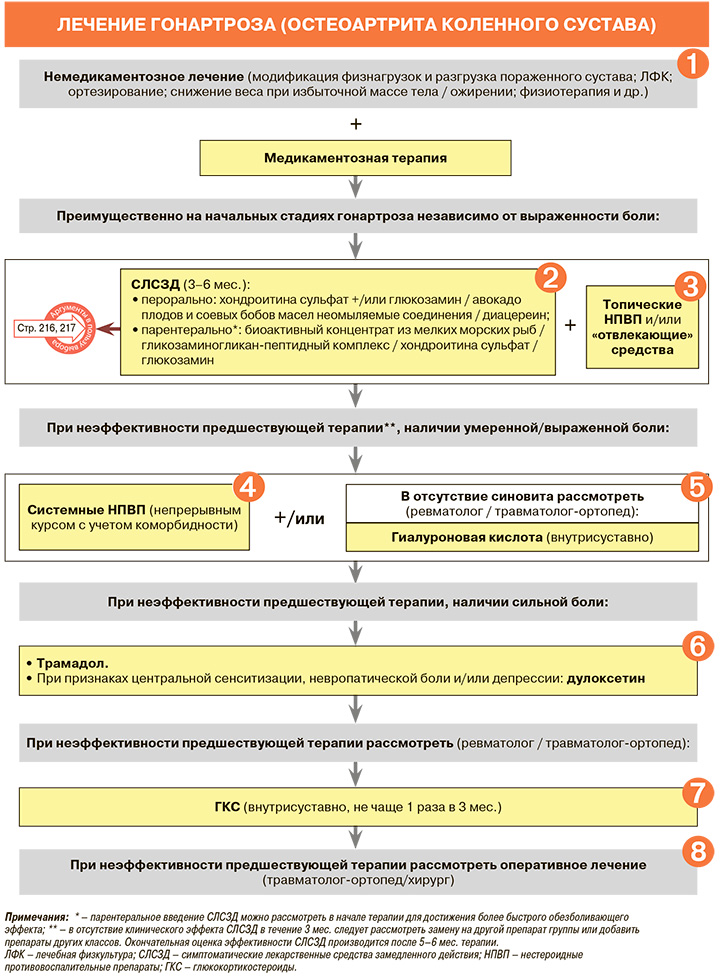
• Лечение гонартроза проводят на протяжении всей жизни пациента, а основу его составляет сочетание нефармакологических, фармакологических и хирургических методов. В качестве основных целей лечения могут быть рекомендованы эффективный контроль симптомов заболевания, прежде всего боли в пораженных коленных суставах, сохранение и улучшение их функции, а также снижение выраженности синовита, замедление прогрессирования патологического процесса и предупреждение деградации суставного хряща: УУР – С, УДД – 5.
• Всем пациентам с ОА рекомендована модификация спортивных/физических нагрузок и разгрузка пораженного сустава: избегание воздействия динамических и статических факторов, повышающих осевую нагрузку на коленный сустав (бег, длительная ходьба, прыжки, подъем тяжестей, пребывание в однообразной рабочей позе и т.п.); ношение обуви с хорошо амортизирующей подошвой; дополнительная опора на трость или костыль в руке, противоположной пораженному суставу при обострении: УУР – С, УДД – 5.
• Всем пациентам с ОА рекомендована лечебная физкультура (ЛФК) при заболеваниях и травмах суставов, направленная на укрепление мышц бедра и голени, являющаяся наиболее эффективным методом снижения болевых ощущений и улучшения функции сустава в долгосрочной перспективе: УУР – С, УДД – 5. Необходимо разъяснять пациентам, считающим любую форму физической активности фактором, усугубляющим их состояние, что целевые упражнения являются эффективной формой терапии.
• Снижение веса настоятельно рекомендуется пациентам с гонартрозом, имеющим избыточную массу тела или ожирение. Для этого могут быть рекомендованы соответствующие программы физических упражнений для купирования симптомов гонартроза и повышения эффективности снижения массы тела: УУР – С, УДД – 5. Снижение массы тела на ≥ 5% может быть связано с улучшением клинических и механических показателей у пациентов с ОА. Наиболее эффективная стратегия снижения веса включает оптимизацию рациона питания (уменьшение количества потребляемого жира, углеводов, ограничение потребления соли, увеличения фруктов и овощей) в сочетании с занятиями ЛФК.
• Пациентам с гонартрозом рекомендовано ортезирование пораженного коленного сустава при обострении, особенно в случаях преимущественной локализации заболевания в бедренно-надколенниковом сочленении: УУР – В, УДД – 2.
Ортезирование должно применяться дифференцированно в зависимости от паттернов поражения различных отделов коленного сустава.
• Для обеспечения комплексной терапии ОА совместно с медикаментозной терапией рекомендованы различные методы физиотерапии, обладающие противовоспалительным, обезболивающим и трофико-регенераторными эффектами: УУР – С, УДД – 5. Из этих методов с учетом индивидуальных особенностей пациентов рекомендованы следующие (УУР – С, УДД – 5): чрескожная электростимуляция нервов, ультразвуковое воздействие, воздействие электрическим полем ультравысокой частоты, воздействие синусоидальными модулированными токами (СМТ-терапия), высокочастотными электромагнитными полями (индуктотермия), сочетанное воздействие импульсных токов, ультрафонофорез лекарственный, магнитофорез лекарственных веществ, общая и локальная магнитотерапия.
• Пациентам с ОА рекомендован электрофорез лекарственных препаратов при заболеваниях суставов, электрофорез импульсными токами, электрофорез диадинамическими токами с учетом индивидуальных особенностей пациентов (ДЦТ-форез): УУР – С, УДД – 2.
• Пациентам с гонартрозом рекомендовано применение ударноволновой терапии на область коленных суставов, а также области бедра и голени: УУР – А, УДД – 1.
• Пациентам с гонартрозом рекомендовано проводить мануальную терапию при патобиомеханических изменениях в суставах и мышцах: УУР – В, УДД – 2.
• Пациентам с гонартрозом рекомендовано включать в программы медицинской реабилитации и санаторно-курортного лечения процедуры массажа для купирования болевого синдрома, снижения скованности и расширения функциональных возможностей заинтересованного сустава в краткосрочной перспективе: УУР – С, УДД – 2.
• Пациентам с гонартрозом рекомендован подводный душ-массаж лечебный, общий массаж медицинский, массаж нижней конечности медицинский, массаж коленного сустава: УУР – С, УДД – 5.
• Пациентам с ОА рекомендованы ванны сероводородные лечебные, ванны радоновые лечебные, ванны газовые (кислородные, углекислые, азотные): УУР – А, УДД – 2.
• Пациентам с гонартрозом рекомендовано использование локальной криотерапии на область коленных суставов: УУР – В, УДД – 2.
• Пациентам с первичным, посттравматическим и другим вторичным гонартрозом без выраженного синовита, с недостаточностью функции суставов не выше II степени рекомендовано санаторно-курортное лечение на грязевых и бальнеологических курортах: УУР – А, УДД – 2.
2.
• Пациентам преимущественно с начальными стадиями гонартроза вне зависимости от выраженности болевого синдрома рекомендуется назначение симптоматических лекарственных средств замедленного действия (СЛСЗД):
– хондроитина сульфата, глюкозамина, а также их комбинаций перорально или в виде растворов парентерально в соответствии с инструкциями по применению указанных препаратов для эффективного облегчения симптоматики ОА и получения структурно-модифицирующего эффекта при длительном использовании (УУР – А, УДД – 2);
– препарата на основе авокадо плодов и соевых бобов масел неомыляемых соединений для облегчения симптоматики ОА в дозе 300 мг/сут. (УУР – В, УДД – 1);
– диацереина для облегчения симптоматики ОА (УУР – В, УДД – 1);
– препаратов на основе биоактивного концентрата из мелких морских рыб или гликозаминогликан-пептидного комплекса для снижения выраженности симптоматики ОА (УУР – В, УДД – 2).
• Выраженный симптоматический эффект от применения СЛСЗД развивается через 8–12 нед. после начала приема, но для структурно-модифицирующего действия препаратов продолжительность лечения должна составлять не менее 2 лет. В отличие от нестероидных противовоспалительных препаратов (НПВП), СЛСЗД после прекращения лечения обладают эффектом последействия в течение 2–4 мес.
• В начале терапии для повышения биодоступности и достижения более быстрого обезболивающего эффекта препараты на основе хондроитина сульфата, глюкозамина и другие препараты из группы СЛСЗД (биоактивный концентрат из мелких морских рыб или гликозаминогликан-пептидный комплекс) могут назначаться парентерально, например, в виде внутримышечных инъекций, в соответствии с действующими инструкциями по их применению.
• По данным метаанализа, кристаллический глюкозамина сульфат достоверно снижал боль, улучшал функцию сустава и снижал болевой синдром при ОА, в то время как другие формы этого активного вещества не демонстрировали достоверной разницы по этим показателям в сравнении с плацебо.
Кристаллический глюкозамина сульфат демонстрировал также сопоставимую с НПВП ибупрофеном эффективность в плане купирования боли и улучшения функции сустава уже со второй недели применения. В других исследованиях было показано, что глюкозамина сульфат замедлял сужение суставной щели и снижал потребность в эндопротезировании суставов при остеоартрите у пациентов на протяжении 8 лет наблюдения. В двухлетнем рандомизированном контролируемом исследовании (РКИ) было доказано значимое снижение потери объема суставного хряща по данным количественной МРТ при приеме хондроитина сульфата в дозе 1200 мг/сут. у пациентов с остеоартритом коленного сустава. Суточные терапевтические дозы для глюкозамина и хондроитина сульфата (наиболее изученных СЛСЗД в плане эффективности и безопасности использования при ОА) составляют 1500 и 800 мг соответственно. Важно подчеркнуть, что, согласно результатам последних метаанализов, положительные данные об эффективности оригинальных стандартизированных лекарственных препаратов из группы СЛСЗД не могут быть экстраполированы на дженерики, биологически активные добавки и прочие незарегистрированные как фармакологическое средства субстанции.
• Недавний метаанализ эффективности и безопасности препарата на основе неомыляемых соединений масел авокадо и сои продемонстрировал его значительный симптоматический эффект в плане снижения болевого синдрома при сравнимой с плацебо частоте нежелательных явлений. Однако нет убедительных данных о наличии у этого препарата структурно-модифицирующего действия.
• Проведенное в 2019 г. международное многоцентровое двойное слепое сравнительное исследование целекоксиба и диацереина подтвердило анальгетическую и противовоспалительную эффективность последнего при ОА. Эффективность и безопасность диацереина при ОА коленного сустава была также подтверждена в метаанализе, обобщившем результаты 12 РКИ, включавших 1732 профильных пациента. Поэтому этот препарата может быть альтернативой применению препаратов из группы НПВП при лечении гонартроза, особенно у больных, имеющих противопоказания для подобной терапии, так как не вызывает нежелательных явлений, характерных для применения НПВП. В то же время следует учитывать, что прием диацереина может вызывать нежелательные явления со стороны желудочно-кишечного тракта (диарею, метеоризм, боли в эпигастральной области).
• Препараты на основе биоактивного концентрата из мелких морских рыб, а также препараты гликозаминогликан-пептидного комплекса, которые имеют показания к применению при гонартрозе, также продемонстрировали в плацебоконтролируемых РКИ симптоматическую эффективность в отношении снижения боли.
• В случае отсутствия в течение 3 мес. клинического эффекта у пациентов, получающих СЛСЗД, целесообразно рассмотреть замену применяемого препарата на другое лекарственное средство этой группы или дополнительное назначение препаратов из других фармакологических групп с учетом целесообразности окончательной оценки эффективности препаратов СЛСЗД после завершения полного лечебного курса, продолжающегося обычно 5–6 мес.
3.
• Для купирования умеренной боли при гонартрозе до назначения пероральных НПВП взрослым пациентам рекомендуется использование трансдермальных (топических) форм этих препаратов: УУР – А, УДД – 1. Местное применение диклофенака при гонартрозе в дозе 70–81 мг/сут. является эффективной и безопасной лечебной стратегией. Кроме того, локальные формы и других НПВП оказывают выраженное анальгетическое действие при ОА коленного сустава, обладают хорошей переносимостью и практически не вызывают системных побочных эффектов, так как их концентрация в системном кровотоке не превышает 5–15% по сравнению с пероральным приемом тех же НПВП.
• Рекомендовано при мышечных и суставных болях у пациентов с гонартрозом использование препаратов для местного применения (местнораздражающих средств): УУР – С, УДД – 5. Препараты этой группы, вызывая локальное раздражение кожи, приводят к фармакологическим эффектам как рефлекторного (кожновисцерального), так и анальгетического (отвлекающее действие дополнительной афферентной импульсации) характера. Возможно, что ослабление боли происходит и за счет активации антиноцицептивных механизмов в центральной нервной системе (ЦНС).
4.
• Пациентам с гонартрозом при умеренном и выраженном болевом синдроме для быстрого и эффективного уменьшения болей в пораженных коленных суставах рекомендовано назначение системных НПВП с учетом коморбидности: УУР – А, УДД – 1. При этом рекомендуется назначение непрерывного курса НПВП, который обеспечивает лучший контроль симптомов при гонартрозе, чем прием этих лекарственных средств в режиме «по требованию»: УУР – В, УДД – 2.
• НПВП в средних и максимальных терапевтических дозах при лечении хронической боли не уступают по эффективности трамадолу. Клиническая эффективность рекомендуемых доз НПВП примерно одинакова, а основное различие заключается в индивидуальной реакции пациентов на конкретный препарат. Поэтому выбор лекарственного средства из этой группы должен осуществляться индивидуально с учетом фармакологических особенностей каждого препарата и сопутствующих заболеваний конкретного пациента.
• Прием НПВП может приводить к развитию серьезных нежелательных явлений, наиболее распространенные из которых эрозивно-язвенные поражения органов желудочно-кишечного тракта (ЖКТ), кардиоваскулярные осложнения и нарушение функции почек. При этом в большинстве своем побочные эффекты слабо выражены и являются транзиторными. Тем не менее в ряде случаев (0,25–1,58%) поражение ЖКТ может приводить к кровотечениям и перфорациям. К основным факторам риска развития нежелательных явлений со стороны ЖКТ относятся возраст > 65 лет, язвенная болезнь желудка и двенадцатиперстной кишки, а также кровотечение из верхних отделов ЖКТ в анамнезе, сопутствующий прием антитромботических средств. В свою очередь, ведущими факторами риска развития побочных эффектов со стороны сердечно-сосудистой системы являются кардиоваскулярные заболевания (ишемическая болезнь сердца, гипертоническая болезнь, хроническая сердечная недостаточность и др.), а также высокий сердечно-сосудистый риск. Следует отметить, что частота нетяжелых осложнений со стороны ЖКТ и сердечно-сосудистых осложнений на фоне приема НПВП постоянно повышается и становится значимой уже через 4 нед. терапии. Таким образом, при назначении НПВП следует учитывать возможное раннее появление незначительных нежелательных явлений, а также переносимость препарата и предпочтения пациента.
При длительном использовании НПВП целесообразно мониторировать состояние ЖКТ, функцию печени и почек и измерение артериального давления на периферических артериях у профильных пациентов.
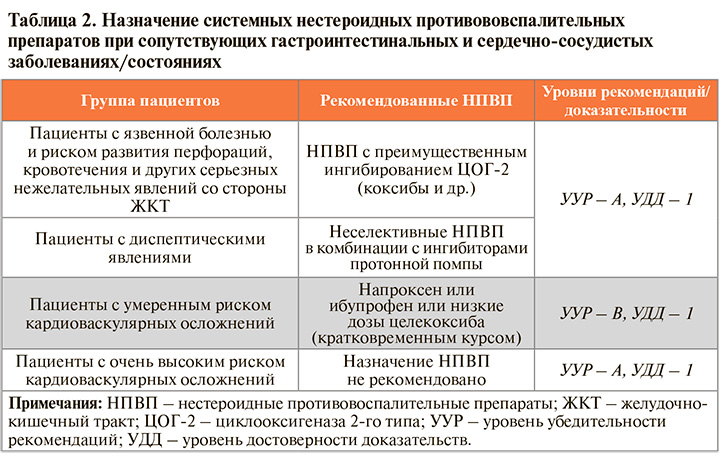
• Рекомендации по назначению НПВП в зависимости от желудочно-кишечной и сердечно-сосудистой коморбидности отражены в таблице 2.
• Не рекомендуется одновременное использование двух и более разных препаратов из группы НПВП, так как это увеличивает риск развития нежелательных явлений: УУР – С, УДД – 5.
• Принятие решения о модификации НПВП-терапии целесообразно через 5–7 сут. от начала лечения препаратами данной группы (при неэффективности предшествующей анальгетической терапии).
• При неэффективности или наличии противопоказаний к применению НПВП рекомендуется прием парацетамола в соответствии с действующей инструкцией по его применению: УУР – С, УДД – 5. Парацетамол долгое время считался препаратом выбора при слабых или умеренных болях при ОА без признаков выраженного воспаления, поскольку полагали, что его анальгетическая эффективность сопоставима с НПВП. Однако последующие исследования показали не только его низкую анальгетическую эффективность, сопоставимую с плацебо при ОА коленных суставов, но и частые нежелательные явления со стороны ЖКТ и сердечно-сосудистой системы. Поэтому в настоящее время он может использоваться при неэффективности или наличии противопоказаний к НПВП в суточной дозе не выше 3,0 г при условии достижения удовлетворительного клинического эффекта. Препарат не следует назначать больным с поражениями печени и хроническим алкоголизмом.
5.
• Взрослым пациентам с ОА при болевом синдроме и функциональных нарушениях в коленных суставах рекомендуется внутрисуставное введение средств для замещения синовиальной жидкости (протезов синовиальной жидкости) на основе гиалуроновой кислоты: УУР – В, УДД – 1. Внутрисуставное применение производных гиалуроната натрия может приводить к положительному клиническому эффекту различной степени выраженности, средняя продолжительность которого составляет ≥ 4–6 мес., сильно варьируя в зависимости от физико-химических характеристик конкретного изделия медицинского назначения и клинических особенностей пациента. После окончания клинического эффекта инъекция может быть выполнена повторно.
• Внутрисуставные средства на основе гиалуроновой кислоты имеют более благоприятный профиль безопасности, чем НПВП, и могут быть альтернативой НПВП при лечении гонартроза, особенно у пожилых пациентов и у лиц с высокой коморбидностью. Лечение хорошо переносится и в этом плане сопоставимо с плацебо: очень редко возникают боли по типу псевдоподагрической атаки. Результаты сравнительных исследований внутрисуставного введения средств на основе гиалуроновой кислоты и глюкокортикостероидов (ГКС) показывают примерно равную их эффективность через 4 нед. после инъекции и достоверно больший эффект гиалуроновой кислоты через 5–13 нед. после введения.
Препараты гиалуроновой кислоты следует вводить в коленный сустав только при отсутствии синовита (в «сухой» сустав).
6.
• При неэффективности предшествующей консервативной терапии ОА или наличии противопоказаний для ее использования рекомендуется для контроля сильной боли использовать трамадол, учитывая риски развития нежелательных явлений со стороны ЖКТ и ЦНС при его длительном применении: УУР – A, УДД – 1. Слабый опиоид трамадол оказывает умеренно выраженное дозозависимое анальгетическое действие при гонартрозе. Отсутствие прямого ульцерогенного и протромботического влияния делает возможным его назначение у больных с высоким ЖКТ и кардиоваскулярным риском. Механизм действия трамадола отличается от НПВП, что делает целесообразным его применение при неэффективности последних. Однако большое число нежелательных явлений (тошнота, запоры, нарушения сна, головокружение, риск развития привыкания и т.д.) и социальные проблемы, связанные с нецелевым использованием опиоидов, ограничивают возможности использования этого препарата.
• Для контроля сильной хронической боли, связанной с гонартрозом, при неэффективности предшествующей консервативной терапии и наличии признаков центральной сенситизации, невропатической боли и/или депрессии рекомендуется прием дулоксетина: УУР – В, УДД – 1. Анальгетическое действие антидепрессанта дулоксетина (селективный ингибитор обратного захвата серотонина и норадреналина) связано с влиянием на центральные механизмы ноцицепции, что определяет его эффективность при фибромиалгии и невропатической боли. Метаанализ, посвященный применению дулоксетина при гонартрозе, свидетельствует о значимом уменьшении боли, скованности, функциональной недостаточности и улучшении качества жизни на фоне такой терапии. При этом дулоксетин способен вызывать различные нежелательные явления, поэтому его назначение требует тщательного врачебного контроля и постепенного увеличения дозы, начиная с минимальной 30 мг/сут.
7.
• В случаях сохранения выраженной суставной боли и синовита, которые не купируются другими методами консервативной терапии, рекомендуется внутрисуставное введение ГКС, но не чаще 1 раза в 3 мес., а курсовое применение этих препаратов следует исключить: УУР – В, УДД – 2. Внутрисуставное введение ГКС оказывает сильный противовоспалительный эффект, однако сопряжено с высоким риском развития вторичного остеонекроза и с усугублением деградации суставного хряща.
• Кроме препаратов гиалуроновой кислоты и ГКС, для внутрисуставного введения при гонартрозе рекомендована (при наличии инициативы со стороны пациента) обогащенная тромбоцитами плазма (УУР – В, УДД – 1). Недавний метаанализ 30 РКИ показал превосходство внутрисуставных инъекции обогащенной тромбоцитами плазмы по сравнению с ГКС, гиалуроновой кислотой и плацебо у пациентов с ОА коленного сустава через 3, 6 и 12 мес. наблюдения.
8.
Наряду с неудовлетворительным эффектом консервативной терапии (невозможности купирования болевого синдрома) хирургическое лечение гонартроза рекомендовано в том случае, если при первичном обращении за медицинской помощью у пациента определяются выраженные дегенеративнодистрофические изменения в суставе, сопровождающиеся стойкими функциональными нарушениями: УУР – C, УДД – 5.



