Ряд физиологических гемодинамических, метаболических и гормональных изменений, происходящих у женщины во время беременности, делает ее более уязвимой к развитию нарушений ритма сердца. Физиологические сердечно-сосудистые изменения во время беременности увеличивают вероятность развития аритмии de novo или рецидива ранее имеющейся аритмии. В современном мире все больше женщин с оперированными врожденными пороками сердца доживает до репродуктивного возраста, при этом с наступлением беременности риск развития аритмий увеличивается. Кроме этого, возрастает число женщин, откладывающих беременность на более поздний срок, что повышает угрозу развития аритмий в период гестации, поскольку распространенность сердечно-сосудистых заболеваний (ССЗ) увеличивается с возрастом [1].
РАСПРОСТРАНЕННОСТЬ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У БЕРЕМЕННЫХ
Во время беременности фибрилляция предсердий (ФП) редко встречается у женщин без органического поражения сердца или патологии щитовидной железы. Врожденные пороки сердца, пролапс митрального клапана и кардиомиопатии – наиболее частые заболевания сердца, при которых риск развития ФП потенцируется. Тиреотоксикоз и хронические заболевания легких – другие заболевания, предрасполагающие к возникновению ФП.
Целью исследования Silversides C.K. et al. было определение частоты рецидивов аритмий во время беременности и их влияние на внутриутробные и неонатальные исходы среди 73 женщин, имевших нарушения ритма сердца до беременности и получивших акушерскую помощь в период с 1990 по 2002 г. [2]. У наблюдаемых женщин было 83 беременности: 36 у женщин с пароксизмальной суправентрикулярной тахикардией в анамнезе, 23 – с ФП/трепетанием предсердий (ТП), 6 – с персистирующей ФП/ТП, 22 – с желудочковой тахикардией в анамнезе. При исходно синусовом ритме в 44% случаев развились рецидивы тахиаритмий во время беременности или в раннем послеродовом периоде: у женщин с суправентрикулярной тахикардией, ФП/ТП и желудочковой тахикардией в анамнезе частота рецидива составила 50, 52 и 27% соответственно. У 6 женщин ФП/ТП сохранялась в течение всей беременности. Неблагоприятные внутриутробные осложнения развились в 20% случаев и чаще встречались у женщин, имевших аритмии до беременности, в сравнении с теми, у кого нарушения ритма сердца до беременности отсутствовали (относительный риск 3,4; 95% доверительный интервал (ДИ): 1,0–11,0; p=0,045). Авторы сделали заключение, что женщины с нарушениями ритма сердца в анамнезе должны находиться под особым наблюдением, так как беременность может провоцировать не только рецидив аритмий, но и неблагоприятное влияние на внутриутробное развитие плода.
В работе Vaidya V.R. et al. [3] за период 2000–2012 гг. были выявлены 57 315 593 госпитализаций, связанных с беременностью. Общая частота аритмий, ассоциированных с беременностью, составила 68 на 100 000, из них ФП – 27 на 100 000, ТП – 4 на 100 000, суправентрикулярные тахикардии – 19 на 100 000, фибрилляция желудочков – 2 на 100 000, желудочковая тахикардия – 16 на 100 000. Авторы исследования констатировали, что за указанный период количество госпитализаций по поводу беременности с аритмиями увеличилось на 58% (р <0,001 для тренда). Увеличение в первую очередь было вызвано большим количеством ФП (увеличение на 111%; р <0,001 для тренда) и желудочковой тахикардии (увеличение на 127%; р <0,001 для тренда), тогда как частота суправентрикулярной тахикардии оставалась стабильной с течением времени (рост на 12%; р <0,001 для тренда). Женщины в возрасте от 41 до 50 лет имели в целом более высокие показатели частоты возникновения любой аритмии (199 на 100 000) по сравнению с возрастной группой от 18 до 30 лет (55 на 100 000). Любые аритмии чаще встречались у темнокожих женщин по сравнению с белыми (116 против 73 на 100 000; р <0,001). Принципиально важное наблюдение, полученное в данном исследовании: внутригоспитальная смертность, а также осложнения со стороны матери или плода у беременных с любой аритмией были выше (36,5 и 5,9% соответственно) по сравнению с женщинами в целом (0 и 21,8% соответственно).
В ретроспективном популяционном исследовании [4], проведенном в Калифорнии (2003–2013), под наблюдением находилось 210 356 женщин, у которых было 264 730 беременностей. ФП была выявлена при 157 беременностях (у 129 женщин; 63,3 на 100 000 женщин или 59,3 на 100 000 беременностей). Распространенность ФП (на 100 000 женщин) у белых, темнокожих, азиатских и латиноамериканских женщин составила 111,6; 101,7; 45,0 и 34,3 соответственно. Беременные с ФП имели предшествующие сопутствующие заболевания, включая артериальную гипертонию (7,0%), гиперлипидемию (12,4%) и сахарный диабет (7,0%). Структурные заболевания сердца в анамнезе (ревматическая болезнь сердца, врожденные пороки сердца и кардиомиопатия) наблюдались только у 7 пациенток (5,4%). ФП в анамнезе была зарегистрирована у 93 женщин (42,2 на 100 000 женщин), в то время как у 45 женщин ФП впервые была диагностирована во время беременности или в течение 6-месячного послеродового периода (21,4 на 100 000 женщин). По сравнению с женщинами в возрасте младше 25 лет ФП чаще наблюдалась у матерей в возрастном диапазоне 30–34 года (87,1 на 100 000; р <0,001), женщин 35–39 лет (104,7 на 100 000; р <0,001) и старше 40 лет (109,7 на 100 000; р <0,001).
Клинически значимые эпизоды ФП были выше в течение III триместра беременности по сравнению с I триместром (отношение шансов (ОШ) 3,2; 95% ДИ: 1,5–7,7). В 99,4% случаев беременности закончились рождением живых детей, однако частота поступления новорожденных в отделение интенсивной терапии была выше у женщин с ФП, чем у женщин без этого заболевания (10,8 против 5,1%; р=0,0003). Исследователи сделали вывод, что возраст выступает фактором риска развития ФП у беременных, а риск возникновения данной аритмии наиболее высок в III триместре беременности. Потребности в наблюдении в отделении интенсивной терапии выше у тех новорожденных, чьи матери имели ФП.
Группа исследователей Salam A.M. et al. проспективно наблюдала 1321 беременную женщину с врожденными пороками сердца, клапанными заболеваниями, кардиомиопатиями и ишемической болезнью сердца из 28 стран (регистр беременностей и заболеваний сердца ROPAC) [5]. ФП/ТП у беременных развились в 1,3% случаев, преимущественно в III триместре (61,5%). Однофакторный анализ выявил факторы риска развития ФП/ТП во время беременности:
- ФП/ТП в анамнезе до беременности (ОШ 7,1; 95% ДИ: 1,5–32,8);
- митральные пороки сердца (ОШ 6,9; 95% ДИ: 2,6–18,3);
- использование бета-блокаторов (ОШ 3,3; 95% ДИ: 1,2–9,0). Материнская смертность была выше у женщин с ФП/ТП в сравнении с женщинами без этих патологий (1,8 против 0,9%; р=0,01). Низкий вес детей при рождении (менее 2500 г) чаще встречался у молодых матерей с ФП/ТП относительно женщин без этих аритмий (35 против 14%; р=0,02). Результаты данного регистра показали, что ФП/ТП в период беременности у пациенток кардиологического профиля ассоциируется с неблагоприятным исходом у матери, а также негативно влияет на вес ребенка при рождении.
Таким образом, ФП – одна из наиболее распространенных аритмий, частота которой во время беременности составляет 27 на 100 000 [6]. Гемодинамические нарушения и тромбоэмболические события, связанные с ФП, приводят к значительной заболеваемости и смертности [3, 4, 6]. Женщины с ССЗ имеют повышенный риск акушерских осложнений, включая преждевременные роды, преэклампсию и послеродовое кровотечение. С целью минимизации осложнений во время беременности всем женщинам детородного возраста с ССЗ до зачатия необходимо проводить оценку материнского риска, используя классификацию ВОЗ (I, C) [6, 7, 8]. Согласно этой классификации, женщины с большинством суправентрикулярных аритмий, включая ФП, относятся к низкому риску осложнений во время беременности (I, C), однако оценка этого риска в дальнейшем должна пересматриваться врачом при каждом посещении беременной женщины для определения тактики ведения пациентки.
ТАКТИКА АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ ФП У БЕРЕМЕННЫХ
Особого внимания заслуживают вопросы антиаритмической терапии ФП у беременных с учетом того, что органогенез происходит в течение I триместра, и развивающийся плод может находиться под влиянием потенциально тератогенного действия лекарственных препаратов. Во II и III триместрах беременности лекарства могут оказывать воздействие на рост плода и/или приводить к возникновению аритмии. Сложность проблемы заключается в том, что лечение нарушений ритма сердца, оптимальное для женщины, может быть связано с потенциальным вредом для ребенка, а безопасная для плода терапия не всегда оказывается достаточной для матери. В связи с этим фармакотерапия аритмий у беременных должна проводиться по строгим клиническим показаниям. В настоящее время соответствующих рандомизированных исследований недостаточно, и в большинстве случаев рекомендации соответствуют уровню доказательств С [6, 23].
Для консультирования беременных женщин и кормящих матерей, нуждающихся в медикаментозной терапии, используют классификацию Управления по контролю за безопасностью пищевых продуктов и лекарственных препаратов (FDA) от 2015 г. [9]. Перед началом антиаритмической терапии беременной женщины необходимо проверить данные по клинической безопасности препарата (табл. 1).
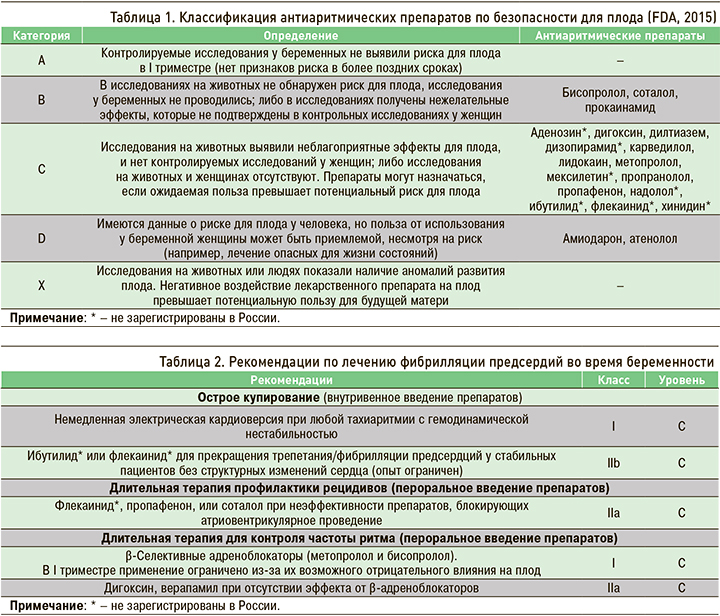
Данные, представленные в классификации, показывают, что абсолютно безопасных для беременных антиаритмических средств не существует. Большинство лекарственных препаратов, применяемых для лечения аритмий, относятся к категории С, в связи с чем наличие у беременной женщины коротких малосимптомных/асимптомных пароксизмов ФП не требует назначения антиаритмической терапии.
Электрическая кардиоверсия применяется в случае нестабильной гемодинамики на фоне тахиаритмии и считается безопасной как для матери, так и для плода (I, С; табл. 2) [6, 23]. Однако с учетом риска эмбрионального дистресс-синдрома она должна проводиться только в условиях возможности мониторирования витальных функций плода и срочного выполнения кесарева сечения [3, 10]. Следует также иметь в виду, что почти все антиаритмические препараты проникают через плаценту. При условии отсутствия у стабильных пациенток структурных изменений сердца для купирования ФП может обсуждаться применение антиаритмических препаратов III класса (ибутилид) и IC класса (флекаинид), при этом они имеют класс рекомендации и уровень доказательности IIb, C [6, 11, 12, 23]. В национальных рекомендациях по лечению ССЗ у беременных (2018) регламентировано, что фармакологическую кардиоверсию можно проводить ААП IА класса новокаинамидом, но только при отсутствии признаков сердечной недостаточности [14].
В рамках длительного медикаментозного лечения ФП у беременных выбор делается между двумя стратегиями: контролью синусового ритма (электроимпульсная терапия или фармакологическая кардиоверсия) с последующей профилактикой рецидивов ФП или контролью частоты желудочкового ритма при сохранении ФП (исключение – осложненное течение ФП).
Контроль ритма – предпочтительная стратегия в период беременности, которая позволяет избежать потенциально негативного влияния на плод, вызванного побочными эффектами антиаритмических препаратов, а также вероятной гемодинамической нестабильностью, связанной с тахиаритмией.
Антиаритмические препараты IС класса (флекаинид и пропафенон) или III класса (соталол) используют для профилактики рецидивов ФП у беременных без органической патологии сердца или с артериальной гипертонией без гипертрофии миокарда (IIa, C; см. табл. 2), [3, 6, 10, 14, 23], но беременным с систолической дисфункцией левого желудочка (фракция выброса <40%) лечение этими препаратами противопоказано в связи с ухудшением прогноза жизни.
При имеющихся показаниях к сохранению ФП и для контроля частоты сокращений желудочков рекомендуются селективные β-адреноблокаторы (I, C; см. табл. 2) [6, 23]. В национальных рекомендациях для урежения желудочковых сокращений рекомендованы β-адреноблокаторы и недигидропиридиновые антагонисты кальция (IIa, C) [14]. При отсутствии эффекта от β-адреноблокаторов возможно применение дигоксина или верапамила (IIa, C; см. табл.2) [6, 23]. В национальных рекомендациях обсуждается применение дигоксина с классом рекомендаций/уровнем доказательности IIb, C при наличии противопоказаний к β-адреноблокаторам [14].
Антиаритмический препарат III класса амиодарон может вызывать неблагоприятные исходы для плода, такие как гипотиреоз/гипертиреоз, поэтому не должен применяться во время беременности [6, 13, 15].
В национальных рекомендациях указано, что при тяжелых, рефрактерных к медикаментозному лечению пароксизмах ФП и ТП во время беременности возможно применение катетерной радиочастотной абляции (РЧА) [14]. В Европейских рекомендациях РЧА в период беременности обсуждается при суправентрикулярных тахикардиях и должна рассматриваться к применению в специализированных центрах в случае лекарственной рефрактерности и плохо переносимой аритмии (IIa, C) [6].
ТАКТИКА АНТИКОАГУЛЯНТНОЙ ТЕРАПИИ ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У БЕРЕМЕННЫХ
При беременности в организме женщины происходят выраженные физиологические изменения, в числе которых увеличение содержания факторов свертывания и фибриногена [6], что, в свою очередь, повышает риск тромбообразования. Согласно рекомендациям, проведение антикоагулянтной терапии при ФП у беременных обязательно для предупреждения тромбоэмболических осложнений (ТЭО) [6, 14, 23].
В отношении беременных должна использоваться та же шкала оценки риска инсульта, что и для небеременных – CHA2DS2-VASc (табл. 3) [10]. Антикоагулянтная терапия для профилактики ишемического инсульта показана в течение всего срока беременности всем пациенткам с ФП при высоком риске ТЭО [14]. При назначении антикоагулянтов необходимо помнить о повышенном риске геморрагических осложнений, включая послеродовое и ретроплацентарное кровотечение [6].
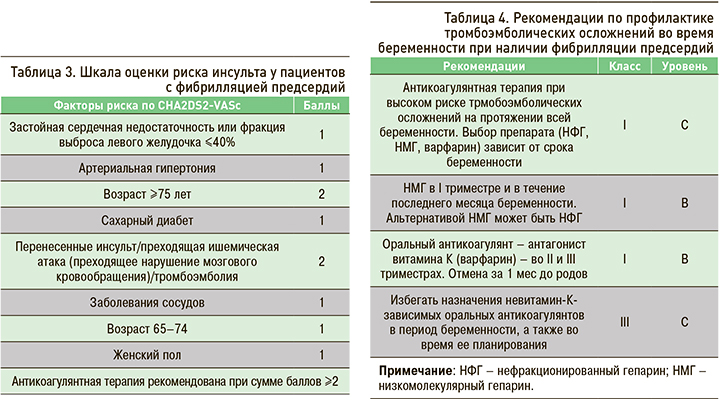
Препаратами выбора при решении вопроса о назначении антикоагулянтной терапии в зависимости от срока беременности могут быть нефракционированный гепарин (НФГ), низкомолекулярный гепарин (НМГ) или антагонист витамина К (АВК) варфарин (табл. 4) [14].
НМГ и АВК имеют свои преимущества и недостатки при использовании во время беременности [6, 23]. Варфарин проникает через плаценту, и его использование в I триместре беременности может привести к эмбриопатиям, включая дефекты конечностей и назальную гипоплазию в 0,6–10% случаев. Имеются данные, что риск эмбриопатий при приеме АВК является дозозависимым. Согласно двум систематическим обзорам [17, 18], вероятность эмбриопатий при применении низких доз варфарина (не превышающих 5 мг) составил 0,45–0,9%.
В дополнение к угрозе эмбриопатии, ограниченной I триместром беременности, в 0,7–2% случаев существует риск фетопатии, если АВК применяется во II и III триместрах. Это, к примеру, аномалии развития зрительного нерва, центральной нервной системы и возникновение внутричерепного кровоизлияния [19, 20]. Кроме этого, на фоне приема АВК противопоказаны роды через естественные родовые пути в связи с высоким риском внутричерепного кровоизлияния у ребенка [20].
Замена АВК на НМГ в III триместре беременности почти исключает риск эмбриопатии [6]. НМГ считаются безопасными, так как не проникают через плаценту [12]. Подкожное введение НМГ рекомендуется в Ш триместре и в течение последнего месяца беременности [14].
Альтернативой НМГ может служить НФГ, вводимый в дозе, достаточной для удлинения активированного частичного тромбопластинового времени (АЧТВ) в 1,5 раза по сравнению с контрольным значением (уровень доказательств В) [6, 14, 23]. НФГ не проникают через плаценту, однако его применение в большей степени ассоциировано с тромбоцитопенией (уровень тромбоцитов рекомендуется контролировать каждые 2–3 дня) и остеопорозом. Кроме того, применение НФГ требует более частого его введения при подкожном использовании по сравнению с НМГ.
Учитывая, что некоторым женщинам может потребоваться корректировка дозы АВК или гепарина для поддержания адекватной антикоагуляции, в III триместре беременности рекомендуется лабораторный контроль коагуляционного статуса каждые 10–14 дней [12] и уровня анти-Ха-активности [6].
Прием новых оральных антикоагулянтов (ОАК) во время беременности противопоказан [6, 16, 23]. Так, в период с декабря 2014 г. по декабрь 2015 г. был проведен анализ 137 из 233 зарегистрированных случаев приема ОАК у беременных (табл. 5) [21]. Ривароксабан применялся чаще других ОАК – в 176 случаях, в то время как апиксабан – в 21, дабигатрана этексилат – в 26, а эдоксабан – в 10. Из 137 доступных к анализу беременностей с зарегистрированными исходами, в течение которых женщины принимали ОАК, живорождением закончились 67 беременностей, в остальных случаях наблюдался выкидыш (n=31) или плановое прерывание беременности (n=39).
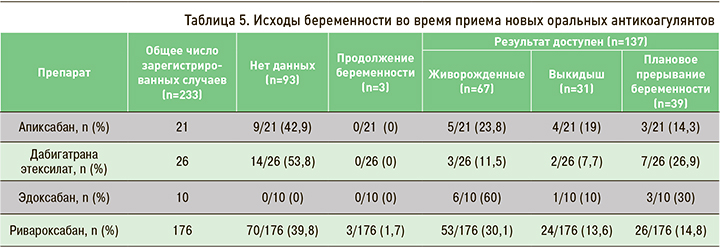
В 7 случаях (5,1%) наблюдались анатомические аномалии, 3 (2,2%) из которых потенциально можно было интерпретировать как эмбриопатию, связанную с лекарственными препаратами, даже несмотря на отсутствие повторяющихся паттернов аномалий. Данные об исходах отсутствовали примерно в 40% случаев, в связи с чем авторы заключили, что в рамках ограничения результатов нельзя говорить о возможности безопасного использования ОАК у пациенток, планирующих забеременеть или во время беременности.
Другими авторами проведен анализ применения ОАК в период 236 беременностей, зарегистрированных до 4 июля 2017 г. [22]. Во время указанных беременностей ривароксабан применялся наиболее часто (n=178). Данные об исходах были доступны для 140 беременностей (59%). Плановое прерывание беременности проводилось у 39 женщин (28%), большинство из которых было сделано по социальным показаниям. В остальной 101 беременности частота выкидышей составила 31% (n=31), а рождаемость – 68% (n=69). Аномалии развития плода и новорожденного наблюдались в 8 случаях (4%), половина которых предположительно была связана с приемом ривароксабана в течение I триместра беременности. Лишь в 18% случаев сообщалось о наличии или отсутствии тромботических осложнений и осложнений в виде кровотечения. Авторы исследования выразили обеспокоенность в отношении безопасности приема ОАК в связи с высокой частотой выкидышей и 4% аномалий развития плода и новорожденного; они пришли к выводу о недостаточности данных для оценки безопасности и эффективности применения этой группы препаратов в период беременности.
ЗАКЛЮЧЕНИЕ
ФП встречается во время беременности относительно редко, однако ее наличие сопряжено с повышенным риском развития неблагоприятных исходов как для матери, так и плода. Сложности в терапии ФП у беременных заключаются в повышенном риске развития побочных явлений со стороны плода при применении лекарственных препаратов и отсутствии крупных рандомизированных исследований.
Основные подходы к лечению ФП у беременных включают контроль синусового ритма антиаритмическими препаратами IС или III классов с последующей профилактикой рецидива ФП, а также антикоагулянтную терапию с целью профилактики тромбоэмболических осложнений. В качестве основных антикоагулянтных средств при беременности применяются НМГ, НФГ и АВК в зависимости от сроков беременности. ОАК беременным женщинам противопоказаны.



