ВВЕДЕНИЕ
Церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией (ЦАДАСИЛ, от англ. CADASIL – Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy) – наследственное моногенное заболевание с вовлечением мелких сосудов и ишемическим повреждением головного мозга [1–4]. Заболевание обусловлено мутацией в гене NOTCH3, который расположен на коротком плече 19-й хромосомы и кодирует трансмембранный рецептор NOTCH 3 – белок, участвующий в регуляции ангиогенеза [4]. Внеклеточный домен белка NOTCH3 включает 34 одинаковых фрагмента, подобных фактору роста эпидермиса (англ. epidermal growth factor (EGF)-like repeats, EGFrs). Каждый такой фрагмент содержит 6 аминокислотных остатков цистеина.
К настоящему времени описано уже более 280 патогенных мутаций гена NOTCH3 [4]. Большинство из вызывающих ЦАДАСИЛ мутаций расположены в 2–24 (из них чаще в 2–6) экзонах этого гена, кодирующих 34 повтора EGFrs. Основную часть составляют «цистеин-изменяющие» миссенс-мутации, которые приводят к увеличению или уменьшению числа цистеиновых остатков в EGFrs части белка NOTCH3 [4, 5]. Результатом этого служит изменение конформации данного белка и его дисфункция, запускающая каскад молекулярных изменений в клетке и в итоге способствующая развитию прогрессирующих изменений в стенках артериол и капилляров [4, 6, 7].
Основным патоморфологическим признаком ЦАДАСИЛ выступает изменение мелких сосудов в головном мозге, коже и мышцах с накоплением патологических белковых микроагрегатов (включающих внеклеточный домен рецептора NOTCH3) в области перицитов и базальной мембраны капилляров и дегенерацией гладкомышечных клеток в стенках артериол [4].
До последнего времени ЦАДАСИЛ считался редким наследственным заболеванием с предполагаемой распространенностью 2–5 на 100 000 представителей европеоидной расы [7]. Однако истинная частота ЦАДАСИЛ может быть значительно выше, поскольку проведенные в последние годы крупномасштабные геномные исследования указывают на высокую встречаемость патогенных мутаций NOTCH3 среди населения [4].
Клинические проявления ЦАДАСИЛ включают 4 группы «классических» симптомов: мигрень с аурой и другие головные боли (до 80% случаев); повторные подкорковые (чаще лакунарные) ишемические инсульты с негрубыми двигательными, чувствительными и координаторными нарушениями (60–85%); расстройства настроения/апатия (до 20%); когнитивные нарушения (до 10–20%) [8]. Наряду с этим могут отмечаться судорожные припадки (5–10%), нарушения ходьбы, недержание мочи по центральному типу, псевдобульбарный синдром, а также обратимая энцефалопатия с острым началом, обозначаемая как CADASIL-кома [9]. К «атипичным» проявлениям ЦАДАСИЛ относят гемиплегическую мигрень, рецидивирующий эпилептический статус, геморрагический инсульт, психозы, острый вестибулярный синдром, синдром паркинсонизма, спинальные синдромы, рецидивирующую транзиторную глобальную амнезию, невропатии и миопатии [2, 7, 9, 10].
Самым ранним проявлением ЦАДАСИЛ в европейских странах считается мигрень (может возникать в возрасте до 20 лет) [6, 11]. Несколько позднее (в среднем в возрасте от 20 до 30 лет) появляются изменения белого вещества по данным магнитно-резонансной томографии (МРТ) головного мозга, а затем (в среднем в 40–59 лет) развиваются инсульты с очаговой симптоматикой и когнитивная (прежде всего регуляторная) дисфункция (средний возраст манифестации – 50–59 лет) [12]. К «атипичным» фенотипам относят вариант с легкой выраженностью церебральной микроангиопатии и отсроченной клинической манифестацией; так, описаны пациенты с ЦАДАСИЛ, у которых первый инсульт развился в возрасте старше 80 лет [4, 13, 14].
Наиболее характерными МРТ признаками ЦАДАСИЛ служат множественные лакунарные инсульты и постинсультные кисты, симметричная гиперинтенсивность перивентрикулярного белого вещества головного мозга на Т2-взвешенных изображениях (Т2-ВИ) с частым вовлечением передних отделов височных долей и наружной капсулы [15]. Нередко отмечаются очаги ишемии в области мозолистого тела (не характерные для микроангиопатий иной этиологии) и единичные микрокровоизлияния [15, 16].
Диагностику ЦАДАСИЛ затрудняет фенотипическая гетерогенность этой патологии, проявляющаяся в большом разнообразии клинической симптоматики и нейровизуализационных изменений [3, 4]. Разнообразию проявлений ЦАДАСИЛ способствуют этническая принадлежность и различия в характере мутации в гене NOTCH3 [4].
Установлено, что у пациентов из стран Восточной Азии (таких как Корея, Япония и Китай) по сравнению с пациентами из стран Европы симптомы ЦАДАСИЛ возникают в более позднем возрасте, чаще отмечаются транзиторная ишемическая атака (ТИА), ишемический инсульт, внутримозговые кровоизлияния и когнитивные нарушения, но реже встречаются мигрень и психические расстройства [4, 5, 17, 18]. Вовлечение в патологический процесс переднего полюса височной доли при ЦАДАСИЛ чаще наблюдается у пациентов в Европе, чем в странах Азии [18].
Клинические особенности ЦАДАСИЛ могут определяться и характером мутации [4]. Так, Nakamura T. et al. (2005) отметили связь мутации S180C в гене NOTCH3 с развитием зрительных галлюцинаций и феноменом антиципации, проявившимся в виде более раннего возраста развития инсульта в каждом последующем поколении японской семьи с ЦАДАСИЛ [19]. Тип мутации может влиять и на степень вовлечения в патологический процесс височной доли [20]. Установлено также, что инсульт при ЦАДАСИЛ развивается раньше (в среднем на 12 лет), а объем поражения белого вещества, по данным МРТ, больше при мутациях в одном из первых шести кодирующих EGFrs экзонов гена NOTCH3, чем при мутациях, изменяющих другие экзоны EGFrs [4, 21]. На основании такого рода данных была предложена гипотеза «эффекта положения мутации NOTCH3» [4, 21]. С другой стороны, ряд исследований свидетельствует об отсутствии связи между типом мутации в гене NOTCH3 и клинической симптоматикой ЦАДАСИЛ [6, 22].
Тяжесть клинических проявлений ЦАДАСИЛ находится также под влиянием негенетических факторов, связанных с воздействиями внешней среды и образом жизни. Такие классические факторы сердечно-сосудистого риска, как курение, артериальная гипертензия, сахарный диабет и гиперлипидемия у пациентов с ЦАДАСИЛ, приближают сроки развития первого инсульта и ускоряют прогрессирование когнитивных расстройств [2, 7, 23].
Целью нашей работы стало описание трех случаев ЦАДАСИЛ в двух соседних поколениях одной семьи для демонстрации фенотипической вариабельности данной патологии и повышения врачебной настороженности в ее отношении.
Ниже приводится описание трех членов семьи с ЦАДАСИЛ. У каждого пациента было получено подписанное информированное согласие на проведение обследования и публикацию его результатов без указания имени. Исследование одобрено локальным этическим комитетом ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Известно, что мать пробанда (пациентки Н.) перенесла три эпизода нарушения мозгового кровообращения, которые стали причиной ее инвалидизации в 53 года и смерти в возрасте 56 лет. Указания на повторные инсульты в анамнезе и признаки аутосомно-доминантного типа наследования в родословной (рис. 1) позволяют считать вероятным наличие ЦАДАСИЛ у матери пациентки Н. Однако сведений о ее медицинском обследовании нами не было получено, и далее мы приводим лишь данные о пробанде и ее сыновьях, т.е. тех трех больных членах семьи, которые находились под нашим наблюдением.
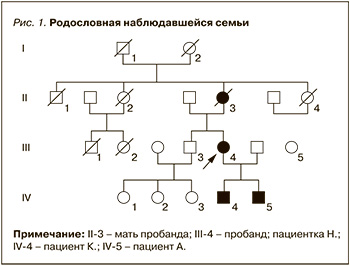
Пациентка Н., 49 лет (1974 г.р.), пробанд. Родилась на Курильских островах; имеет среднее специальное образование.
Пациентка Н. впервые обратилась к неврологу 12 лет назад (в 2011 г.) с жалобами на общую слабость, головокружение, неустойчивость при ходьбе, легкую слабость и онемение в левых конечностях. Наличие головных болей на тот момент и в предшествующие годы отрицала. МРТ головного мозга выявила множественные очаги в белом веществе лобных, теменных, височных долей, перивентрикулярном и субкортикальном белом веществе. Лечилась у невролога с диагнозом «рассеянный склероз». Периодически отмечала ухудшение состояния в виде нарастания шаткости походки.
По данным ежегодно повторявшейся МРТ головного мозга за период с 2011 по 2016, отмечалось появление новых очагов (по своим признакам соответствовавшим демиелинизации) в лобных, теменных, затылочных долях обоих полушарий, мозолистом теле, мозжечке. В 2016 г. впервые были описаны изменения в белом веществе передних отделов височных долей и лакунарные кисты в субкортикальных отделах больших полушарий, однако пациентка продолжала наблюдаться у неврологов с диагнозом «рассеянный склероз». Ухудшение произошло летом 2022 г., когда на фоне психического стресса почувствовала слабость в правой стопе. Самостоятельно выполнила МРТ головного мозга, по данным которой на фоне ранее имевшихся изменений был выявлен лакунарный очаг острой ишемии в левой лобной доле. Была госпитализирована в региональный сосудистый центр.
Оценка по Шкале инсульта национального института здоровья (NIHSS) при поступлении составляла 2 балла. Неврологический дефицит был представлен легким монопарезом в правой ноге, который полностью регрессировал через 10 дней. В этот период был впервые заподозрен ЦАДАСИЛ. В ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова» методом прямого автоматического секвенирования пациентке был проведен частичный анализ гена NOTCH3 (синдром ЦАДАСИЛ, аутосомно-доминантный тип наследования, NM_000435.3). Исследованы 2, 3, 4, 5, 6 экзоны данного гена и прилежащие интронные области. В экзоне 4 обнаружен вариант c.566A>G (p.Tyr189Cys) в гетерозиготном состоянии, описанный в международной базе мутаций человека HGMD как патогенный (CM042442).
Пациентка осмотрена нами повторно в марте 2023 г. На момент осмотра она была трудоспособна, активных жалоб не предъявляла, наличие головных болей отрицала.
В неврологическом статусе определялся легкий центральный левосторонний прозопарез, оживление сухожильных рефлексов, двусторонний симптом Бабинского, легкая интенция при выполнении координаторных проб, легкая дисбазия. Оценка функций по Монреальской шкале когнитивных функций (МоСа) составила 21 балл, что указывало на умеренные когнитивные расстройства (деменция отсутствовала, поскольку у больной сохранялась независимость от посторонней помощи в повседневной жизни).
Характер ошибок при выполнении заданий МоСА свидетельствовал о преобладании нейродинамических нарушений и нарушений регуляторных функций в виде ухудшения произвольной регуляции деятельности, трудностей инициации выполнения заданий и переключения внимания с одного задания на другое, снижения беглости речи, общей замедленности и истощаемости психических процессов, нарушения активного воспроизведения материала из памяти при эффективности семантического опосредования и сохранности узнавания. Отмечалась сохранность зрительно-пространственных функций, номинативной функции речи, счета. Оценка по субъективной шкале оценки астении (МFI-20) указывала на наличие астенического синдрома. Показатель шкалы депрессии Бека соответствовал умеренной выраженности синдрома депрессии (табл.).
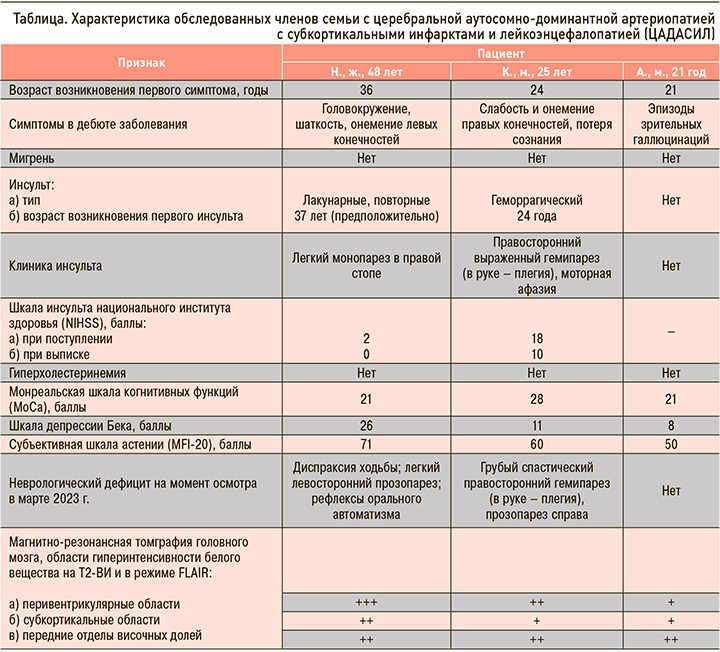
Таким образом, клиническими особенностями заболевания у Н. являлись: манифестация заболевания с легких, периодически нараставших и затем регрессировавших координаторных и двигательных нарушений; отсутствие цефалгического синдрома на всех этапах болезни; развитие лакунарного инсульта с легким и быстро регрессировавшим неврологическим дефицитом через 11 лет после начала заболевания; медленное нарастание когнитивных нарушений, не достигших степени деменции к 49-летнему возрасту. Нейровизуализационные изменения головного мозга (рис. 2а, 2б) имели сходство с таковыми при рассеянном склерозе (за исключением изменений в передних отделах височных долей), что во многом способствовало ошибочной диагностике последнего вплоть до момента развития у пациентки инсульта.
Пациент К., 25 лет (1998 г.р.), старший сын пациентки Н. Родился от первой беременности, в срок. Рос и развивался соответственно возрасту. Закончил 9 классов средней школы, дальнейшего образования не получил. Успеваемость во время обучения была средней. В детском возрасте проблем со здоровьем не имел, неврологами не наблюдался. После школы окончил курсы по вождению и стал работать водителем-дальнобойщиком. Заболел остро год назад (01.04.2022), когда приехал из рейса продолжительностью 2 сут, в течение которых, со слов больного, «практически не спал». Остро развились слабость в правой руке и ноге, нарушение речи и потеря сознания. Был госпитализирован в региональный сосудистый центр. Компьютерная томография (КТ) головного мозга выявила геморрагический инсульт с формированием внутримозговой гематомы в области базальных ядер слева, прорывом крови в желудочковую систему и дислокацией срединных структур головного мозга. Сосудистых мальформаций по данным КТ-ангиографии обнаружено не было.
В неврологическом статусе при поступлении отмечались правосторонняя гемиплегия и эфферентная моторная афазия, центральный прозопарез. Оценка выраженности неврологического дефицита по шкале NIHSS составила 18 баллов. В остром периоде инсульта отмечался регресс неврологического дефицита, количество баллов по NIHSS при выписке равнялось 10 баллам.
До инсульта К. на головные боли не жаловался. После перенесенного инсульта у пациента стали возникать двусторонние головные боли давящего и сжимающего характера в лобной, височной и теменной областях, имевшие слабую интенсивность (3 балла по визуально-аналоговой шкале), возникавшие 1–2 раза в неделю и продолжавшиеся до 4–5 ч. Анальгетики не принимал.
Пациент был осмотрен в марте 2023 г. В неврологическом статусе отмечался легкий центральный прозопарез справа, правосторонний выраженный спастический гемипарез (в руке – плегия с формированием сгибательной контрактуры в суставах кисти, в ноге – снижение силы до 3–4 баллов в проксимальных и до 2 баллов в дистальных отделах, правосторонняя гемигипестезия). Когнитивные функции соответствовали уровню образования; оценка по МоСА с поправкой на образовательный уровень составила 27 баллов, т.е. находилась в пределах нормальных значений. Результаты применения опросника MFI-20 и шкалы депрессии Бека указывали на признаки легкой депрессии и наличие астенического синдрома, соответственно (см. табл.).
На МРТ головного мозга (29.05.2022) определялись кистозно-глиозные изменения в области базальных ядер слева, а также множественные сливные гиперинтенсивные очаги в белом веществе лобных, теменных, полюсах височных долей (см. рис. 2в, 2г). Таким образом, у пациента К. синдром ЦАДАСИЛ дебютировал геморрагическим инсультом с грубым неврологическим дефицитом. Обращало на себя внимание отсутствие головной боли до манифестации инсульта, а также отсутствие когнитивных нарушений на фоне выраженных нейровизуализационных изменений головного мозга.
Пациент А., 21 год (2002 г.р.), младший сын пациентки Н. Родился в срок от второй беременности. Получил среднее специальное образование, работает парикмахером. Курит до 20 сигарет в день. На момент обследования считал себя здоровым, активных жалоб не предъявлял. Однако при расспросе сообщил о том, что за прошедший год у него дважды на фоне очень сильного утомления отмечались эпизоды зрительных галлюцинаций. Во время этих эпизодов пациент замечал большое «черное пятно», которое открывало дверь в комнату, приближалось к нему и вставало рядом. В эти минуты он отмечал общую слабость (вплоть до обездвиженности) и тревогу, хотя осознавал, что видимое им «пятно» в реальности не существует. Описанные нарушения сохранялись в течение 8–10 мин, после чего проходили бесследно.
Пациент осмотрен нами в марте 2023 г. В неврологическом статусе очаговой неврологической симптоматики не определялось. Оценка по шкале МоСа составила 22 балла, что свидетельствовало о наличии умеренных когнитивных нарушений (поскольку ограничений жизнедеятельности не было, говорить о деменции было неправомерно). Характер допускавшихся ошибок при выполнении заданий МоСА свидетельствовал о преимущественной регуляторной дисфункции, что проявлялось в ухудшении программирования и саморегуляции произвольной деятельности, трудностях вхождения в задания, поддержания и переключения внимания, снижении беглости речи, умеренном снижении возможностей обобщения и критики при сохранности зрительно-пространственных функций, номинативной функции речи и счета.
Применение соответствующих шкал указало на наличие астенического синдрома при отсутствии признаков депрессии (см. табл.). Учитывая отягощенный наследственный анамнез, пациенту было предложено провести МРТ головного мозга. На МРТ (10.03.2023) в белом веществе лобных, теменных и передних отделах височных долей юкстакортикально, субкортикально и перивентрикулярно были обнаружены множественные гиперинтенсивные сигналы на Т2-ВИ и FLAIR размерами 0,2–1,8 см (рис. 2д, 2е). Поскольку имелись указания на эпизоды галлюцинаций, был также проведен шестичасовой мониторинг электроэнцефалограммы (ЭЭГ-мониторинг), который эпилептиформной активности не выявил.
Таким образом, у пациента А. имелись умеренные когнитивные нарушения преимущественно дисрегуляторного типа, возникшие на фоне выраженных симметричных изменений белого вещества, вовлекавших в том числе передние отделы височных долей.
ОБСУЖДЕНИЕ
Анализ истории болезни и результатов обследования трех пациентов из двух соседних поколений описанной семьи выявил как сходство, так и индивидуальные различия проявлений ЦАДАСИЛ.
Общей особенностью клинической симптоматики у всех трех пациентов стало отсутствие мигрени, характерной для ЦАДАСИЛ. У двух пациентов не было не только мигрени, но и других типов головной боли, а у пациента К., старшего сына пробанда, цефалгия появилась только после развития геморрагического инсульта. По характеру она соответствовала частой эпизодической головной боли напряжения, хотя с учетом перенесенного инсульта не могла быть квалифицирована как первичная головная боль.
Головная боль считается самым частым начальным симптомом ЦАДАСИЛ: в странах Европы у 22–77% больных с этой патологией отмечается мигрень (как правило, мигрень с аурой), при этом описаны и случаи головной боли напряжения [4, 8, 12, 17, 24, 25]. В ряде случаев головная боль возникает лишь после развития острого нарушения мозгового кровообращения, как это произошло у пациента К. [17, 24].
У пациентов из стран Восточной Азии мигрень в клинике ЦАДАСИЛ встречается значительно реже [17]. В связи с этим представляет интерес тот факт, что мать пациентки Н. и она сама родились на Дальнем Востоке, т.е. в азиатской части России, хотя точных сведений о национальной принадлежности предшествовавших поколений этой семьи нам получить не удалось.
Отсутствие головной боли при ЦАДАСИЛ у наблюдавшихся пациентов нельзя объяснить характером обнаруженной мутации в 4-м экзоне гена NOTCH3 (p.Tyr189Cys), поскольку миссенс-мутация, приведшая к аминокислотной замене тирозина на цистеин в положении 189 в полипептидной цепи EGFrs белка рецептора NOTCH3, была ранее описана у трех больных с ЦАДАСИЛ, страдавших мигренью [26]. Этот факт согласуется с мнением ряда авторов об отсутствии связи между типом патогенной мутации в гене NOTCH3 и наличием головной боли [22].
Другая общая особенность всех описанных пациентов – наличие характерных для ЦАДАСИЛ изменений на МРТ головного мозга в виде симметричных зон гиперинтенсивного на Т2-ВИ сигнала в перивентрикулярном белом веществе и передних отделах височных долей.
Фенотипическая вариабельность ЦАДАСИЛ в описанной семье проявилась, во-первых, в различиях типа и возрасте возникновения инсультов. У пациентки Н. с 36-летнего возраста отмечались легкие повторные ишемические лакунарные инсульты (это следует из анамнеза и результатов повторных МРТ головного мозга, хотя формально инсульт был документирован лишь в ее 48 лет). У ее старшего сына развился тяжелый геморрагический инсульт, и произошло это в 24 года, т.е. в более молодом возрасте. Геморрагический инсульт в клинке ЦАДАСИЛ описан, хотя и относится к атипичным проявлениям [27]. Так, Palazzo P. et al. в 2021 г., проанализировав собственные наблюдения и публикации 1997–2019 гг., обнаружили 52 описания случаев развития нетравматического внутримозгового кровоизлияния у больных с ЦАДАСИЛ, при этом внутримозговая гематома в 65% случаев локализовалась в глубинных структурах головного мозга [10]. Развитию внутримозгового кровоизлияния при ЦАДАСИЛ способствуют артериальная гипертония и прием антитромботических препаратов [10, 27]. У 21-летнего больного А. клинически явных инсультов не было, но указания на наличие у него в анамнезе двух эпизодов сложных зрительных галлюцинаций могут с известной долей вероятности быть расценены как атипичные признаки острых нарушений мозгового кровообращения, поскольку такого рода галлюцинации описаны у больных с инсультом [28].
Фенотипическая вариабельность ЦАДАСИЛ заключалась также в существенном различии тяжести когнитивных нарушений у членов семьи.
Когнитивные расстройства у пробанда в возрасте 48 лет имели умеренную выраженность, проявляясь преимущественно в виде регуляторной дисфункции, а у ее старшего 25-летнего сына познавательные функции были еще сохранны. Такое соотношение между возрастными периодами и степенью когнитивного снижения считается для ЦАДАСИЛ типичным [4]. Однако у пациента А., младшего сына пробанда, уже в 20 лет выявлялись умеренные, преимущественно дисрегуляторные когнитивные нарушения, по степени выраженности соответствовавшие тем изменениям, которые у его матери были обнаружены в возрасте 48 лет.
Раннему когнитивному снижению у младшего сына пробанда могло способствовать курение, негативное влияние которого при ЦАДАСИЛ известно [2, 23]. В то же время нельзя полностью исключить и феномене антиципации, ранее описанный при этом заболевании [19].
Фенотипическая вариабельность затрудняет своевременную диагностику ЦАДАСИЛ, как это произошло с пробандом. Ошибочный диагноз рассеянного склероза у больных с ЦАДАСИЛ отнюдь не редкость [29, 30]. Этому способствует сходство нейровизуализационных изменений в головном мозге при ЦАДАСИЛ и рассеянном склерозе [16, 29].
Наряду с рассеянным склерозом дифференциальный диагноз ЦАДАСИЛ проводится с церебральной гипертонической микроангиопатией, другими наследственными формами церебральной болезни мелких сосудов (CARASIL, CARASAL и др.), церебральными васкулитами, нейроинфекциями, митохондриальной патологией (MELAS), метаболическими лейкоэнцефалопатиями, рассеянным склерозом [8].
Предложен ряд скрининговых шкал для оценки вероятности наличия у больного ЦАДАСИЛ путем анализа клинической симптоматики и данных нейровизуализации [7]. Активно изучаются серологические биомаркеры ЦАДАСИЛ [4]. Однако надежная диагностика этого заболевания в настоящее время требует проведения молекулярно-генетического исследования либо биопсии кожи. Подтверждает диагноз мутация в 2–24-м экзонах гена NOTCH3, изменяющая число цистеиновых остатков в одном из 34 повторов EGFrs белка NOTCH3. Биопсию кожи рекомендуется выполнять в случаях, когда молекулярно-генетическое исследование указывает на мутацию неопределенного значения. Диагноз ЦАДАСИЛ верифицируется при обнаружении в биоптате характерных гранулярных осмиофильных включений по данным электронной микроскопии и/или соответствующих изменений при иммунногистохимическом окрашивании внеклеточного домена NOTCH3 [3].
Лечение больных ЦАДСИЛ включает воздействие на контролируемые факторы сердечно-сосудистого риска, прежде всего нормализацию артериального давления, а также отказ от курения, что и было строго рекомендовано младшему сыну пациентки Н.
Перенесшим инсульт пациентам (в нашем случае пациентке Н. и ее старшему сыну) назначаются дезагреганты. В связи со склонностью к формированию церебральных микрокровоизлияний у больных ЦАДАСИЛ дезагреганты до момента развития ишемического инсульта не используются [3]. Статины для первичной и вторичной профилактики инсульта при ЦАДАСИЛ назначают лишь в случаях гиперхолестеринемии [3]. Пациентке Н. и ее сыну они не были рекомендованы, поскольку нарушения липидного обмена у них выявлялись.
Ограничением нашей работы стало то, что молекулярно-генетическое тестирование было проведено лишь пробанду, поскольку сыновья на данный период времени отказались от этого исследования. Диагноз ЦАДАСИЛ сыновьям пробанда был установлен с учетом характерной для этого заболевания клинической картины и признаков его аутосомно-доминантного тип наследования. В будущем планируется продолжить наблюдение за описанными пациентами с возможным выполнением генетического исследования.
ЗАКЛЮЧЕНИЕ
Высокая фенотипическая вариабельность ЦАДАСИЛ свойственна даже больным из соседних поколений одной семьи. Гетерогенность клинических проявлений ЦАДАСИЛ создает предпосылки для запоздалой диагностики этой патологии. Врачебная настороженность в отношении ЦАДАСИЛ у лиц молодого и среднего возраста с ишемическим инсультом и когнитивным снижением должна присутствовать во всех случаях, в том числе и при отсутствии у пациентов головной боли.



