Медицинские и социальные последствия заболеваний опорно-двигательного аппарата, в том числе остеоартрит (ОА) коленного сустава, вносят значимый вклад в снижение качества жизни пожилого населения всех стран [1]. ОА коленного сустава – заболевание, высоко ассоциированное с возрастом, которое приводит к инвалидизации, психологической дезадаптации пациентов, особенно в пожилом возрасте [2–4]. Увеличение ожидаемой продолжительности жизни закономерно сопровождается повреждением опорно-двигательного аппарата дегенеративно-дистрофического характера, включая ОА коленного сустава [5, 6]. Наличие болевого синдрома, ограничения подвижности и нарушения функций являются наиболее значимыми факторами для пациентов с ОА коленного сустава, влияющими на психологическое благополучие, и требуют своевременной коррекции.
Рост численности пожилого населения создает предпосылки для здравоохранения в отношении потребности оперативно пересматривать систему оказания медицинской помощи, в том числе пациентам с ОА. Тем самым актуализируется необходимость в проведении клинических исследований с учетом реальной клинической практики. На основе таких исследований возможно формирование алгоритмов ведения больных ОА, в которых учитывается наличие сопутствующей патологии, включая не только сердечно-сосудистые заболевания, но также сахарный диабет (СД), хроническую болезнь почек (ХБП), патологию глаз, предстательной железы, желудочно-кишечного тракта, болезни Паркинсона и анемии. Совокупность заболеваний, имеющихся в анамнезе у больных ОА, подразумевает постоянную медикаментозную поддержку и прием лекарственных средств (ЛС) в соответствии с клиническими рекомендациями и стандартами по соответствующему профилю. В свою очередь, лечение ОА подразумевает целый комплекс лечебно-реабилитационных мероприятий, в том числе применение нестероидных противовоспалительных препаратов (НПВП), особенно при выраженном болевом синдроме [7]. Назначение НПВП (выбор, доза, длительность применения) зависит от показаний, представленных в инструкции к препарату, и должно соответствовать Российским клиническим рекомендациям по оптимизации рациональных подходов к назначению НПВС [8]. Известны риски развития побочных эффектов НПВП [9, 10], в связи с чем необходимо учитывать индивидуальные характеристики пациента, включая имеющиеся сопутствующие заболевания.
Целью нашего исследования стало изучение распространенности сопутствующих заболеваний у пациентов с ОА коленного сустава в возрасте старше 60 лет.
МАТЕРИАЛ И МЕТОДЫ
Исследование, зарегистрированное как наблюдательная программа «Распространенность сопутствуЮщих забоЛеваний у пациентов с остеоАртритом коленного сустава в возрасте старше 60 лет» (ЮЛА), проведено в период с октября 2017 по март 2018 г. на базе амбулаторно-поликлинических учреждений городов Самары, Воронежа, Липецка, Нижнего Новгорода с последовательным включением больных, обратившихся впервые в данном календарном году по поводу болевого синдрома в области коленного сустава
Критерии включения в исследование:
- амбулаторные пациенты с верифицированным диагнозом ОА коленных суставов в соответствии с критериями, опубликованными R. Altman и соавт. [10], и объективной информацией, подтвержденной данными автоматизированной системы АИС «Поликлиника»;
- возраст ≥60 лет;
- добровольное информированное согласие на включение в исследование и обработку персональных данных.
Критерии невключения:
- онкологические заболевания в анамнезе;
- системные аутоиммунные заболевания.
 На этапе скрининга обследованы 856 пациентов, из которых критериям включения/невключения отвечали 500 больных. Анализировались окончательные результаты 499 пациентов, один пациент выбыл из исследования ввиду ненадлежащего оформления информированного согласия. Все данные вносились в электронные индивидуальные регистрационные карты для каждого больного с указанием клинико-демографических (пол, возраст, индекс массы тела, сопутствующие заболевания, включая анамнестические сведения о болях в спине), инструментальных (уровень офисного артериального давления – АД, частота сердечных сокращений – ЧСС) данных, а также информации о принимаемых лекарственных средствах (ЛС). С целью уточнения характера боли и оценки достоверности наличия невропатической боли применен опросник DN4, состоящий из 10 пунктов. В результате анкетирования и анализа определяли суммарный балл (от 0 до 10). При сумме баллов ≥ 4 боль оценивали как невропатическую.
На этапе скрининга обследованы 856 пациентов, из которых критериям включения/невключения отвечали 500 больных. Анализировались окончательные результаты 499 пациентов, один пациент выбыл из исследования ввиду ненадлежащего оформления информированного согласия. Все данные вносились в электронные индивидуальные регистрационные карты для каждого больного с указанием клинико-демографических (пол, возраст, индекс массы тела, сопутствующие заболевания, включая анамнестические сведения о болях в спине), инструментальных (уровень офисного артериального давления – АД, частота сердечных сокращений – ЧСС) данных, а также информации о принимаемых лекарственных средствах (ЛС). С целью уточнения характера боли и оценки достоверности наличия невропатической боли применен опросник DN4, состоящий из 10 пунктов. В результате анкетирования и анализа определяли суммарный балл (от 0 до 10). При сумме баллов ≥ 4 боль оценивали как невропатическую.
Все пациенты отвечали на вопрос о самостоятельном приеме (без назначений врача) обезболивающих препаратов (НПВП) в течение последних 6 мес, предшествующих периоду включения в исследование, по любой причине. Врач регистрировал информацию о назначенных ЛС в связи с установленным диагнозом: остеоартрит коленного сустава по Международной классификации болезней 1-го пересмотра (М 17.0, М 17.1, М 17.9).
Полученные данные обрабатывали c помощью стандартной программы Microsoft Excel и пакета статистических программ Statistiсa for Windows, v. 6.0. Описание нормально распределенных количественных признаков приведено с указанием среднего значения признака и среднего квадратичного отклонения (M±SD). Для анализа использована описательная статистика с применением параметрического t-критерия Стьюдента. Для описания признаков с распределением, отличным от нормального, указывали медиану, верхний (25-й) и нижний (75-й) квартили – Me [Q25; Q75]. Для сравнения независимых групп применяли однофакторный дисперсионный анализ (one-way ANOVA), для исследования связи между количественными признаками использовался ранговый коэффициент корреляции Спирмена (r). Различия между изучаемыми параметрами признавали статистически значимыми при p <0,05.
Расчет основных характеристик диагностических методов вели в соответствии требованиями CONSORT (CONSORT Group., 1996).
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом Самарского государственного медицинского университета.
Мы заявляем, что дизайн наблюдения и полученные данные соответствуют критериям оригинального исследования. В случае возникновения спорных вопросов мы готовы предоставить экспертам в полном объеме исходный материал и статистические расчеты. Все авторы гарантируют, что внесли существенный вклад в получение и анализ данных, их интерпретацию и готовы нести ответственность за все аспекты работы, а также гарантировать соответствующее рассмотрение и решение вопросов, связанных с точностью и добросовестностью при проведении исследования.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Общая характеристика и основные клинико-анамнестические параметры пациентов, включенных в исследование, представлены в табл. 1.
Следует отметить, что средняя длительность анамнеза ОА коленного сустава в представленной группе больных оставила 7,0±2,5 года. Пациенты имели опыт неоднократного обращения по поводу данного заболевания в лечебные учреждения, а также ранее получали лекарственную терапию, лечебную физкультуру и физиолечение.
При оценке болевого синдрома в коленном суставе показатель по визуальной аналоговой шкале (ВАШ) составил 55,5±12,5 мм. Нами установлены гендерные различия по уровню боли: так, у женщин (64,2±8,1 мм) показатель шкалы ВАШ статистически значимо (p=0,039) был выше, чем у мужчин (48,5±7,5 мм). При анализе основных характеристик болевого синдрома выявлено, что у большинства пациентов боль носит ноющий – 305 (61,1%) и ломящий характер – 307 (61,5%) больных, 172 (34,5%) пациента отметили стреляющий характер боли, 181 (36,3%) – жгучий и 43 (8,6%) – покалывающий. По результатам опросника DN4 у 156 (31,3%) больных определялся невропатический компонент боли с показателем 4,9±0,5 балла.
На вопрос исследователя: «Испытывали ли вы когда-либо ранее боль в нижней части спины?» 462 (92,5%) больных ответили положительно. У этих пациентов при сборе анамнеза отмечено, что давность болевого синдрома в нижней части спины составила 11,7±3,6 года, что статистически значимо (p=0,024) было выше, чем давность боли в коленном суставе и верифицированного диагноза ОА коленного сустава.
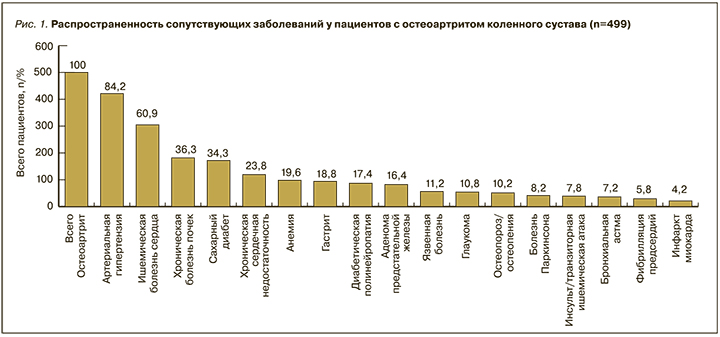
В отношении сопутствующей патологии была установлена высокая распространенность не только сердечно-сосудистых заболеваний, СД (34,3%) и ХБП (36,3%), но также диабетической полиневропатии (17,4%), язвенной болезни желудка (11,2%), хронического гастрита (18,8%), остеопороза/остеопении (10,2%), анемии (19,6%), болезни Паркинсона (8,2%), глаукомы (10,8%) и аденомы предстательной железы (8,2%). Данные по распространенности сопутствующих заболеваний, каждое из которых нуждается в постоянной медикаментозной поддержке, представлены на рис. 1.
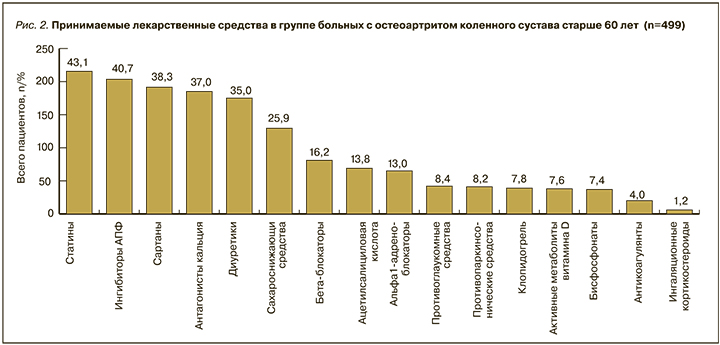
 Был проведен анализ ЛС, принимаемых пациентами на момент обращения в амбулаторно-поликлиническое учреждение. На рис. 2 подробно представлена информация о принимаемых больными в постоянном режиме препаратах на момент их обращения по поводу болей в коленном суставе. Наиболее высокий процент приходится на антигипертензивные средства (блокаторы кальциевых каналов – 37,0%, ингибиторы АПФ – 40,7%, сартаны – 38,3%), диуретики (35,0%), статины (43,0%), β-адреноблокаторы (16,2%), α-адреноблокаторы (13,0%), сахароснижающие (25,9%) препараты, что в целом отражает спектр имеющихся у больных ОА заболеваний, требующих медикаментозной коррекции. Следует отметить, что проведенный подробный анализ ЛС показывает, что все они были назначены в соответствии с клиническими рекомендациями и протоколами по профилю заболевания.
Был проведен анализ ЛС, принимаемых пациентами на момент обращения в амбулаторно-поликлиническое учреждение. На рис. 2 подробно представлена информация о принимаемых больными в постоянном режиме препаратах на момент их обращения по поводу болей в коленном суставе. Наиболее высокий процент приходится на антигипертензивные средства (блокаторы кальциевых каналов – 37,0%, ингибиторы АПФ – 40,7%, сартаны – 38,3%), диуретики (35,0%), статины (43,0%), β-адреноблокаторы (16,2%), α-адреноблокаторы (13,0%), сахароснижающие (25,9%) препараты, что в целом отражает спектр имеющихся у больных ОА заболеваний, требующих медикаментозной коррекции. Следует отметить, что проведенный подробный анализ ЛС показывает, что все они были назначены в соответствии с клиническими рекомендациями и протоколами по профилю заболевания.
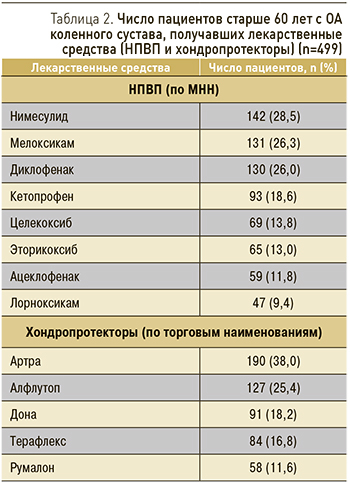
Далее мы проанализировали заполненные врачами данные пациентов, которым были назначены НПВП (по МНН) и хондропротекторы (по торговым наименованиям), представленные в табл. 2.
Наибольший процент назначений пришелся на диклофенак (26,0%), мелоксикам (26,3%) и нимесулид (28,5%). Однако стоит отметить, что в целом число назначаемых НПВС было больше (n=736), чем число пациентов, что свидетельствовало о включении в схемы терапии более 2 ЛС. Так, на одного пациента пришлось в среднем 1,5 назначенных НПВП. Это обстоятельство отягощает риски возможных негативных последствий с учетом имеющихся и сопутствующих заболеваний и уже принимаемых ЛС. Врачами в амбулаторно-поликлинических учреждениях в схемы терапии всем пациентам были включены хондропротекторы (как парентерально, так и перорально).
ОБСУЖДЕНИЕ
Многоцентровое исследование ЮЛА стало пилотным наблюдательным проектом, основной задачей которого было представить информацию о распространенности сопутствующих заболеваний в условиях реальной клинической практики у пациентов с ОА коленного сустава старше 60 лет.
Накопленные научные данные показывают, что ОА коленного сустава – заболевание неоднородное, характеризуется вариабельностью клинических фенотипов. Следует подчеркнуть, что за последние десятилетия термин фенотип изменился в своих коннотациях. Сегодня он применятся уже не только и не столько в отношении наследственных расстройств, сколько клинических проявлений, которые зависят от совокупности ряда факторов, способствующих пенетрации генетически детерминированного признака. Становится все более очевидным, что именно фенотип определяет различные ответы пациентов на лечение и исходы, наблюдаемые в реальной клинической практике [12, 13]. Имеются данные по гендерным особенностям, продемонстрированные в исследовании Е. Kriegova и соавт., где показаны статистически достоверные различия при иммунофенотипировании клеток синовиальной жидкости коленного сустава у мужчин и женщин [14].
Исследование различных фенотипов больного ОА представляет научный и клинический интерес [15]. В недавнем обзоре сенсибилизация боли, психологический дистресс, индекс массы тела (ИМТ), мышечная сила, воспаление и сопутствующая патология были связаны с клинически выраженными фенотипами [16]. В другом обзоре возраст, эстрогеновый статус, генетические факторы, компоненты метаболического синдрома, сывороточные биомаркеры определяли прогрессирование и клинические проявления ОА коленного сустава [17].
В отсутствии единого консенсуса относительно конкретных подтипов ОА наше исследование предполагает расширить представления о популяции пациентов с ОА коленного сустава, обращающихся в амбулаторно-поликлинические учреждения. Наши данные могут быть использованы в последующем для формирования критериев фенотипа ОА с учетом сопутствующей патологии, лекарственного анамнеза и наличия невропатического компонента боли. Мы поддерживаем мнение, что необходимо уделять внимание различным фенотипам ОА коленного сустава, так как пациенты по-разному могут реагировать на лечение [18]. Важно, что наличие таких характеристик, как интенсивность, длительность, механизм боли, включая невропатический компонент, в совокупности с сопутствующими заболеваниями, психоэмоциональным состоянием и когнитивным статусом больного ОА должны быть в приоритете.
Очевидно, наличие сопутствующих заболеваний имеет влияние на формирование механизмов боли у пациентов с ОА коленного сустава [19]. Более того, изменение паттерна боли также можно ожидать при изменении тех или иных параметров соматического статуса и прогрессировании любого из сопутствующих заболеваний [20]. В 2016 г. была предложена стратификации по профилю болевой чувствительности с проведением количественного сенсорного тестирования пациентов с ОА коленного сустава [21]. Установлено, что механизмы центральной сентицизации значимым образом влияют на характер, длительность и интенсивность болевого синдрома [22, 23].
Наше исследование показывает, что профиль больного ОА коленного сустава старше 60 лет сложный в связи с наличием сопутствующей патологией, принимаемыми ЛС и высокой потребностью в купировании болевого синдрома. Длительно не купирующийся болевой синдром является крайне неблагоприятным предиктором в отношении индивидуального прогноза у пациентов с ОА коленного сустава [24, 25]. В нашем исследовании показано, что высокий процент пациентов имеют не только высокий уровень боли по ВАШ, но и значимый процент невропатической боли. В совокупности это означает определенные трудности в определении тактики медикаментозной коррекции, что логично подразумевает не только назначение НПВП в длительной терапии, но и назначение антиконвульсантов.
Основная часть всех методов лечения ОА направлена на облегчение боли, и, хотя многие воззрения направлены на модификацию заболевания, до сих пор не представлены доказательства в отношении метода медикаментозной поддержки, направленного на уменьшение прогрессирования заболевания. Наше исследование, являясь одномоментным, не отвечает на этот вопрос, однако позволяет при описании фенотипа пациента с ОА коленного сустава в последующем принимать методологические решения на основе полученной информации. Независимо от используемых терминов, научные данные по регистрации различных биохимических, диагностических и клинических характеристик становятся все более важными в исследованиях ОА. Повышение осведомленности в условиях реальной клинической практики о потенциальной значимости фенотипов ОА с учетом качественного анализа сопутствующих заболеваний и принимаемых ЛС поможет сформировать обоснованную и относительно безопасную схему терапии.
ЗАКЛЮЧЕНИЕ
Многоцентровое исследование ЮЛА, проведенное на базе амбулаторно-поликлинических учреждений четырех регионов РФ (города Самара, Нижний Новгород, Воронеж и Липецк), показало, что пациенты старше 60 лет с ОА коленного сустава имеют широкий спектр сопутствующих заболеваний и принимаемых по их поводу лекарственных средств.
В исследуемой когорте больных уровень боли был высоким, что при определении тактики лечения требовало купирование болевого синдрома, в том числе с помощью НПВП. Более чем у 1/3 пациентов имела место невропатическая боль, в 92,5% случаев в анамнезе пациенты отмечали наличие боли в нижней части спины с давностью болевого синдрома 11,7±3,6 года, что статистически значимо превышало давность боли в коленном суставе и верифицированного диагноза ОА коленного сустава.
Во взаимосвязи клинических и анамнестических данных мы предлагаем для обсуждения дегенеративно-дистрофический фенотип больного ОА старше 60 лет с высокой распространенностью сопутствующих заболеваний и широким спектром принимаемых ЛС с целью формирования методологии принятия врачом обоснованного решения по тактике ведения таких пациентов.
Мы признаем, что наше исследование имело ряд ограничений, в первую очередь ввиду изучения небольшой выборки, что не позволяет в полной мере сформулировать популяционные выводы. В ходе исследования нами самостоятельно не проводилась верификация всех имеющихся диагнозов и не проводилось их инструментальное подтверждение. Изучение распространенности нозологий оценивалось по данным первичной медицинской документации, в том числе информации в автоматической информационной системе (АИС) «Поликлиника» (отчетная форма 012/у). Следует отметить, что форма федерального статистического наблюдения № 12 «Сведения о числе заболеваний, зарегистрированных у пациентов, проживающих в районе обслуживания медицинской организации» составляется всеми амбулаторно-поликлиническими учреждениями, информация передается в Федеральную службу государственной статистики, что в целом повышает достоверность полученных нами результатов. Мы сочли возможным представить полученные данные, так как считаем, что актуально дальнейшее изучение и обсуждение фенотипов пациентов с ОА коленного сустава у пациентов старшей возрастной группы.



