АКТУАЛЬНОСТЬ
Хронический гастрит (ХГ) занимает центральное место среди заболеваний желудка, а его проявление в виде атрофического гастрита является звеном в цепочке метаморфоз эпителия слизистой, ведущих к развитию рака желудка (РЖ) [1]. С 2018 г. РЖ занимает четвертое место в структуре онкологической заболеваемости, при этом выступая второй причиной смерти от всех видов рака в мире. В большинстве стран, в том числе и России, показатели смертности от РЖ приближаются к показателям заболеваемости им, но пребывают в сильной зависимости от ранней диагностики и успеха лечения заболевания. Все это делает острой и актуальной проблему атрофического гастрита как клинико-морфологического маркера повышенного риска развития РЖ [2].
В нашей стране инфицированность населения Helicobacter pylori (Н. pylori) существенно превышает таковую в других странах, достигая 50–75% [3]. По этой причине и восприятие проблемы атрофического гастрита как патологического фона для развития РЖ в России существенно острее. Отметим, что эта проблема не иллюзорна и для стран с гораздо более низкой распространенностью хелиобактериоза, так как механизм и пути гастроканцерогенеза в контексте влияния одного и того же этиологического фактора (в данном случае Н. pylori) универсальны. В Республике Ингушетия долгое время не уделялось должного внимания этой нозологии, что было связано в первую очередь с недостаточным оснащением лечебно-профилактических учреждений и нехваткой врачей-гастроэнтерологов [4].
ВЫЯВЛЕНИЕ HELICOBACTER PYLORI КАК ЭТАП ДИАГНОСТИКИ АТРОФИЧЕСКОГО ГАСТРИТА
На сегодняшний день важным диагностическим методом служит выявление Н. pylori как основного этиологического фактора развития атрофического гастрита. Это необходимо для его идентификации, количественного определения инфицированности, оценки эффекта от проведенного антихеликобактерного лечения [5]. В настоящее время доступны морфологический, уреазный, дыхательный, иммунологический методы, а также бактериологический метод с посевом на среды и иммуноморфологический анализ на антигены Н. pylori.
Серологический метод состоит в выявлении IgG-антител к этому возбудителю, применяется для скрининга инфицированности населения Н. pylori в эпидемиологических исследованиях и не может использоваться для контроля полноты его эрадикации в результате проведенной антихеликобактерной терапии.
Культуральный (бактериологический) метод с посевом на среды применяется для определения чувствительности Н. pylori к антибиотикам. Данный метод инвазивен, и для его выполнения необходимо получение в ходе эндоскопического исследования биоптатов слизистой оболочки желудка. Метод обладает практически 100% специфичностью, но низкой чувствительностью (56–81%), нередко сопровождается ложноотрицательными результатами, что ограничивает его применение.
Морфологический метод используется для первичной диагностики инфицирования Н. pylori по биоптатам, полученным в ходе эндоскопического исследования. Чувствительность метода составляет 93–94%, а специфичность достигает 95%. К его недостаткам относят инвазивность, потребность в патоморфологической лаборатории и квалифицированном персонале, достаточно большая длительность ожидания результатов исследования, составляющая 5–7 дней.
Быстрый уреазный тест также проводится в ходе гастроскопии [6]. Основой этого теста, известного также как CLO-тест (Campylobacter-like organism test), является свойство Н. pylori выделять уреазу – фермент, катализирующий процесс преобразования мочевины в аммиак и углекислый газ. Биоптат слизистой оболочки желудка помещается в среду, содержащую мочевину и индикатор (феноловый красный). Преобразуя мочевину в аммиак, выделяемая контаминирующими биоптат бактериями Н. pylori уреаза повышает рН среды и меняет цвет среды с желтого (отрицательный тест) на красный (положительный). Скорость изменения окраски индикатора с желтой на ярко-красную зависит от уреазной активности, которая, в свою очередь, коррелирует с количеством бактерий. Чувствительность метода составляет 75–90%, а специфичность 90%, поэтому отрицательный результат теста не позволяет исключить инфекцию.
В настоящее время разработано и успешно применяется в клинической практике множество других быстрых уреазных тестов (HP-тест, CUT-тест, Campy-тест, Хеликотест-экспресс). 13С-уреазный дыхательный тест с использованием меченой мочевины (13С-мочевины), в которой атом углерода заменен на изотоп (13С), относится к неинвазивным и обладает очень высоким уровнем чувствительности (до 95%) и специфичности (95–100%). Помимо констатации факта наличия бактерий Н. pylori, метод позволяет получать количественную характеристику контаминации слизистой желудка этим патогеном, что особенно важно для оценки результата антихеликобактерной терапии и обоснованности вывода о достижении эрадикации. С целью контроля эффективности антихеликобактерного лечения тест проводят спустя 4 нед после окончания терапии антибиотиками.
Антигенный фекальный тест (стул-тест) основан на выявлении антигена Н. pylori в кале иммуноферментным методом [7]. Он применяется для первичной диагностики инфекции Н. pylori и контроля эффективности антихеликобактерной терапии, его специфичность и чувствительность превышают 95%. Простота, техническая доступность, отсутствие возрастных ограничений и скорость получения результатов позволяют широко использовать этот тест в клинической медицине.
Выбор метода идентификации Н. pylori регламентирован Маастрихтским консенсусом V, согласно которому основными тестами должны служить 13С-уреазный дыхательный тест и антигенный фекальный тест (стул-тест) [8].
ЭНДОСКОПИЧЕСКАЯ ДИАГНОСТИКА АТРОФИЧЕСКОГО ГАСТРИТА
Современная эндоскопия – это прежде всего электронная эндоскопия с возможностью применения режимов высокого разрешения (HD), осмотра в узком спектре света (NBI), в условиях увеличения изображения (ZOOM), аутофлуоресценции (AFI). Эндоскопическая картина АГ может быть стертой. Врач-эндоскопист должен подготовить полость желудка к осмотру с использованием пеногасителя (симетикона) и орошением поверхности слизистой желудка раствором муколитика (1% раствором N-ацетилцистеина) с последующим удалением содержимого путем его аспирации [9]. Следует обеспечить экспертный уровень осмотра с использованием всех технических возможностей получения изображения высокого качества. Соблюдение методичности осмотра с использованием адекватной инсуффляции воздуха и современных визуализационных технологий позволяет качественно исследовать поверхность слизистой оболочки всех анатомических отделов желудка, оценивать складчатость, толщину, цвет, сосудистый рисунок, особенности поверхности, характер ямок, очаговые изменения.
По сравнению с эндоскопией в белом свете без высокого разрешения (WLE) проведение исследования в белом свете в режиме высокого разрешения (HD-WLE) обеспечивает значительно лучшую визуализацию предраковых изменений слизистой оболочки [10]. Атрофичная слизистая оболочка желудка обычно характеризуется бледностью, подчеркнутым рисунком подслизистых кровеносных сосудов из-за своего истончения и уменьшения размеров складок. Складчатость слизистой по большой кривизне в отсутствие инсуффляции воздуха выглядит выпрямленной, с существенно меньшей, чем в неистонченной слизистой, «мозговидной» извитостью. Часто можно определить границу атрофичной слизистой оболочки.
Применение увеличительной эндоскопии и хромоэндоскопии в сочетании с методиками улучшенной визуализации (например, NBI) позволяет проводить более детальную оценку состояния слизистой оболочки желудка и архитектоники микрососудистой подслизистой сети. Технология ZOOM-эндоскопии в рутинной клинической практике доступна не везде. Лучшую дифференциацию патологических изменений слизистой оболочки по сравнению с HD-WLE обеспечивает опция ближнего фокуса HD-эндоскопов нового поколения.
Поскольку кишечная метаплазия (КМ) является основным признаком атрофического гастрита, врачи должны уметь распознавать ее эндоскопические признаки. Надежно идентифицировать КМ можно путем осмотра в белом свете с высоким разрешением (HD-WLE), чувствительность которого может быть повышена при NBI. При осмотре в белом свете с высоким разрешением локусы КМ у пациентов с хроническим атрофическим гастритом бывают представлены ребристым или трубчатым рисунком поверхности слизистой оболочки, выглядят слегка узловатыми и несколько возвышающимися над поверхностью «соседствующей» слизистой без означенных метапластических изменений кишечного типа. При узкоспектральном осмотре характерными признаками КМ выступают так называемые голубые гребни (LBC) и белые непрозрачные поля (WOF/WOS) [11]. «Голубые гребни» – это тонкие светло-голубые линии на поверхности эпителия, соответствующие щеточной кайме (микроворсинкам). В свою очередь, «белые непрозрачные поля» (или симптом белой непрозрачной субстанции) – это обнаруживаемые при рассеянном свете микроскопические липидные капли, накапливающиеся в межвазальном пространстве слизистой желудка при КМ. Важность выявления симптома белой непрозрачной субстанции подчеркивается установленным фактом: он обнаруживается в 70% случаев при аденокарциноме и в 30% при аденоме слизистой оболочки желудка.
Симптом мутной краевой полосы (marginal turbid band – MTB) зависит от присутствия в перешейках желудочных желез большого количества бокаловидных клеток [12]. Бокаловидные клетки – одна из разновидностей кишечного эпителия, обычно располагающегося на кишечных ворсинках поодиночке среди каемчатых энтероцитов, их основная функция – выработка слизи. При ряде патологических состояний бокаловидные клетки могут встречаться в тканях и органах, где они в норме отсутствуют. Наличие бокаловидных клеток в слизистой оболочке желудка считается важнейшим диагностическим признаком КМ: выявление симптома мутной краевой полосы, свидетельствующего о наличии не свойственных слизистой желудка бокаловидных клеток, – объективное визуальное доказательство наблюдаемой при атрофическом гастрите энтеролизации желудочных желез. Признаки LBC, WOF/WOS и MTB лучше всего поддаются визуализации при сочетанном использовании технологий увеличительной эндоскопии и узкоспектрального осмотра. По опубликованным результатам одного из метаанализов, чувствительность и специфичность характерного для КМ симптома «голубой гребень» составляют около 90%. Так называемые белые непрозрачные поля также служат важным маркером КМ, характеризующимся высокой специфичностью (100%; 95% доверительный интервал (ДИ): 85–100), но ограниченной чувствительностью (50%; 95% ДИ: 40–50).
Для адекватной оценки предраковых заболеваний желудка во время эндоскопии необходимо выполнение биопсии по меньшей мере из четырех точек: из антрального отдела и тела желудка по малой и большой кривизне (рис.). Биоптаты из тела и антрального отдела следует размещать в отдельные маркированные флаконы. Для определения тяжести атрофического гастрита и стратификации риска РЖ могут быть использованы системы гистопатологического стадирования (OLGA и OLGIM) [13]. В случае применения систем OLGA и OLGIM рекомендовано получение дополнительных биоптатов из угла желудка.
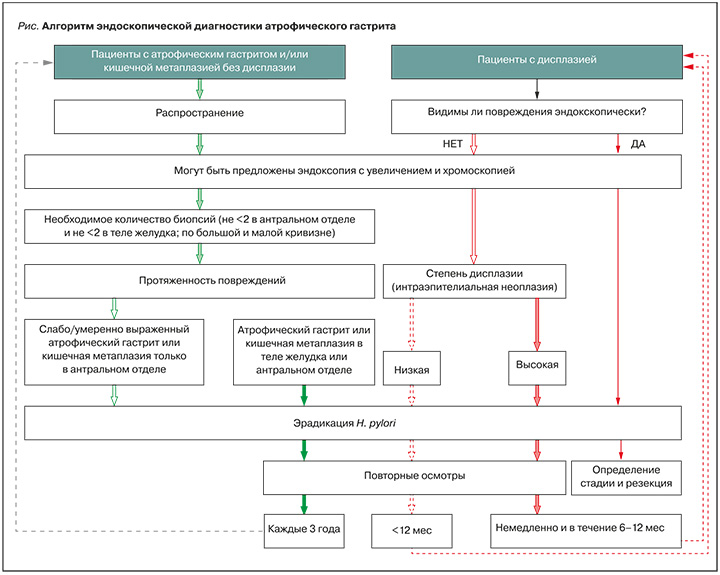
СВЯЗЬ АТРОФИЧЕСКОГО ГАСТРИТА С УРОВНЕМ ПЕПСИНОГЕНА
В последние годы все большую популярность получает метод исследования содержания в сыворотке крови пепсиногена I и пепсиногена II в качестве маркеров атрофии слизистой оболочки фундального и антрального отделов желудка.
Низкий уровень сывороточного пепсиногена I и/ или низкое значение соотношения пепсиногена I и II служат предикторами продвинутых стадий атрофического гастрита. Пациентам с низкими значениями сывороточного пепсиногена I рекомендовано проведение эзофагогастродуоденоскопии (ЭГДС), особенно в случае негативного результата серологического анализа на Н. pylori.
ДОСТУПНОСТЬ МЕТОДОВ ДИАГНОСТИКИ В ЛПУ РЕСПУБЛИКИ ИНГУШЕТИЯ
На данный момент наблюдается улучшение диагностики атрофического гастрита в Республике Ингушетия. Многие лечебно-профилактические учреждения региона оснащены необходимым оборудованием для своевременного выявления заболеваний желудка. По показаниям проводится ЭГДС со взятием биоптата и определением на Н. pylori. Открыты отделения гастроэнтерологического профиля в больницах региона, привлекаются специалисты узкого профиля. Вместе с тем все так же ощущается нехватка неинвазивных методов диагностики, которые доступны только в частных центрах республики, что затрудняет маршрутизацию, своевременную диагностику и лечение пациентов.
ЗАКЛЮЧЕНИЕ
В России инфицированность населения Н. pylori существенно выше по сравнению с другими странами. Это дополнительно актуализирует проблему своевременной верификации атрофического гастрита как патологического фона для развития РЖ. В рамках его диагностики необходимы как выявление Н. pylori, так и эндоскопическое исследование (с целью адекватной оценки предраковых заболеваний желудка) с биопсией по меньшей мере из четырех точек: из антрального отдела и тела желудка по малой и большой кривизне. Кроме того, пациентам с низким уровнем сывороточного пепсиногена рекомендовано проведение ЭГДС.
В Республике Ингушетия по причинам прежде всего инфраструктурного характера долгое время не уделялось должного внимания диагностике атрофического гастрита, однако на данный момент наблюдается очевидная тенденция к улучшению решения этой медицинской проблемы.



