ВВЕДЕНИЕ
В России сердечно-сосудистые заболевания (ССЗ) являются причиной смертности более чем в половине процентов случаев, при этом чаще всего пациенты умирают от ишемической болезни сердца (ИБС) [1]. Одна из важных кардиологических задач – поиск и изучение новых сердечно-сосудистых биологических маркеров, способных помогать в ранней диагностике ССЗ, служить лабораторным инструментом оценки эффективности проводимого лечения, выступать в качестве прогностического маркера неблагоприятных клинических исходов и значимого критерия стратификации риска [2].
В последние годы интерес ученых при изучении кардиометаболических заболеваний активно привлекает иризин (irisin) – миокин, о котором впервые сообщили Bostrom P. et al. в 2012 г. [3]. Он был назван в честь греческой богини Ириды –
вестницы богов [3]. Изначально иризин рассматривали как основное звено «браунинга» – процесса перехода белой жировой ткани (ЖТ) в бурую и бежевую [4].
Цель данного обзора литературы – анализ работ, посвященных исследованию иризина в роли диагностического и прогностического маркера при кардиометаболических заболеваниях.
МЕТОДОЛОГИЯ ПОИСКА ИСТОЧНИКОВ
В статье представлен обзор актуальных публикаций. Мы провели анализ литературных источников, включавший все релевантные статьи в базах данных PubMed, РИНЦ, MedLine, Google Scholar, Science Direct. При поиске публикаций использовались следующие ключевые слова: биологические маркеры, сердечно-сосудистые заболевания, иризин, biological markers, cardiovascular diseases, irisin.
БИОЛОГИЧЕСКИЕ АСПЕКТЫ ИРИЗИНА
Иризин представляет собой полипептид, состоящий из 112 аминокислот [4]. Иризин отщепляется от белка 5, содержащего домен фибронектина III типа (FNDC5), путем протеолиза при стимуляции PGC1-α (коактиватор PPARγ – рецептор, активирующий пролиферацию пероксисом), а затем секретируется в кровоток. Следует отметить, что протеолитический фермент, осуществляющий эту реакцию, в настоящее время остается неизвестным [4]. PGC1-α через активацию PPAR-γ повышает экспрессию термогенина, разобщающего белка 1 (UCP1), что приводит к усилению несократительного термогенеза и расхода энергии [4, 5]. Помимо скелетной мышечной ткани, иризин синтезируется и в других органах, содержащих мышечные ткани (сердце, язык, конечная часть пищеварительного тракта), а также в подкожной белой ЖТ и в меньшей степени в висцеральной белой ЖТ [4].
Известны несколько внутриклеточных сигнальных путей, с помощью которых ось FNDC5/иризин осуществляет свои биологические функции (рис. 1) [2, 6]. Основными путями, через которые иризин оказывает свое действие на «потемнение» белой ЖТ, нейронную дифференцировку и пролиферацию остеобластов, являются сигнальные пути MAPK (митоген-активируемая протеинкиназа) [6]. Существуют и некоторые другие сигнальные пути иризина [6] (рис. 2).
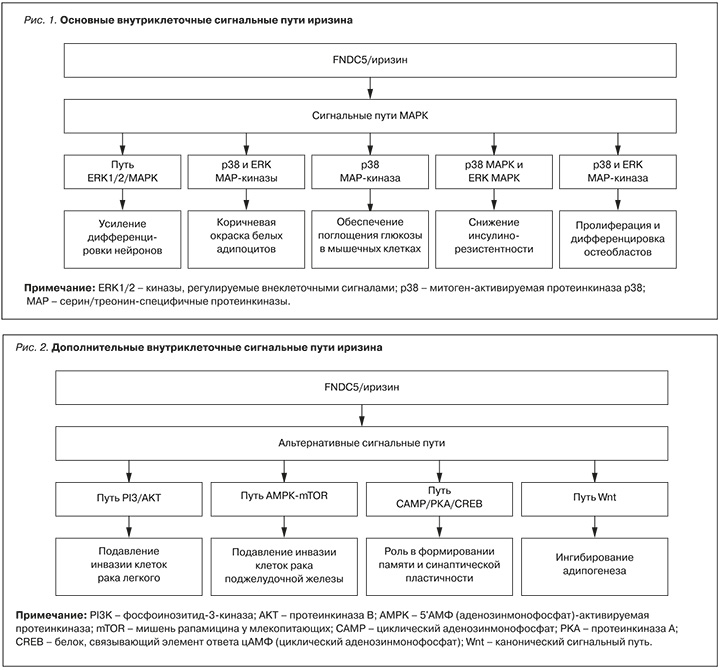
Наиболее значимая роль иризина – «потемнение» белых адипоцитов, пролиферация нейронов и участие в костном метаболизме [4, 5, 7–9]. Также он участвует в гомеостазе глюкозы и сердечном метаболизме [4]. Известно, что секреция иризина увеличивается на фоне высокоинтенсивной физической нагрузки [10]. Эффекты этого миокина, по-видимому, зависят от его концентрации и анатомических особенностей адипоцитов [11, 12].
Иризин снижает уровень липопротеидов низкой плотности и триглицеридов [13], усиливает дифференцировку остеобластов [14], стимулирует рост мышц [15] и нейротрофический фактор мозга [16]. Кроме того, он уменьшает дисфункцию эндотелиальных клеток и воспаление сосудов [17], а также снижает резистентность к инсулину [18]. Иризин оказывает противовоспалительное действие на сердце, легкие и органы пищеварения [19–21]. Хотя до сих пор нет окончательной теории о механизме, с помощью которого иризин влияет на воспаление, возможно, он подавляет системы передачи воспалительного сигнала и/или ингибирует криопирин (NLRP3) [22–24].
Удаление FNDC5 сокращало продолжительность жизни мышей [25]. Дефицит FNDC5 усугублял сосудистую жесткость, старение, окислительный стресс, воспаление и дисфункцию эндотелия у подопытных животных [25]. Лечение рекомбинантным иризином мышей уменьшало индуцированную ангиотензином II (Ang II) жесткость сосудов и замедляло старение [25].
ДИАГНОСТИЧЕСКИЕ И ПРОГНОСТИЧЕСКИЕ АСПЕКТЫ ИРИЗИНА
Установлено, что концентрации иризина снижены у пациентов с ССЗ и нарушениями метаболизма [5, 26–29]. У пациентов с сахарным диабетом 2-го типа (СД 2) его уровни в крови обратно коррелировали с гипергликемией, индексом массы тела и процентным содержанием жира в организме [30]. Соотношение «окружность талии/рост» была обратно связана с иризином только у женщин [31]. Концентрации иризина в крови при СД 2 были значительно ниже, чем у здоровых людей. Также его концентрации в сыворотке крови оказались ниже у больных с СД и атеросклерозом, чем у пациентов с СД без атеросклероза [32].
Уровни иризина в крови были ниже у пациентов с артериальной гипертензией (АГ) по сравнению со здоровыми лицами и обратно коррелировали с артериальным давлением (АД) [33]. Более низкие концентрации этого маркера обнаружены у пациентов с первичной АГ по сравнению со здоровыми добровольцами [34]. Уровни иризина отрицательно коррелировали с толщиной комплекса интима-медиа сонных артерий [35].
Метаанализ (741 исследование, 876 пациентов с ИБС, 700 лиц контрольной группы) показал, что концентрации иризина по крови были снижены на 18,10 нг/мл у пациентов с ИБС в сравнению со здоровыми людьми [36]. Его содержание в крови было обратно связано с распространенностью и тяжестью кальцификации коронарных артерий [37]. Уровни иризина в крови отрицательно коррелировали с индексом коронарного кальция у пациентов с ИБС [38]. При этом тяжесть ИБС была ассоциирована с низким уровнем иризина в крови [39, 40].
Было обнаружено, что снижение уровня иризина является прогностическим критерием при инфаркте миокарда (ИМ) с подъемом сегмента ST [41]. Сниженная концентрация иризина в крови при поступлении в стационар у пациентов с острым ИМ была связана с возникновением неблагоприятных сердечно-сосудистых событий после чрескожного коронарного вмешательства [42].
Концентрации иризина в крови у пациентов с хронической сердечной недостаточностью (ХСН) были значительно ниже, чем в контрольной группе; отрицательная корреляция была выявлена между уровнями этого миокина и мозгового натрийуретического пептида (BNP) [43, 44]. При низком содержании иризина повышался риск развития острой декомпенсации ХСН [45].
Тяжесть кальцификации аортального клапана была отрицательно связана с уровнем иризина крови [46]. Низкий его уровень – возможный диагностический и прогностический лабораторный критерий при идиопатической легочной гипертензии [47].
ТЕРАПЕВТИЧЕСКИЕ АСПЕКТЫ ИРИЗИНА
В ряде исследований было показано, что физические упражнения приводят к увеличению секреции иризина скелетными мышцами [48–50]. Как упражнения на выносливость организма, так и особенно упражнения с отягощениями повышали уровень иризина в крови [51].
Экспериментальное исследование на крысах с индуцированной гипертензией продемонстрировало, что внутривенное введение иризина привело к снижению АД путем активации ядерного фактора эритроидного происхождения 2 (Nrf2) и симпатической регуляции паравентрикулярного ядра гипоталамуса [52]. Гиперэкспрессия FNDC5 снижала АД, кроме того, FNDC5 оказывал благотворное влияние на сосуды [53]. Иризин улучшал функцию эндотелия через путь AMPK/eNOS (эндотелиальная синтаза оксида азота) и приводил к уменьшению АД [54].
Иризин снижал выраженность атеросклероза у мышей с дефицитом аполипопротеина Е путем ингибирования клеточного воспаления и апоптоза [55]. Помимо этого, он уменьшал выраженность воспаления и эндотелиальную дисфункцию, вызванные конечными продуктами гликирования, посредством ингибирования передачи сигналов ROS (активные формы кислорода)/NLRP3 [22]. Положительное влияние иризина на эндотелиальную функцию реализуется, по-видимому, за счет подавления окислительного стресса и ингибирования протеинкиназы С-β (PKC-β), никотинамид-адениндинуклеотидфосфата (NADP) оксидазы и индуцированной ядерным фактором-каппа В (NFκB) NOS [56]. Иризин снижал рекрутирование Т-лимфоцитов и макрофагов при атеросклерозе [57], уменьшал экспрессию медиаторов воспаления, таких как молекулы клеточной адгезии (ICAM-1, VCAM-1), моноцитарный хемоаттрактантный протеин-1 (MCP-1), интерлейкин 6 и NF-κB [59]. Механизмом этого процесса может быть опосредованное ингибирование сигнального пути ROS-P38MAPK-NFκB и активация сигнального пути AMPK-PI3K-PKB-NOS [55, 57].
Иризин защищал сердце от ишемического и реперфузионного повреждения (I/R) дозозависимым образом [59]. При его введении в течение 2 нед мышам с ИМ наблюдались улучшение сердечной функции, уменьшение дилатации желудочков и площади инфарктной зоны [60]. При диабете иризин подавлял NLRP3 в эндотелиальных клетках микрососудов сердца при I/R [61]. Было доказано, что при сердечной недостаточности иризин регулирует аутофагию через активацию сигнального пути AMPK/ULK1 (Unc-51-подобная киназа 1) [62, 63].
Продемонстрирована возможность лечения тахиаритмии путем микроинъекции иризина в двойное ядро, что индуцировало увеличение концентрации клеточного кальция и деполяризацию нейронов и вызывало брадикардию у бодрствующих крыс [64]. Иризин или FNDC5 значительно снижал выраженность фиброза миокарда [65]. Наряду с этим иризин уменьшал индуцированный Ang II сердечный фиброз за счет опосредованного Nrf2 ингибирования сигнальной оси ROS/TGFβ1 (трансформирующий фактор роста β1) [66]. Иризин защищал сердце от кардиотоксичности, вызванной доксирубицином, положительно влияя на митохондриальную динамику и укрепляя эндогенную антиоксидантную систему при участии оси AMPK–Nrf2 [67].
Установлено, что лекарственные препараты могут индуцировать экспрессию FNDC5 и иризина: так, икариин усиливает экспрессию FNDC5 и иризина, активируя путь AMPK, а рекомбинантный гормон роста человека и орлистат повышают уровень иризина в крови [68].
ЗАКЛЮЧЕНИЕ
В современном мире имеются высокие технологии для идентификации новых биомаркеров, вследствие чего необходимо создание мультибиомаркерной модели диагностики и прогнозирования течения кардиоваскулярной патологии. Для этого требуется совершенствование биоинформационных технологий, необходимых для анализа большой базы данных. Представленный литературный обзор указывает на потенциально важную диагностическую и прогностическую значимость оценки иризина. И хотя на момент написания этой статьи накоплено не так много клинических данных в отношении влияния этого миокина на сердечно-сосудистую систему, ожидается, что дальнейшие исследования продемонстрируют возможность его использования как дополнительного лабораторного инструмента диагностики и оценки прогноза у пациентов кардиологического профиля. Регуляция концентрации и экспрессии иризина, возможно, окажется многообещающей стратегией для лечения патологии сердца и сосудов.



