Анализ смертности от 235 заболеваний в 20 возрастных группах населения с 1990 по 2010 г., опубликованный в декабре 2012 г. в журнале Lancet, показал, что хроническая обструктивная болезнь легких (ХОБЛ) поднялась с 4-го на 3-е место в списке причин смерти в мире [1]. На данный момент можно констатировать, что ХОБЛ – это нозология, смертность от которой имеет тенденцию неуклонного роста [2]. По данным различных авторов, от 25,0 до 48,8% всех случаев смерти у больных ХОБЛ вызваны сердечно-сосудистыми заболеваниями (ССЗ), 23,3% – дыхательной недостаточностью, 20,9% – раком легкого [3]. Аналогичные данные о значимости ССЗ как ведущей причины смертности пациентов с ХОБЛ продемонстрированы в работах отечественных авторов [4].
Несмотря на то что ХОБЛ в современном мире представляет собой тяжелое социально-экономическое бремя, современные алгоритмы выявления заболевания далеки от совершенства, отсутствуют достоверные данные о распространенности болезни. Доступные эпидемиологические данные отличаются значительной вариабельностью.
Так, в США встречаемость ХОБЛ составляет 4,6%, в странах Юго-Восточной Азии – 11,4%, в Европе – 7,4%, в Чили – свыше 20%, а в России этот показатель, по данным официальной статистики, равен 1,6%. Учитывая результаты исследования GARD, проведенного по инициативе ВОЗ в 2010 г., распространенность ХОБЛ в общей популяции составляет 15,3% [5, 6]. Заболевание встречается с различной частотой в следующих возрастных группах: 31–40 лет – 8,9% обследованных; 41–50 лет – 15,5%; 51–60 лет – 23,9%; 61–70 лет – 33,2%; 71–80 лет – 38,7% [7].
Таким образом, объективная величина распространенности ХОБЛ более чем в 9 раз выше данных официальной статистики РФ, что отражает низкий уровень выявляемости заболевания. Отдельная проблема – несвоевременная диагностика ХОБЛ, когда обнаружение болезни происходит на поздних его стадиях (GOLD III, IV) [1]. По данным отечественных авторов, низкий уровень выявляемости ХОБЛ на ранних стадиях обусловлен, с одной стороны, гиподиагностикой, а с другой – неправильной интерпретацией результатов спирометрии, которая наблюдается в ≈47% случаев [8].
В связи с этим необходимо подчеркнуть, что ранняя диагностика ХОБЛ на начальных стадиях заболевания позволит с помощью применения современных профилактических и терапевтических стратегий улучшить прогноз пациентов, снизить темпы падения легочной функции и риски прогрессирования коморбидной сердечно-сосудистой патологии.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ ХОБЛ
В настоящее время алгоритм диагностики ХОБЛ построен на сочетании клинической оценки респираторных симптомов и данных спирометрии (обструкция по ОФВ1, воздушная ловушка по ОФВ1/ФЖЕЛ) [9]. Ключевые клинические показатели диагностики ХОБЛ представлены в таблице 1.
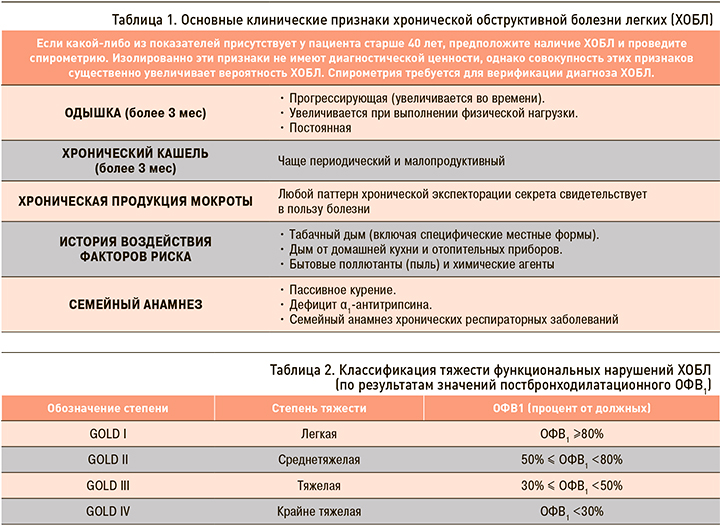
Спирометрия необходима для установления клинического диагноза ХОБЛ. Наличие постбронходилатационного соотношения ОФВ1/ФЖЕЛ <0,70 подтверждает наличие воздушной ловушки и самого заболевания. Снижение постбронходилатационного ОФВ1 в процентах от должного служит критерием степени тяжести функциональных нарушений при ХОБЛ (табл. 2).
Открытым остается вопрос разработки алгоритма выявления пациентов с ХОБЛ в первичном звене. Согласно современным рекомендациям, диагноз ХОБЛ следует заподозрить у лиц с одышкой, хроническим кашлем, продукцией мокроты и с воздействием в анамнезе характерных факторов риска заболевания. Всем пациентам с подозрением на ХОБЛ рекомендуется проведение спирометрии для оценки тяжести обструктивных нарушений. При выявлении признаков бронхиальной обструкции у симптоматичных пациентов (ОФВ1 <100%) показано проведение бронходилатационного теста с определением функционального признака «воздушной ловушки» (ОФВ1/ФЖЕЛ <0,7) [9, 10].
В соответствии с приказом Минздрава России от 13.03.2019 № 124н «Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения» на втором этапе диспансеризации с целью дополнительного обследования и уточнения диагноза заболевания (состояния) показана спирометрия (для граждан с подозрением на хроническое бронхолегочное заболевание, курящих граждан, выявленных по результатам анкетирования) по назначению врача-терапевта.
Таким образом, показания для проведения спирометрии в рамках диспансеризации населения с целью своевременного выявления ХОБЛ четко не определены. В связи с вышеизложенным целью настоящего исследования стало изучение распространенности ХОБЛ в амбулаторных условиях и разработка алгоритмов диагностики заболевания в первичном звене.
МАТЕРИАЛ И МЕТОДЫ
Группу наблюдения составила случайная выборка 1000 человек в возрасте от 40 до 75 лет прикрепленного населения амбулаторного учреждения ведомственного подчинения. Группа обследуемых не имела профессиональных факторов риска развития ХОБЛ, имела высокий социально-экономический статус и образовательный уровень (94% – высшее образование).
Из этой группы были исключены 2 пациента с ранее диагностированной ХОБЛ, 3 человека с анамнезом рака легких, 2 человека с анамнезом туберкулеза легких. Еще 21 человек отказался участвовать в исследовании. Таким образом, выборка для скрининга ХОБЛ составила 972 человека.
Средний возраст обследуемых составил 57,0 лет [47,0; 66,0]. Обращает на себя внимание, что встречаемость ХОБЛ в группе до проведения скрининга составила 0,2%.
Согласно действующим клиническим рекомендациям, при базисной терапии ХОБЛ предпочтение отдается длительно действующим антихолинергическим препаратам (ДДАХ), длительно действующим β2-агонистам (ДДБА) и фиксированной комбинации ДДАХ/ДДБА. Применение таких ингаляционных препаратов позволяет положительно влиять на функцию легких, симптомы и риск обострений ХОБЛ. Пациенты, состоявшие на диспансерном наблюдении с диагнозом ХОБЛ, получали терапию коротко действующими β2-агонистами (КДБА) и/или М-холинолитиками. Несмотря на современные рекомендации, больные не получали вакцинацию от гриппа и пневмококка.
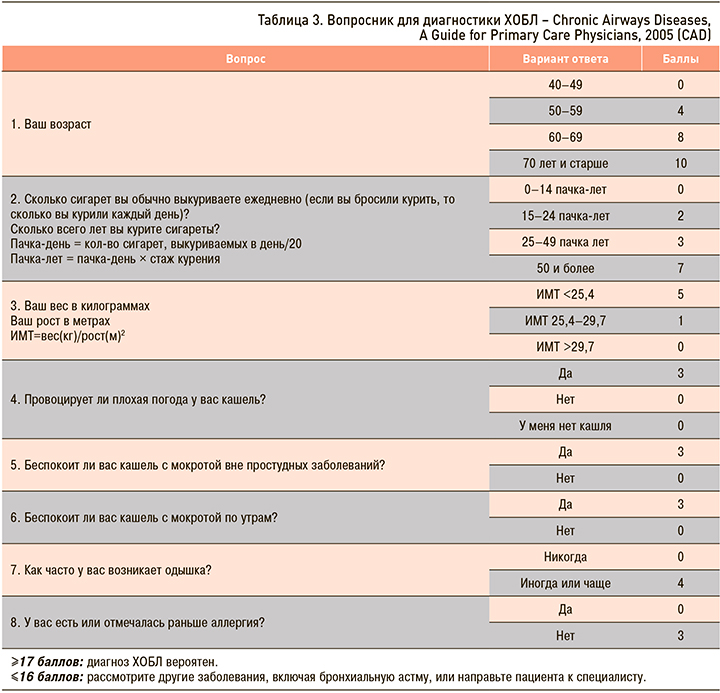
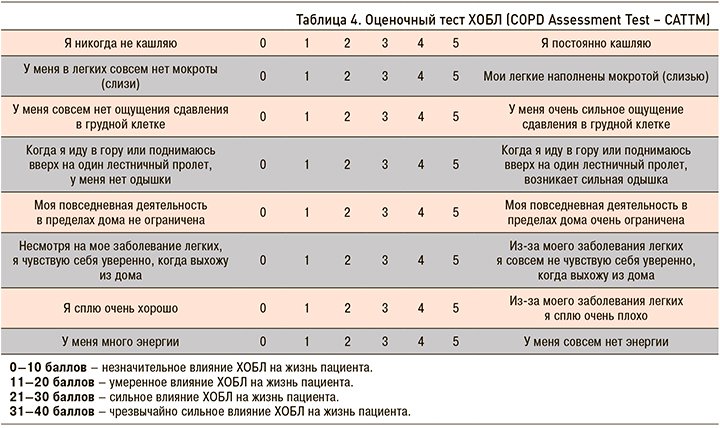
Лицам, включенным в скрининг, проводилось спирометрическое исследование на оборудовании Spirolab III (MIR (МИР), Италия). Для оценки обратимости обструкции всем обследуемым проводился бронходилатационный тест с КДБА (сальбутамолом 400 мкг через дозированный аэрозольный ингалятор). Все пациенты проходили оценочный тест ХОБЛ – COPD Assessment Test (CAT), а также заполняли вопросник для диагностики ХОБЛ – Chronic Airways Diseases, A Guide for Primary Care Physicians, 2005 (CAD) (табл. 3, 4) [9, 10].
Статистический анализ выполнялся с помощью программы IBM SPSS Statistics 22. При проведении проверки на нормальность распределения с помощью двухстороннего критерия согласия Колмагорова–Смирнова большая часть выборки не удовлетворяла условиям, в связи с чем нами использовались статистические методы для непараметрических распределений. Описательная статистика выборок представлена в виде медианы, первого и третьего квартилей. С целью оценки прогностической способности опросников CAT и CAD был проведен ROC-анализ по методу Hanley J.A., McNeil B.J. [11]. Анализировалась площадь под кривой AUC (area under curve), которая характеризует прогностическую способность показателя. Оптимальная точка отсечения (Cut-off Value) рассчитывалась по максимуму суммы чувствительность (Sensitivity) + специфичность (Specificity) в различных точках отсечения ROC-кривой. Статистически значимыми считались различия при p <0,05.
 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Нормальные показатели спирометрии выявлены у 917 человек (94,2%). У 41 человека (4,2%) была диагностирована ХОБЛ в соответствии с критериями GOLD-2019 [9]. Основным установленным фактором риска в исследуемой группе было табакокурение (табл. 5).
Среди лиц с диагностированной ХОБЛ 20 человек наблюдались с диагнозом «хронический бронхит». Средний стаж курения у обследуемых составил 45,8 пачко-лет. Разделение по половому признаку: 81,9% мужчин и 18,1% женщин. Средний возраст мужчин, имеющих диагноз ХОБЛ, составил 61,8 лет, женщин – 65,3 лет. Распределение по степени тяжести функциональных нарушений: GOLD I – 4 человека; GOLD II – 25 человек; GOLD III – 12 человек. Обращает на себя внимание, что подавляющее количество выявленных больных имело среднетяжелые функциональные нарушения.
Столь низкий процент распространенности ХОБЛ среди обследуемой группы объясняется особенностями исследуемой выборки: рафинированная группа без профессиональных факторов риска с высоким социально-экономическим и образовательным статусом. Заметим, что при активном скрининге встречаемость ХОБЛ оказалась в 20 раз выше в сравнении с исходными показателями и, несмотря на рафинированную группу, была почти в 3 раза выше среднестатистических показателей.
 В ходе исследования была выявлена группа пациентов (14 человек) с результатами спирометрии, соответствующими критериям ХОБЛ, в отсутствие факторов риска развития заболевания и респираторной симптоматики. Средний возраст этой группы пациентов составлял 74,1 года (выше среднего по всему исследованию), при этом все они имели отягощенный кардиологический анамнез: 7 человек перенесли инфаркт миокарда, у 5 было выполнено аортокоронарное шунтирование, 8 страдали хронической сердечной недостаточностью (ХСН) 2А, у 7 была выявлена фибрилляция предсердий, у 12 диагностирована артериальная гипертония. Пациенты этой группы не имели в анамнезе основного фактора риска ХОБЛ – курения.
В ходе исследования была выявлена группа пациентов (14 человек) с результатами спирометрии, соответствующими критериям ХОБЛ, в отсутствие факторов риска развития заболевания и респираторной симптоматики. Средний возраст этой группы пациентов составлял 74,1 года (выше среднего по всему исследованию), при этом все они имели отягощенный кардиологический анамнез: 7 человек перенесли инфаркт миокарда, у 5 было выполнено аортокоронарное шунтирование, 8 страдали хронической сердечной недостаточностью (ХСН) 2А, у 7 была выявлена фибрилляция предсердий, у 12 диагностирована артериальная гипертония. Пациенты этой группы не имели в анамнезе основного фактора риска ХОБЛ – курения.
Существует опасность гипердиагностики ХОБЛ, особенно среди пожилых лиц, связанная с отсутствием достоверной корреляции должных величин «фиксированного показателя ОФВ1/ФЖЕЛ <0,7» (FR) с возрастом пациентов. Это связано как с чувствительностью спирометрического теста, так и возрастной инволюцией легких (например, у лиц старше 70 лет) [12].
Показано, что обструкция из-за задержки жидкости и бронхиальной гиперреактивности может приводить к снижению FR у больных ХСН даже в отсутствие истинной ХОБЛ [13]. Это, безусловно, требует взвешенного подхода к диагностике ХОБЛ на фоне сердечной недостаточности. Высокий процент диагностики ХОБЛ при ХСН исследователи частично объясняют гипердиагностикой из-за пограничных или незначительно сниженных показателей спирометрии у пациентов, имеющих сердечную недостаточность со сниженной фракцией выброса [14]. Это согласуется с данными, показывающими, что использование критериев GOLD приводит к неправдоподобно частому диагностированию бронхиальной обструкции у асимптомных пожилых лиц с низким риском развития ХОБЛ и никогда не куривших пациентов [15,16].
 Таким образом, при постановке диагноза ХОБЛ необходим очень аккуратный и тщательный подход на основании детального анализа медицинской истории (курение, факторы риска, респираторная симптоматика до дебюта сердечно-сосудистой патологии), физикального обследования (оценка симптомов задержки жидкости, застоя в легочной гемоциркуляции, рестриктивных изменений, наличия эмфиземы и т.д.), правильной оценки ответа на ингалируемые бронхорасширяющие препараты (если таковые назначены).
Таким образом, при постановке диагноза ХОБЛ необходим очень аккуратный и тщательный подход на основании детального анализа медицинской истории (курение, факторы риска, респираторная симптоматика до дебюта сердечно-сосудистой патологии), физикального обследования (оценка симптомов задержки жидкости, застоя в легочной гемоциркуляции, рестриктивных изменений, наличия эмфиземы и т.д.), правильной оценки ответа на ингалируемые бронхорасширяющие препараты (если таковые назначены).
Основная задача нашего исследования – разработка алгоритма диагностики ХОБЛ для врачей первичного звена. Актуальная проблема – выбор контингента пациентов, которым необходимо проведение спирометрии для выявления этого заболевания. Для определения группы с высоким риском развития ХОБЛ с целью дальнейшего проведения скрининга нами была произведена оценка предсказательной способности рутинных опросников (САТ и CAD). В соответствии с полученными данными была построена ROC-кривая (Receiver Operating Characteristic). В качестве переменной состояния была принята дихотомическая переменная (есть ХОБЛ – «1», нет ХОБЛ – «0»), определенная по соотношению ОФВ1/ФЖЕЛ <0,7.
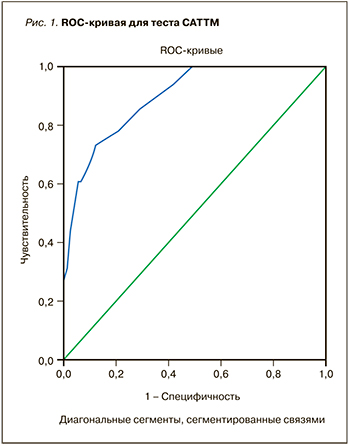
Площадь под ROC-кривой (AUC) для оценочного теста САТ составила 0,895 (95% ДИ 0,85–0,93) (рис. 1). При этом пороговое значение для теста САТ=7,5.
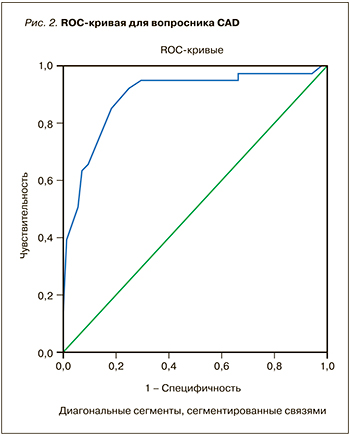
ROC AUC для вопросника CAD составил 0,89 (95% ДИ 0,83-0,94). Пороговое значение CAD=10,5 (рис. 2).
Таким образом, оба теста обладают хорошей прогностической способностью, причем этот показатель у них оказался сопоставимым. По данным International Primary Care Respiratory Group (IPCRG) Guidelines: Diagnosis of respiratory diseases in primary care, в качестве порогового значения для вопросника CAD предлагается использовать величину более 17, что существенно выше показателя, полученного нами. Это может быть объяснено более тщательным формированием группы скрининга (исключение пациентов с диагностированной другой бронхолегочной патологией – раком, туберкулезом).
ЗАКЛЮЧЕНИЕ
Выявляемость ХОБЛ в амбулаторно-поликлинической практике крайне низка. Предложенный алгоритм диагностики с помощью рутинных тестов и опросников в качестве скрининга и отбор пациентов для проведения спирометрии позволяет увеличить выявляемость ХОБЛ без увеличения количества необоснованных спирометрических исследований (95% исследований, выполненных в процессе скрининга, были нормальными), что значительно снижает затраты на диагностику.
При проведении спирометрии у лиц старшей возрастной группы и(или) с наличием коморбидной сердечно-сосудистой патологии (в особенности ХСН) необходим взвешенный клинический подход. Он должен основываться на анализе факторов риска заболевания, выраженности респираторных симптомов, учитывать возможность развития «сенильного легкого» и ХСН с целью исключения гипердиагностики ХОБЛ. Необходимы дальнейшие исследования на группах пациентов, более приближенных к средней выборке, наблюдающейся в первичном звене.



