ВВЕДЕНИЕ
В течение многих лет продолжается изучение полиморфизмов большого числа генов в надежде лучше понять механизмы, лежащие в основе развития бронхиальной астмы (БА), и выявить генетические биомаркеры, позволяющие предсказать возникновение и варианты течения этого заболевания [1–5].
Изучение генов, участвующих в патогенезе БА, чрезвычайно важно и для выявления лиц группы высокого риска по астме, в отношении которых можно будет проводить тщательное обследование и, возможно, персонифицированное лечение [2]. Существует мнение, что это может способствовать снижению распространенности и тяжести течения БА [2, 3, 5]. Все вышесказанное свидетельствует о необходимости дальнейшего изучения генов-кандидатов, вовлеченных в развитие астмы.
Один из таких генов – ген SOCS5, локализованный в коротком плече 2 хромосомы, локусе 21 (2p21) и кодирующий одноименный белок. Рядом исследований доказано, что именно белок SOCS5 регулирует Th-клеточную дифференцировку, определяет соотношение Th1-/Th2-клеток и влияет на Th2-иммунный ответ при БА [6–10].
В исследованиях по изучению влияния однонуклеотидного полиморфизма (ОНП) rs6737848 гена SOCS5 на формирование БА была подтверждена его связь с развитием атопической БА [2, 11]. И.В. Салтыковой с соавт. (2013) впервые в России были получены данные, свидетельствующие о патогенетической роли rs6737848 гена SOCS5 в отношении атопической БА, но не было показана его связь с уровнем общего IgE [2]. Авторы предположили, что ОНП rs6737848 гена SOCS5 участвует в развитии БА независимо от IgE-опосредованных механизмов поддержания аллергического воспаления [2].
В целом исследований, посвященных изучению роли ОНП rs6737848 гена SOCS5 в развитии БА, крайне мало, и механизм его вовлеченности в развитие заболевания не ясен.
Целью нашего исследования стало изучение ассоциации ОНП rs6737848 гена SOCS5 с аллергической БА.
МАТЕРИАЛ И МЕТОДЫ
В ходе работы было обследовано 179 человек (61 мужчина и 118 женщин) с аллергической БА. Средний возраст больных составил 37,45±14,23 лет: 31,8±10,43 года у мужчин и 40,79±15,45 года у женщин. Легкое течение аллергической БА диагностировано у 116 (68,2%), среднетяжелое – у 46 (27,1%), тяжелое – у 8 (4,7%) участников.
В контрольную группу вошли 217 человек (107 мужчин и 110 женщин). Средний возраст их равнялся 33,9±12,7 лет: 28,5±9,1 лет у мужчин и 39,3±16,4 года у женщин. Контрольная группа была представлена популяционной выборкой жителей Новосибирска, обследованных в рамках международных проектов MONICA (Multinational MONItoring of trends and determinants in CArdiovascular disease) и HAPIEЕ (Health, Alcohol and Psychosocial factors In Eastern Europe).
Работа была утверждена этическим комитетом Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого (протокол № 73/2016 от 16.12.2016).
Больным аллергической БА выполнялся стандартный набор лабораторных и инструментальных методов обследования.
Всем обследуемым был проведен молекулярно-генетический анализ. Выделение ДНК из лейкоцитов крови осуществлялось с помощью метода фенол-хлороформной экстракции [12]. Перед началом работы приготовлялся стоковый раствор протеиназы К. Для дальнейшей работы и хранения полученный раствор разливался на аликвоты меньшего объема по 20–40 мкл. Затем в полипропиленовую пробирку объемом 1,5 мл добавляли 50 мкл заранее размороженной венозной крови, 50 мкл деионизованной воды и перемешивали на вихревом смесителе (Multi-Vortex V-32, bioSan) 3–5 с. Далее в пробирку вносили 100 мкл 2-кратного лизирующего буфера и 4 мкл стокового раствора протеиназы К до итоговой концентрации в 200 мкг/мл, после чего перемешивали их на вихревом смесителе 3–5 с и инкубировали в термостате при температуре 55 °С в течение 1 ч. По истечении часа в пробирку добавляли равный объем (200 мкл) раствора фенол-хлороформа, перемешивали образец на вихревом смесителе 10 с и помещали в центрифугу (Heal Force, Model: Neofuge 13R) при комнатной температуре на 5 мин при заданной скорости 10 000–12 000 об./мин (10 000–13 000 g). Следом в новую полипропиленовую пробирку на 1,5 мл вносилась отобранная верхняя (водная) фаза центрифугированного образца, и в нее добавлялся равный объем (200 мкл) раствора хлороформа. После этого содержимое пробирки перемешивали на вихревом смесителе 3–5 с и центрифугировали при комнатной температуре в течение 2 мин со скоростью 10 000–12 000 об./ мин (10 000–13 000 g). Далее опять в новую полипропиленовую пробирку объемом на 1,5 мл вносилась отобранная верхняя (водная) фаза, и к ней добавлялись 40 мкл (1/5 объема) раствора ацетата аммония, 5М и 720 мкл (3 объема) раствора этанола 96%. Полученная смесь перемешивалась на вихревом смесителе 3–5 с и помещалась на инкубацию при -20 °С на 40 мин. После инкубирования образцы центрифугировали 15 мин со скоростью 12 000 об./мин (13 000 g). Затем супернатант удаляли, добавляли 100 мкл раствора этанола 75% и вновь центрифугировали в течение 1 мин при комнатной температуре со скоростью 12 000 об./мин (13 000 g). Полученный супернатант вновь удаляли, осадок подсушивали на воздухе 15 мин, после чего растворяли его в 50 мкл ТЕ-буфера.
Качество полученных образцов ДНК проверялось на спектрофотометре (NanoVue Plus). Амплификация необходимого фрагмента исследуемого гена проводилась с помощью набора реактивов для постановки ПЦР (PRIMETECH, Беларусь). Расчет объема необходимой смеси для требуемого количества проб производился с учетом погрешности используемых пипеток и соответственно увеличением объема итоговой смеси на 10% от требуемого количества проб. Для амплификации на 1 пробу (объем 25 мкл) смесь готовилась из расчета (в порядке добавления компонентов в пробирку) 15,35 мкл деоинизованной воды, 2,5 мкл буфера А 10X, 1 мкл 50 mM MgCl2, 2 мкл 2,5 mM раствора dNTPs, по 1 мкл прямого и обратного праймеров, в последнюю очередь добавлялось 0,15 мкл Taq-полимеразы. Полученную смесь перемешивали с помощью вихревого смесителя 3-5 с при комнатной температуре. Далее смесь разносили в пробирки с добавлением 2 мкл исследуемой ДНК. Полученные образцы перемешивали с помощью вихревого смесителя в течение 3–5 с при комнатной температуре. Для выполнения амплификации использовался программируемый термостат (BIOER, Model TC-EA) с функцией «горячая крышка». Условия проведения реакции: 95 °С – 5 мин; 95 °С – 30 с, 62 °С – 30 с, 72 °С – 30 с (35 циклов); 72 °С – 7 мин. Полученные образцы после завершения процесса амплификации могли храниться при температуре от +4 до +8 °С в течение 24–48 ч.
Полученные продукты амплификации проверялись методом горизонтального электрофореза. Далее к полученным ПЦР-продуктам добавлялась эндонуклеаза рестрикции BstDEI («Сибэнзим», Россия) (сайт узнавания: 5’ …С↓TNAG …3’; 3’ …GANT↑C …5’) для гена SOCS5, и образцы оставлялись на 16 ч в термостате при 37,0 °С. Результат оценивался после электрофореза в 2% агарозном геле и окраски ZUBER GREEN. Для полиморфизма rs6737848 гена SOCS5 генотип CG определялся как 3 фрагмента размером 204, 132 и 72 п.н., генотип СС – как 2 фрагмента размером 132 и 72 п.н., генотип GG – как продукт размером 204 п.н.
В рамках статистического анализа полученных результатов использовались способы статистической обработки в соответствии с характером учетных признаков и числа групп сравнения. Точный критерий Фишера применялся при частоте встречаемости признака 5 и менее. Относительный риск вероятности заболевания по конкретному генотипу или аллелю рассчитывался как отношение шансов (ОШ). Различия оценивали как статистически значимые при р <0,05 [13]. Соответствие распределения наблюдаемых частот генотипов исследуемого гена, теоретически ожидаемого по равновесию Харди–Вайнберга, проверяли с использованием критерия χ2.
РЕЗУЛЬТАТЫ
Результаты анализа частот генотипов и аллелей ОНП rs6737848 гена SOCS5 среди больных с аллергической БА и лиц контрольной группы представлены в таблице 1. Установлено статистически значимое преобладание генотипа СС и аллеля C у больных аллергической БА по сравнению с контрольной группой. Кроме того, выявлено, что у больных с аллергической БА число носителей генотипа СG и аллеля G была статистически значимо меньше, чем в группе контроля.
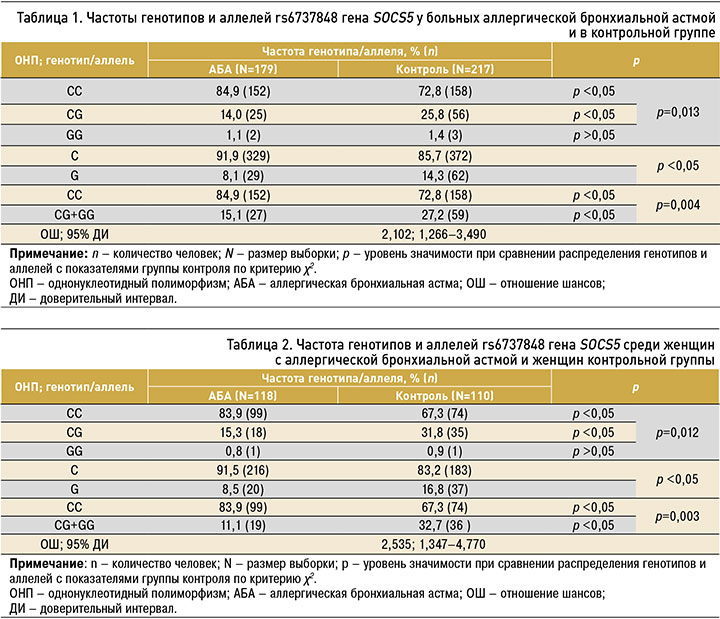
В подгруппе женщин с аллергической БА статистически значимо чаще, чем в контрольной группе, встречался распространенный генотип СС – 83,9 и 67,3% соответственно (p=0,012; табл. 2). Частота генотипа CG у женщин основной группы была статистически меньше, чем в контроле: 15,3 и 31,8% соответственно (р=0,012). Распространенность аллеля C среди женщин с аллергической БА статистически значимо превышала показатель в группе контроля: 83,9 против 67,3% (р <0,05).
Нами проанализированы частоты генотипов и аллелей полиморфизма rs6737848 гена SOCS5 среди больных разной степени тяжести аллергической БА и лиц контрольной группы (табл. 3). Частота генотипа СС полиморфизма rs6737848 гена SOCS5 у пациентов с легкой астмой была статистически значимо больше, чем в контрольной группе. У этой подгруппы больных статистически значимо реже, чем в контроле, встречался генотип СG: 12,1 и 25,8% соответственно (р=0,015).
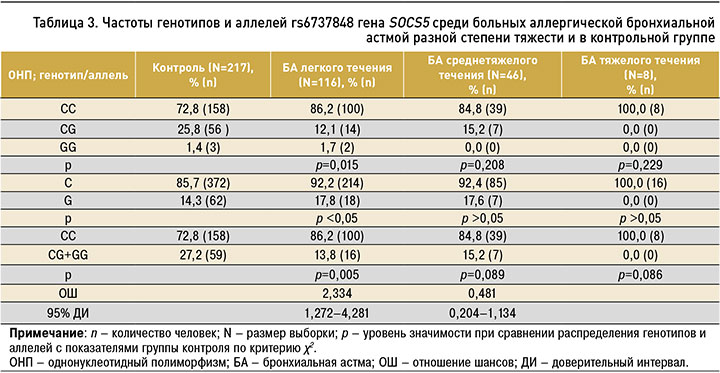
Установлены различия при сравнении аллелей полиморфного локуса гена SOCS5 у пациентов БА легкой степени тяжести и лиц контрольной группы. Аллель С встречался статистически значимо чаще среди больных аллергической БА легкой степени тяжести, чем в группе контроля: 92,2 против 85,7% (р <0,05; ОШ 2,334; 95% ДИ: 1,272 4,281). Статистически значимых различий в распределении частот генотипов и аллелей среди больных аллергической БА средней и тяжелой степени тяжести и лиц группы контроля нами получено не было.
ЗАКЛЮЧЕНИЕ
Таким образом, вся выборка больных аллергической БА характеризовалась преобладанием частоты генотипа СС и аллеля С и снижением числа носителей генотипа СG и аллеля G rs6737848 гена SOCS5. Также нами установлено статистически значимое преобладание числа носителей генотипа СС и аллеля С среди женщин с аллергической БА и в выборке больных аллергической БА легкого течения. Изучение полиморфизма rs6737848 гена SOCS5 показало ассоциацию генотипа СС и аллеля C с аллергической БА в основной группе, в подгруппе женщин и подгруппе пациентов с легким течением заболевания.
Результаты нашей работы, свидетельствующие о более высокой частоте встречаемости генотипа СС и аллеля C гена SOCS5 среди больных аллергической БА по сравнению с контролем, согласуются c результатами исследования И.В. Салтыковой, М.Б. Фрейдина, Е.Ю. Брагиной с соавт. (2013) [2]. Полученные данные свидетельствуют о возможном существенном влиянии генотипа СС и аллеля C rs6737848 гена SOCS5 на развитие аллергической БА. При этом генотип CG и аллель G гена SOCS5 оказывают условно протективное влияние в отношении аллергической БА.



