ВВЕДЕНИЕ
В настоящее время мы наблюдаем увеличение интереса к проблеме амилоидоза. С 1999 по 2018 г. публикационная активность, посвященная системному амилоидозу, увеличилась в 10 раз. Это связано с определенным прогрессом в диагностических и терапевтических стратегиях, появлением терапевтических вмешательств, способных улучшить прогноз при этом тяжелом заболевании [1].
Самый важный фактор в клинике амилоидоза и в его системных проявлениях – тип белка, входящего в структуру амилоидной субстанции. В настоящее время описано 36 белков-предшественников: транстиретин, аполипопротеин‑1, лизоцим, легкие цепи иммуноглобулинов и т.д. Каждый белок имеет определенную тропность к органам и тканям, что и предопределяет многогранность клинической симптоматики [1]. Амилоидоз – это сосудистый диспротеиноз, нарушение белкового обмена с формированием фибриллярного белка, который аккумулируется в органах и тканях. Основные компоненты таких включений – фибриллярные белки (F‑компонент), которые плотно связываются с гликопротеидами плазмы (Р‑компонент), хондроитинсульфатами тканей, фибрином, иммунными комплексами, в результате чего формируется очень прочное вещество. Амилоидные депозиты влияют на функцию органов не только за счет механической компрессии; проявляется локальная цитотоксичность, свободные радикалы вступают в действие и запускают повреждение и апоптоз клеток [2, 3].
Основные типы амилоидоза сердца – амилоидоз легких цепей иммуноглобулинов (AL) и транстиретиновая амилоидная кардиомиопатия (ATTR-КМП). Они составляют до 95% случаев амилоидной кардиопатии (АКМП). К редким случаям АКМП относят следующие белки-предшественники: сывороточный амилоид А, аполипопротеин A1 (AApoA1), тяжелые цепи иммуноглобулинов, альфа цепи фибриногена, гельсолин [4, 5].
Таким образом, при подозрении на АКМП в первую очередь необходимо проведение дифференциальной диагностики между ATTR-КМП и AL-КМП [1]. Актуальность поиска новых методов диагностики и терапии связана, с одной стороны, со значительными трудностями при постановке диагноза, с другой, с высоким уровнем смертности при амилоидной кардиопатии. Медиана выживаемости нелеченных пациентов с AL-амилоидозом с ХСН составляет <6 мес, а с транстиретиновой кардиомиопатией – менее 4 лет [5, 6].
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка З., 60 лет, 24 ноября 2022 г. поступила в терапевтическое отделение Больницы Центросоюза РФ с жалобами на общую слабость, одышку при умеренной физической нагрузке, онемение кистей обеих рук.
Анамнез заболевания: пациентка считает себя больной с ноября 2021 г., когда у нее впервые возникли давящие боли за грудиной и она была госпитализирована в Региональный сосудистый центр (РСЦ).
При электрокардиографии (ЭКГ) – ритм синусовый, неполная блокада правой ножки пучка Гиса (НБПНПГ), депрессия сегмента ST до 0,5 мм в I, II, AVL, V3–V6. При эхокардиогрфии (ЭхоКГ) отмечалась склонность к гипокинезии задней стенки левого желудочка (ЛЖ). Уровень высокочувствительного тропонина – 0,303 нг/мл. Пациентке была проведена коронароангиография (КАГ): гемодинамически значимых поражений коронарного русла выявлено не было, тип кровоснабжения правый. В общем анализе крови наблюдалась нейтропения (0,71×109/л) и лимфоцитоз (6,49×109/л), однако данные изменения интерпретированы не были. Пациентку выписали из РСЦ с диагнозом «инфаркт миокарда без подъема сегмента ST».
В январе 2022 г. больная обращалась к врачу-неврологу с жалобами на онемение пальцев рук, жжение обеих кистей. При ультразвуковой допплерографии артерий верхних конечностей были обнаружены атеросклеротические бляшки без влияния на кровоток. Была выполнена электронейромиография, диагностировано умеренное демиелинизирующее поражение двигательных и сенсорных волокон n.medialis dextra et sinistra, что характерно для синдрома «карпального канала».
В начале августа 2022 г. в связи с изменениями в общем анализе крови (нейтропения и лимфоцитоз) пациентка обращалась к гематологу, ей было рекомендовано проведение стернальной пункции. В миелограмме: малоклеточный полиморфный стернальный пунктат, местами с агрегацией клеток. Заключение гематолога: «лейкемоидная реакция», рекомендовано динамическое наблюдение.
22 августа 2022 г. больная была госпитализирована в одну из московских клиник с жалобами на слабость и выраженную одышку для обследования и уточнения диагноза.
В общем анализе крови: нейтропения – 0,21×109/л; лимфоцитоз – 5,47×109; N-концевой пропептид натриуретического гормона (В-типа; NT-proBNP) – 4136 пг/мл; высокочувствительный тропонин – 174 нг/л. В остальных лабораторных исследованиях клинически значимых изменений выявлено не было.
Для исключения системных заболеваний был выполнен иммуноблот, где отмечалось незначительное повышение антинуклеарного фактора (НЕр-2) – 1:160, тип свечения – ядерное крапчатое.
Данные ЭКГ: ритм синусовый с ЧСС 90 уд/мин. Рубцовые изменения нижней, переднеперегородочной области левого желудочка.
Данные ЭхоКГ: небольшое увеличение объема левого предсердий (ЛП) и правых камер сердца. Небольшая симметричная гипертрофия левого желудочка (ЛЖ). Глобальная систолическая функция ЛЖ значительно снижена. Фракция выброса (ФВ) 22%. Отмечается диффузный гипокинез стенок ЛЖ и незначительная асинхронность их сокращения. Снижение ударного и минутного объемов крови. Нарушение диастолической функции ЛЖ по 1 типу. Систолическое давление в легочной артерии (СДЛА) 32 мм рт.ст., незначительный перикардиальный выпот.
Данные спекл-трекинг эхокардиографии: визуализация удовлетворительная. Форма ЛЖ сферическая. Глобальная систолическая функция резко снижена (ФВ 20–22%). Зон нарушения локальной сократимости миокарда не обнаружено. Отмечается диффузный гипокинез всех стенок ЛЖ. Показатель глобальной продольной систолической деформации (GLS) равномерно резко снижен до 8–6 (норма до 20–22).
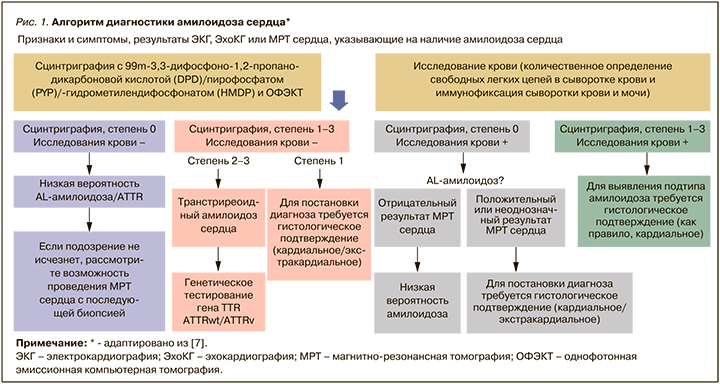
Заключение консилиума: диагноз остается неясен. Подозрение на амилоидную кардиомиопатию. Начато обследование по алгоритму диагностики амилоидоза сердца (рис. 1) [7, 8]:
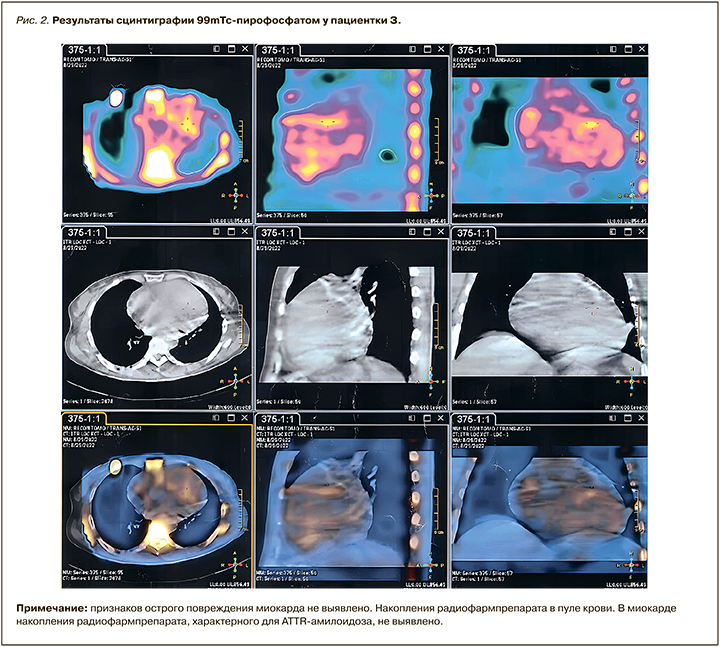
- сцинтиграфия с 99m-3,3-дифосфоно-1,2-пропанодикарбоновой кислотой/пирофосфатом/гидрометилендифосфонатом и однофотонная эмиссионная компьютерная томография (ОФЭКТ): сцинтиграфических признаков острого повреждения миокарда не выявлено. Накопления радиофармпрепарата в миокарде, характерного для транстиретинового амилоидоза (ATTR), не обнаружено (рис. 2);
- количественное определение свободных легких цепей в сыворотке крови и иммунофиксации сыворотки крови и мочи. Заключение: повышен уровень поликлонального иммуноглобулина А (IgA). Концентрация других иммуноглобулинов в норме. Следовая кроглобулинемия. Значительно увеличено количество циркулирующих иммунных комплексов (ЦИК). Методом количественного определения свободных легких цепей (СЛЦ) в сыворотке установлено повышение СЛЦ-κ (482 мкг/мл, нормальные значения 3,3–15,8) и СЛЦ-λ (2620 мкг/мл, нормальные значения – 3,2–28). В моче белок Бенс–Джонса не обнаружен.
Таким образом, АТТР-КМП была исключена. Для подтверждения КМП-AL принято решение о проведении магнитно-резонансной томографии (МРТ) сердца с внутривенным контрастированием гадолинием.
МРТ с гадолинием от 31.08.2022, заключение: общее снижение сократимости миокарда ЛЖ на фоне гипокинеза боковой стенки ЛЖ на всем протяжении, ФВ ЛЖ – 23%. После введения контрастного препарата определяется субэндокардиальное (40–50%) накопление миокардом боковой стенки ЛЖ в базальном сегменте, субэндокардиальное (до 30%) накопление миокардом боковой стенки в среднем и апикальном сегментах, миокардом верхушки ЛЖ с частичным переходом на миокард апикального сегмента нижней стенки, субэндокардиальное (до 20%) накопление миокардом нижней стенки в среднем сегменте. Признаков гиперемии миокарда ЛЖ в раннюю фазу контрастирования не выявлено. Данных в пользу отека миокарда ЛЖ не получено. Тромбов в полостях желудочков не выявлено. В полости перикарда определяется повышенное количество жидкости толщиной слоя до 15 мм. Заключение: картина характерна для очагового-рубцового поражения миокарда ЛЖ ишемического характера нижнебоковой локализации. Снижение сократимости ЛЖ. Гидроперикард.
При отрицательном результате МРТ сердца с гадолинием вероятность амилоидоза низкая, однако было принято решение провести экстракардиальное гистологическое исследование – колоноскопию с биопсией из тонкой и толстой кишки. При исследовании биопсийного материала при окраске Конго красным амилоид не обнаружен.
Таким образом, диагноз амилоидоза подтвержден не был.
При цитологическом исследовании мазков периферической крови отчетливо визуализировалось несколько популяций лимфоидных клеток, включая лимфоциты небольшого и среднего размера с округлой и неправильной формами ядер с грубым конденсированным хроматином (29%), более крупные активированные лимфоциты (10%) и большие гранулярные лимфоциты (61%). Преобладающая часть атипичных лимфоидных клеток были CD3+, CD2+, CD5+, CD8+, CD16+, CD57±, CD45RA+, TCRαβ+ и CD4-, CD56, CD7-, CD25-, CD10-, CD30-, TCRγδ-. Консультация гематолога: указанный клеточный иммунофенотип более соответствует Т-клеточному лейкозу/лимфоме из больших гранулярных лимфоцитов. Было рекомендовано дополнительно выполнить ультразвуковое исследование (УЗИ) лимфатических узлов и трепанбиопсию подвздошной кости.
В период с августа по ноябрь 2022 г. пациентка дважды госпитализировалась в Республиканскую клиническую больницу по месту жительства с диагнозом «кардиомиопатия. Т-клеточный лейкоз/лимфома из больших гранулярных лимфоцитов с поражением сердца? Нарушения ритма сердца: одиночная наджелудочковая экстрасистолия. Желудочковая экстрасистолия (IVB градация по Лауну), неустойчивые пароксизмы желудочковой тахикардии. Хроническая сердечная недостаточность (ХСН) IIБ с низкой ФВ (27%), функциональный класс (ФК) IV. Сердечная астма. Гидроперикард. Двусторонний гидроторакс».
Проводилось лечение: бисопролол 1,25 мг, эмпаглифлозин 10 мг, валсартан + сакубитрил 25 мг, клопидогрел 75 мг, ацетилсалициловая кислота + магния гидроксид 75 мг, розувастатин 20 мг.
Анамнез жизни: в 2020 г. пациентке было выполнено оперативное лечение по поводу желчнокаменной болезни – холецистэктомия. Семейный анамнез не отягощен. Вредных привычек не имеет. Аллергоанамнез не отягощен.
Результаты первичного осмотра в Больнице Центросоюза РФ от 24.11.2022: состояние средней тяжести, сознание ясное. Внешних проявлений застойной сердечной недостаточности нет. Отмечается выраженная слабость. В легких дыхание жесткое, хрипов нет. Частота дыхательных движений (ЧДД) 20/мин, SpO2 98%. Тоны сердца приглушены, аритмичные за счет экстрасистолии, патологических шумов нет. Пульс 90 уд/ мин, удовлетворительного наполнения, аритмичный, экстрасистолия. Артериальное давление (АД): склонность к гипотонии, на правой руке АД 100/60 мм рт.ст., на левой – 110/70 мм рт.ст. При осмотре остальных органов и систем клинических значимых изменений не выявлено.
Результаты лабораторно-инструментального обследования
Общий анализ крови от 24.11.2022: гемоглобин – 137 г/л; эритроциты – 5,19 млн/мкл; лейкоциты – 4,07 тыс/мкл; тромбоциты – 272 тыс/мкл; нейтрофилы – 12%; лимфоциты – 76%; скорость оседания эритроцитов (СОЭ) 40 мм/ч.
Биохимический анализ крови от 24.11.2022: аланинаминотрансфераза (АЛТ) – 113 Ед/л; аспартатаминотрасфераза (АСТ) – 37 Ед/л; креатинин – 57 мкмоль/л; глюкоза – 4,6 ммоль/л; альбумин – 37,3 г/л; бета-глобулины – 15,3 г/л; гамма-глобулины – 19,0 г/л, слияние β и γ фракций; тропонин I – 1919 нг/л; тиреотропный гормон (ТТГ) – 4,31 мЕд/л; трийодтиронин (Т3) – 2,3 пмоль/л; тироксин (Т4) – 12,18 пмоль/л.
Антитела к миокарду от 24.11.2022: IgG 1:640, миофибриллярный тип.
Общий анализ мочи от 24.11.2022: цвет желтый, прозрачность неполная, плотность – 1030, протеинурия – 30 мг/дл, лейкоцитурия – 8–10 в поле зрения. Концентрация белка в суточной моче – 95,3 мг/л. Суточная экскреция белка – 67 мг/сут.
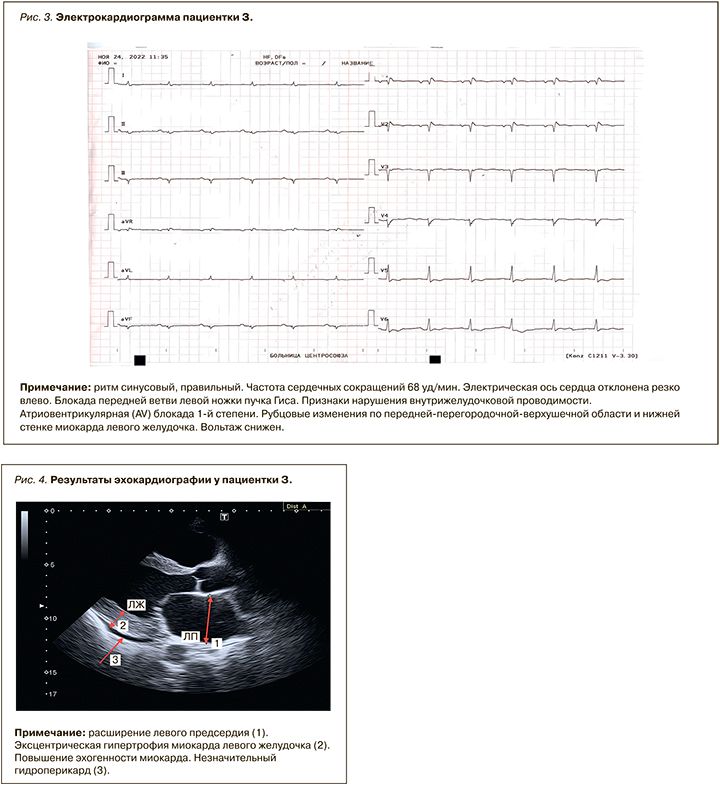
ЭКГ от 24.11.2022: ритм синусовый, правильный. Частота сердечных сокращений (ЧСС) 68 уд/мин. Электрическая ось сердца (ЭОС) отклонена резко влево. Блокада передней ветви левой ножки пучка Гиса (ПВ ЛНПГ). Признаки нарушения внутрижелудочковой проводимости. Атриовентрикулярная (AV) блокада 1-й степени. Рубцовые изменения по передней перегородочной верхушечной области и нижней стенке миокарда ЛЖ, вольтаж снижен (рис. 3).
Рентгенография органов грудной клетки, УЗИ щитовидной железы, органов брюшной полости, почек от 25.11.2022: без клинически значимых изменений.
ЭхоКГ от 24.11.2022: расширение ЛП, правого предсердия (ПП), правого желудочка (ПЖ). Эксцентрическая гипертрофия миокарда ЛЖ, гипертрофии ПЖ не выявлено, возможно, повышение эхогенности миокарда. Фракция выброса ЛЖ снижена (29%), ФВ ПЖ сохранена на фоне диффузного гипокинеза и парадоксального движения межжелудочковой перегородки (МЖП). Аннулодилатация кольца трехстворчатого клапана с формированием недостаточности клапана тяжелой степени, остальные клапаны существенно не изменены, недостаточность митрального клапана легкой степени. СДЛА не повышено. Незначительный гидроперикард без признаков сдавления камер сердца (рис. 4).
С целью верификации лейкоза/лимфомы пациентке была проведена трепанбиопсия костного мозга из подвздошной кости. Заключение: в трепан-биоптате морфологическая картина при учете клинических данных требует иммуногистохимического исключения Т-клеточного лейкоза/лимфомы. При проведении иммуногистохического исследования – иммунофенотип с учетом предоставленных данных проточной цитометрии, лимфоцитограммы, гемограммы свидетельствует в пользу Т-клеточного лейкоза из больших гранулярных лимфоцитов в виду выявления скоплений, в том числе интрасинусоидальных, Т-клеток, коэкспрессирующих CD3+, CD5+, CD8+, CD16+. Таким образом, соблюдены 2 основных и 1 дополнительный диагностические критерии, что, согласно WHO IARC Haematolymphoid Tumours (5th ed.) от 2022 г., является достаточным основанием для выставления диагноза Т-клеточного лейкоза из больших гранулярных лимфоцитов (T-LGLL).
Анализ клинико-анамнестических данных и лабораторно-инструментальных обследований свидетельствовал в пользу наличия у пациентки амилоидной кардиомиопатии:
- ХСН со сниженной ФВ ЛЖ (29%);
- интактные коронарные артерии (коронарография дважды);
- отсутствие анамнеза гипертонической болезни при наличии гипертрофии миокарда;
- низковольтажная ЭКГ;
- повышение высокочувствительного тропонина, NT-proBNP диспропорционально степени ХСН;
- избыточная секреция СЛЦ-κ и СЛЦ-λ при иммунохимическом исследовании крови.
На рисунке 5 представлена динамика клинического состояния пациентки, уровней высокочувствительного тропонина, NT-proBNP и ФВ.
Вместе с тем результаты МРТ с внутривенным контрастированием противоречили вышеназванному диагнозу, в связи с чем было принято решение проконсультироваться насчет МРТ от 31.08.2022 в отделении лучевой диагностики Медицинского научно-образовательного центра МГУ им. М.В. Ломоносова. Заключение: умеренная дилатация полости ЛЖ со значительным снижением его сократимости. Протяженная зона субэндокардиального контрастирования миокарда боковой стенки ЛЖ, миокарда ПЖ, предсердий, клапанных структур. Умеренный гидроперикард. Паттерн отсроченного контрастирования не характерен для рубцового или поствоспалительного поражения миокарда. МР-картина в первую очередь позволяет думать об амилоидозе сердца (рис. 6).
Таким образом был подтвержден диагноз амилоидной кардиомиопатии. Особенностью данного клинического случая было возникновение AL-амилоидоза, предполагающего наличие патологического клона секретирующих плазматических клеток, у пациентки со зрелой Т-клеточной опухолью, что представляет собой достаточно редкую, но описанную в литературе ситуацию [9]. Представленный случай обсуждался в гематологическом отделении МНИОИ им. П.А. Герцена. Совместно был сформулирован диагноз, и выработана дальнейшая терапевтическая тактика.
Заключительный клинический диагноз: Т-клеточный лейкоз из больших гранулярных лимфоцитов. Амилоидная кардиомиопатия AL. Недостаточность трикуспидального клапана тяжелой степени. Недостаточность митрального клапана легкой степени. ХСН со сниженной фракцией выброса (ФВ от 24.11.2022 – 29%) НК 2А, ФК II по NYНA. Нарушение ритма сердца по типу желудочковой экстрасистолии. Синдром карпального канала. Субклинический гипотиреоз.
Пациентка выписалась из Больницы Центросоюза РФ со следующиими рекомендациями:
- метотрексат 20 мг внутрь или внутримышечно 1 раз/нед длительно с последующей оценкой ответа по снижению секреции СЛЦ и количества лимфоцитов крови. Предполагалось, что последовательное подавление лейкемического Т-клеточного клона опосредованно будет влиять на таргетную популяцию секретирующих плазматических клеток. В дальнейшем, при улучшении состояния пациентки, возможно обсуждение химиотерапии, направленной на эрадикацию клона плазматических клеток;
- доксициклин 100 мг 2 раза/сут длительно (по данным одного исследования, этот антибиотик опосредует разрушение амилоида) [10];
- эмпаглифлозин 10 мг утром;
- бисопролол 2,5 мг утром;
- спироналоктон 25 мг утром;
- торасемид 5 мг утром.
В соответствии с алгоритмом диагностики амилоидной кардиомиопатии в случае отсутствия гистологического подтверждения амилоидоза экстракардиальной локализации необходимо проведение эндомиокардиальной биопсии. В нашем клиническом случае выполнение данного исследования невозможно из-за тяжести состояния пациентки и прогрессировании сердечной недостаточности.
ОБСУЖДЕНИЕ
К особенностям описанного клинического случая следует отнести критически долгий путь к правильному диагнозу, что можно объяснить, с одной стороны, нетипичной клинической симптоматикой в дебюте заболевания, с другой – переоценкой отрицательных результатов высокотехнологичных методов диагностики (МРТ сердца с гадолинием, гистологическое исследование). Несмотря на наличие сочетания патогномоничных клинических и лабораторно-инструментальных признаков (гипертрофический паттерн ЭхоКГ при низковольтажной ЭКГ, интактные коронарные артерии по коронарографии, наличие моноклональной секреции по иммунохимии, значительное повышение натрийуретических пептидов диспропорционально степени ХСН), отрицательное заключение МРТ с гадолинием и отсутствие амилоида при биопсии кишечника исключило своевременную диагностику заболевания.
Еще одним диагностическим диссонансом является наличие моноклональной секреции у пациентки с Т-клеточным лейкозом. На сегодняшний день в литературе описаны единичные случаи развития амилоидоза на фоне лимфопролиферативных заболеваний Т-клеточного звена (рис. 7) [11, 12]. Одним из механизмов формирования отложений амилоида при Т-клеточном лейкозе из больших гранулярных лимфоцитов (T-ЛБГЛ) может выступать активация минорного В-клеточного клона либо посредством хронической антигенной стимуляции, либо в результате воздействия иммунных медиаторов, в частности цитокинов.
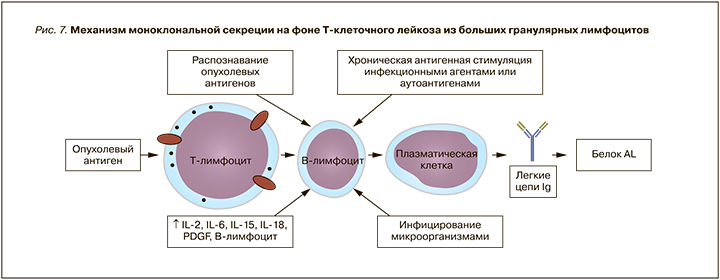
Хроническая антигенная стимуляция инфекционными агентами или аутоантигенами рассматривается в качестве инициирующего события в патогенезе Т-ЛБГЛ, приводящего к поликлональной экспансии лимфоцитов [13]. Однако, поскольку В-лимфоциты осуществляют распознавание и презентацию антигенов, а также являются звеном адаптивного иммунитета, формирование минорного В-клеточного пула возможно еще на начальных этапах развития T-ЛБГЛ [14]. Другой возможный механизм хронической антигенной стимуляции В-клеток – распознавание и презентация В-лимфоцитами опухолевых антигенов прогрессирующего T-ЛБГЛ с последующим формированием противоопухолевого иммунного ответа [15]. Поскольку к одним из иммунопатологических аспектов течения T-ЛБГЛ относят хроническое воспаление с последующим постепенным истощением иммунной системы вследствие апоптоза активированных клеточных пулов (не злокачественных) и постепенным снижением эффективности иммунного ответа, пациенты с T-ЛБГЛ становятся более восприимчивы к инфекционным агентам [16]. Как следствие, развитие иммунного ответа при инфицировании микроорганизмами также может способствовать пролиферации минорного В-клеточного клона на фоне прогрессирующего T-ЛБГЛ.
В то же время опухолевая прогрессия сопровождается формированием специфического опухолевого микроокружения. В случае T-ЛБГЛ на этапе поликлональной экспансии лимфоцитов формируется опухолевая «ниша», характеризующаяся локальным увеличением концентрации провоспалительных медиаторов – интерлейина 6 (ИЛ-6), ИЛ-15, ИЛ-2 [16]. Кроме того, активация Т-лимфоцитов в процессе противоопухолевого иммунного ответа также сопровождается секрецией ряда цитокинов (в том числе ИЛ-2, ИЛ-6, ИЛ-15, ИЛ-18) [17]. Указанные иммунные медиаторы, в частности ИЛ-6, способствуют привлечению в очаг поражения иммунокомпетентных клеток и активации В-лимфоцитов, что опосредованно может способствовать пролиферации В-клеточного клона с последующей инициацией классического механизма развития амилоидоза.
ЗАКЛЮЧЕНИЕ
Таким образом, рассмотренный клинический случай показывает нам трудности диагностики амилоидной кардиомиопатии. Своевременно поставленный диагноз амилоидоза сердца крайне важен, так как AL-кардиомиопатия является заболеванием с крайне низким уровнем продолжительности жизни из-за быстрого прогрессирования сердечной недостаточности.



