ВВЕДЕНИЕ
За последние 30 лет было проведено большое количество рандомизированных контролируемых исследований, в которых напрямую (head-to-head RCTs) сравнивалось действие ацетилсалициловой кислоты (АСК) с другими антитромбоцитарными препаратами разных механизмов действия у пациентов с высоким риском сердечно-сосудистых событий. Целью этих исследований (CAPRIE, SYMPHONY, PERFORM, SOCRATES, GLOBAL LEADERS, HOST-EXAM и других с совокупным участием > 80 000 пациентов) было «сместить» АСК с позиции основного антитромботического препарата [1–6]. Однако ни одно из основных исследований III фазы или постмаркетинговых исследований не предоставило однозначных доказательств превосходства в эффективности (и безопасности) других антитромбоцитарных средств над стандартными низкими дозами АСК (75–100 мг) при применении в режиме монотерапии для вторичной профилактики сердечно-сосудистых событий, и ни один из этих препаратов (клопидогрел, тикагрелор, терутробан, сибрафибан и др.) не был одобрен регулирующими органами. Несмотря на большое количество новых данных, АСК по-прежнему занимает ведущее место в лекарственной профилактике атеротромбоза во всем континууме сердечно-сосудистого риска [7].
Известно, что традиционные нестероидные противовоспалительные препараты (НПВП) вызывают побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ). Их гастроинтестинальная токсичность обусловлена в основном ингибированием ферментов циклооксигеназы-1 (ЦОГ-1) и -2 (ЦОГ-2) в слизистой ЖКТ, что нарушает физиологическую роль простаноидов (в частности, ПГЕ2) в цитопротекции слизистой оболочки и восстановлении тканей [8]. При этом местное повреждающее действие данных лекарственных средств на слизистую оболочку ЖКТ не имеет клинически значимого значения в развитии язвенных осложнений, поскольку препараты с кишечнорастворимым покрытием не более безопасны, чем обычные препараты НПВП [8].
Также следует учитывать важную роль активации тромбоцитов в восстановлении тканей [9], поэтому при приеме антитромбоцитарной терапии существующие повреждения слизистой ЖКТ будут заживать медленнее и легче кровоточить. В то же время сниженная биодоступность препаратов низких стандартных доз АСК (75–100 мг) в кишечнорастворимой оболочке и сниженная абсорбция из тонкого кишечника могут приводить к недостаточному ингибированию тромбоцитов [10] и к так называемому феномену отсутствия ответа на стандартные низкие дозы АСК или сниженному ответу на стандартные низкие дозы АСК (межиндивидуальная вариабельность ответа). В рекомендательных документах время от времени появляются упоминания о предпочтительном назначении формы АСК без кишечнорастворимой оболочки или смене режима дозирования АСК в определенных группах пациентов.
Цель статьи – обзор исследований особенностей межиндивидуального ответа на АСК у пациентов высокого риска сердечно-сосудистых событий, которые получают этот препарат с целью вторичной профилактики, в том числе в зависимости от лекарственной формы, анализ того, какое отражение новые данные нашли в клинических рекомендациях, а также освещение практических аспектов применения АСК в России.
ВАРИАБЕЛЬНОСТЬ ОТВЕТА НА АЦЕТИЛСАЛИЦИЛОВУЮ КИСЛОТУ
В последние годы эксперты считают, что резистентности к АСК не существует (поскольку под лекарственной устойчивостью подразумевается отсутствие ответа на препарат даже при увеличении дозы). Гораздо более корректными следует считать термины «индивидуальная степень реакции на АСК» и «межиндивидуальная вариабельность ответа на АСК», которые включают достаточный ответ на стандартные низкие дозы АСК 75–100 мг и в противоположность ему – отсутствие ответа или недостаточный ответ [11].
Согласно данным самого крупного и последнего по времени тематического метаанализа (2020), объединившего 65 исследований (10 729 пациентов), распространенность недостаточного ответа на АСК составила 24,7% (95% доверительный интервал (ДИ): 21,4–28,4) среди лиц с сердечно-сосудистыми заболеваниями [12]. То есть примерно у каждого 4-го пациента, которому показана и назначена терапия АСК, она неэффективна или недостаточно эффективна, и, таким образом, одно из основных звеньев, отвечающих за развитие кардиоваскулярных событий, не блокируется. Известно, что у таких больных по сравнению с пациентами, имеющими достаточный ответ на терапию АСК, шансы развития смерти выше в 6 раз (отношение шансов (ОШ) 5,99; 95% ДИ: 2,28–15,72), крупных сердечно-сосудистых событий (MACE) – в 4 раза (ОШ 3,85; 95% ДИ: 3,08– 4,80), острого коронарного синдрома – в 4 раза (ОШ 4,06; 95% ДИ: 2,96– 5,56), тромбоза стента – в 4 раза (ОШ 4,35; 95% ДИ: 2,26–8,37) [13].
Касаясь причин сниженного или отсутствующего ответа на прием стандартных низких доз АСК (75–100 мг в день), стоит напомнить, что причина как таковая – это прямой механизм, приводящий к тому или иному состоянию. Вместе с тем, помимо причины, уместно также выделять факторы риска, т. е. обстоятельства, способные увеличить вероятность наступления данного события. Основные причины и факторы риска отсутствующей или недостаточной эффективности низких доз АСК представлены на рисунке 1.

Несмотря на большое количество когортных исследований, посвященных изучению факторов риска (предикторов) развития отсутствия ответа или недостаточного ответа на стандартные низкие дозы АСК, в настоящее время не создано ни одного одобренного и валидированного инструмента для оценки вероятности возникновения этого феномена. Тем не менее некоторые попытки в этом направлении все же были. Так, Cao J. et al. (2016) разработали шкалу риска отсутствия ответа на АСК у пожилых пациентов со стабильной ишемической болезнью сердца (ИБС) [14]. Другие китайские ученые создали аналогичную шкалу ASR-CN (Aspirin Resistance in Chinese population) для нейрохирургических пациентов (2024) [15], также в Китае была опубликована работа, содержащая шкалу для прогнозирования указанного риска у больных с ишемическим инсультом (2025) [16].
Вариабельность ответа на АСК зависит от многих причин и факторов, которые редко учитываются в реальной клинической практике при назначении этого антиагреганта. В то же время четверть пациентов, получающих АСК, имеют недостаточный на нее ответ, что вносит весомый вклад в частоту развития крупных сердечно-сосудистых событий.
Методы определения ответа на ацетилсалициловую кислоту
Другой достаточно сложный вопрос после выделения группы пациентов, у которых может быть снижен ответ на АСК из-за отсутствия универсальных инструментов оценки риска развития этого феномена, – само определение ответа на АСК. Существует множество тестов, позиционируемых как способы определения эффективности АСК, но ни один из них не является «золотым стандартом» [17]. Все используемые в практике методы можно разделить на 2 основные группы: оценка агрегации тромбоцитов и оценка синтеза тромбоксана А2 (ТхА2). Среди экспертов также нет консенсуса, какой тест предпочтителен: как правило, в работах каждой экспертной группы выражается мнение, что какой-то тест, на ее взгляд, лучше. Например, Clerici B. et al. [18] считают, что наиболее точна оценка синтеза TxA2 путем определения его метаболита тромбоксана B2 (TxB2) в сыворотке крови, тогда как Cofer L.B. et al. [19] полагают, что следует выбирать методы, оценивающие агрегацию тромбоцитов, поскольку они доступнее и имеют больший опыт практического применения.
Наиболее часто используемые тесты для оценки ответа АСК приведены на рисунке 2.
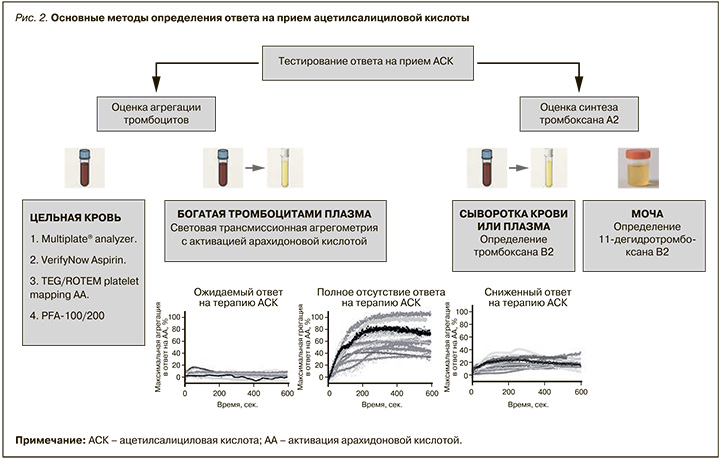
Основная проблема тестирования ответа на прием АСК состоит в том, что результаты применения разных методов плохо соотносятся между собой и чаще дискордантны, что было неоднократно показано в исследованиях [20], а отсутствие «золотого стандарта» или эталонного теста затрудняет изучение диагностической точности каждой методики.
Связь недостаточного ответа на АСК с приемом ее кишечнорастворимых форм
Одним из основных модифицируемых факторов риска развития недостаточного ответа на прием стандартных низких доз АСК (75–100 мг в день) считается наличие у таблеток кишечнорастворимого покрытия. В таблице 1 представлены ключевые исследования по этой теме.

Несмотря на то что большинство работ показало, что кишечнорастворимое покрытие уменьшает лабораторную эффективность АСК, прямых исследований по его влиянию на клинические исходы практически нет. Во вторичном анализе исследования ADAPTABLE (n = 10 678) было показано, что применение кишечнорастворимой формы АСК не увеличивает риск развития смерти от любой причины, инфаркта или инсульта (скорректированное отношение рисков 0,94; 95% ДИ: 0,80–1,09, p = 0,400). Однако этот анализ не был запланирован изначально, а исследование содержит значительные ограничения (данные о применяемой форме АСК имелись только у 70,1% пациентов; комплаенс приема конкретной формы АСК не оценивался – участники могли самостоятельно менять лекарственную форму препарата и не сообщать об этом исследователю), поэтому к его результатам следует относиться скептически, и они, безусловно, требуют подтверждения в новых исследованиях [27].
Лекарственные формы ацетилсалициловой кислоты в дозировках до 100 мг
Основные пероральные формы низкодозированной АСК в зависимости от места всасывания в ЖКТ представлены в таблице 2.

Среди всех вариантов пероральной АСК в дозах 75–100 мг без кишечнорастворимой оболочки для регулярного приема в России зарегистрирована и доступна только буферная форма АСК.
ОТРАЖЕНИЕ НОВЫХ ДАННЫХ В РЕКОМЕНДАТЕЛЬНЫХ ДОКУМЕНТАХ
Хотя, как уже говорилось выше, абсолютно убедительных данных о вреде кишечнорастворимой оболочки АСК в настоящий момент нет, в некоторых рекомендательных документах нашли отражение как тренды, полученные в небольших исследованиях, так и сведения о том, что доказательства пользы такой лекарственной формы тоже сомнительны.
В 2018 г. рабочая группа по изучению тромбоза Европейского общества кардиологов (European Society of Cardiology) выпустила документ, оформленный как экспертное мнение, где было указано, что при лечении пациентов с весом > 120 кг или индексом массы тела > 35 кг/м2 следует отдавать предпочтение простой форме АСК [10].
В 2024 г. рабочая группа российских экспертов также внесла в действующие клинические рекомендации по стабильной ИБС информацию о том, что больным с указанным весом и индексом массы тела предпочтительно назначать простую форму АСК [28].
Наконец, в нынешнем году рабочая группа Американской ассоциации сердца и Американского колледжа кардиологов (American Heart Association, American College of Cardiology) выпустили гайдлайны по ведению пациентов с острым коронарным синдромом, где во всех группах пациентов рекомендуется использовать АСК в дозе 75–100 мг без кишечнорастворимого покрытия [29].
ЗАКЛЮЧЕНИЕ
Такое явление, как «недостаточный ответ на стандартные низкие дозы АСК 75–100 мг в день», очень распространено на практике, а его влияние на прогноз очевидно: возможно, это одна из ведущих причин развития сердечно-сосудистых событий у пациентов высокого, очень высокого и даже экстремального кардиоваскулярного риска. Несмотря на это, эффективных инструментов, которые помогают оценить вероятность развития данного феномена и предотвратить его, в настоящий момент не разработано, хотя соответствующие факторы риска известны и воспроизводимы от исследования к исследованию. При этом, даже если знать, что пациент находится в группе риска, диагностировать недостаточный ответ на АСК в реальной клинической практике довольно трудно, поскольку отсутствуют достоверные знания о точности диагностических тестов и, как следствие, возможности их применения. Рациональным в настоящее время представляется применение таких форм АСК, которые характеризуются минимальным риском развития недостаточного ответа на это лекарственное средство, по крайней мере до тех пор, пока не появятся новые данные. Из зарегистрированных в России лекарственных форм в настоящий момент этому условию соответствует только буферная форма АСК, представителем которой является препарат Кардиомагнил (оригинальная комбинация АСК и магния гидроксида).
ПЕРСПЕКТИВЫ
Мы полагаем, что в клинической практике существует потребность в валидированном инструменте для оценки риска развития недостаточного ответа на АСК в виде удобной шкалы или калькулятора. Другой важный аспект – продолжение изучения лабораторных методов определения эффективности АСК, их диагностической точности и показаний к применению (возможно, на основе результатов прогностической шкалы). Также имеющиеся данные не дают однозначного понимания о потенциальном вреде кишечнорастворимых покрытий при приеме препаратов АСК, в связи с чем необходимо проведение крупных исследований, включающих разные популяции пациентов, где оценивалось бы влияние таких покрытий на частоту клинических исходов.



