2.1 Постковидный синдром: определение, критерии, тактика ведения пациента (С.Н. Авдеев)
Определение
Пост-COVID синдром – состояние, характеризующееся сохранением клинических симптомов более четырех недель с момента появления острых симптомов COVID-19.
Центр по контролю за заболеваниями (CDC) предложил понятие «пост-COVID- состояния», чтобы описать проблемы со здоровьем, которые сохраняются более четырех недель после заражения COVID-19 [1]. «Пост-COVID-состояния» включают:
- длительный COVID (Long COVID), который состоит из широкого спектра симптомов, которые могут длиться от нескольких недель до месяцев;
- мультиорганные эффекты COVID-19;
- последствия лечения/ госпитализации COVID-19.
Типичными клиническими симптомами «длительного COVID» являются утомляемость, одышка, усталость, снижение памяти, вегетативная дисфункция, головная боль, стойкая потеря обоняния или вкуса, кашель, депрессия, субфебрильная температура, учащенное сердцебиение, головокружение, мышечные боли и боли в суставах.
Мультиорганные эффекты COVID-19 включают клинические проявления, относящиеся к сердечно-сосудистой, респираторной, почечной и нервно-психиатрической системам органов, хотя продолжительность этих мультиорганных системных эффектов неясна.
Долгосрочные «эффекты лечения или госпитализации COVID-19» аналогичны другим тяжелым инфекциям. К ним относятся синдром после интенсивной терапии (PICS), приводящий к крайней слабости и посттравматическому стрессовому расстройству.
Многие пациенты с этими осложнениями COVID-19 со временем выздоравливают. Основываясь на хронологии симптомов после заражения COVID-19, «Пост-COVID- состояния» классифицируются следующим образом:
- подострые или персистирующие симптомы COVID-19 (до 12 недель с момента первоначального острого эпизода);
- хронический или пост-ковидный синдром, симптомы проявляются после 12 недель от начала заболевания, и эти симптомы не должны быть связаны с альтернативным диагнозом [1].
Эпидемиология
Основываясь на данных нескольких исследований (обзервационные и проспективные когортные исследования) из Китая, Франции, Испании, Великобритании, США, Италии, России, в которых оценивались долгосрочные последствия COVID-19, было показано, что пациенты, которым требовалась госпитализация в ОРИТ и / или искусственная вентиляция легких (ИВЛ), имеют повышенный риск развития пост-острого синдрома COVID-19 [2].
Считается, что пациенты пожилого возраста, с ранее существовавшими легочными заболеваниями, и ожирением, имеют повышенный риск развития пост-острого синдрома COVID-19 [3]. Пациенты женского пола, выздоравливающие от COVID-19, были более склонны к развитию симптомов пост-острого синдрома COVID-19, особенно утомляемости, беспокойства и депрессии, через 6 месяцев наблюдения [4].
Критерии диагностики
По данным одного из первых наблюдательного когортного исследования, в которым проводилось наблюдение за 488 пациентами после госпитализации из-за COVID-19, наиболее частыми симптомами пост-COVID-19 синдрома являются одышка, кашель и потерей вкуса или запаха (32% пациентов), Результаты этого исследования также показали, что уровень повторной госпитализации составляет 15%, а уровень смертности - 6,7% [6]. В другом исследовании, в котором оценивали 110 пациентов с COVID-19 после выписки из госпитализации в связи COVID-19 в течение 90 дней, наиболее частыми симптомами были утомляемость и одышка (39%), за которыми следовали нарушение сна (24%), боль в груди (12%) и кашель (11%) [7].
Респираторные проявления:
- одышка, кашель, зависимость от кислорода, фибротические изменения в легких (ретикулярные изменения, паренхиматозные тяжи, изменения по типу матового стекла), снижение диффузионной способности и снижение физической выносливости – частые легочные последствия, наблюдаемые у пациентов с пост-COVID-19 синдромом;
- одышка является преобладающим легочным симптомом (распространенность от 40% до 50% в течение 100 дней) после COVID-19. При 6-месячном наблюдении среднее дистанция в тесте с 6-минутной ходьбой было значительно ниже должных величин из-за одышки. Около 6% пациентов, по-прежнему, нуждаются в дополнительном кислороде через 60 дней наблюдения [5].
Сердечно-сосудистые проявления: прямая вирусная цитотоксичность, подавление активности рецептора ACE2, иммуноопосредованное воспаление, влияющее на миокард и перикард, являются наиболее частыми механизмами сердечно-сосудистых поражений, приводящих к клиническим последствиям, таким как одышка, утомляемость, миокардит, снижение сердечного резерва, нарушение регуляции ренин-ангиотензин-альдостероновой системы (РААС), вегетативная дисфункция и аритмии [8].
Гематологические проявления: гипоксия, повреждение эндотелия, активация тромбоцитов, провоспалительные цитокины приводят к непропорционально высокой частоте венозных тромбозов и эмболий при остром COVID-19 [9]. Как продолжительность, так и тяжесть гипервоспалительного состояния увеличивают риск тромботических осложнений после COVID-19.
Психоневрологические проявления: предполагается, что микроваскулярные тромбы, системное воспаление, прямая вирусно-опосредованная нейротоксичность являются возможными механизмами, способствующими персистирующим психоневрологическим проявлениям после COVID-19. Дизавтономия, дезорганизация и посттравматическое стрессовое расстройство могут способствовать возникновению когнитивной дисфункции после COVID-19. Длительное пребывание в ОРИТ, длительная интубация в значительной степени способствуют долгосрочным когнитивным нарушениям у пациентов с COVID-19 [10].
Эндокринные проявления: вирусное повреждение, воспалительное и иммунологическое повреждение способствуют пост-COVID-19 эндокринным проявлениям. Сообщения об отдельных случаях диабетического кетоацидоза, подострого тиреоидита и тиреоидита Хашимото были зарегистрированы через несколько недель после исчезновения острых симптомов COVID-19 [11,12]. Иммобилизация, прием стероидов, дефицит витамина D во время острого и пост-острого выздоровления от COVID-19 могут способствовать деминерализации костей.
Мультисистемный воспалительный синдром у детей (MIS-C). MIS-C – это новое клиническое заболевание, характеризующееся лихорадкой, полиорганной дисфункцией, повышенными воспалительными маркерами, наблюдаемыми у лиц младше 21 года, с недавней или текущей инфекцией SARS-CoV-2. Наиболее вероятным основным механизмом приобретенный иммунный ответ в результате активации комплемента, образования аутоантител (мимикрия вируса-хозяина) и избыточных цитокинов в результате стимуляции Т-клеток [13].
Общие подходы к ведению пациентов
- Пост-COVID синдром можно рассматривать как мультисистемное расстройство, обычно проявляющееся респираторными, сердечно-сосудистыми, гематологическими и нейропсихиатрическими симптомами, либо по отдельности, либо в сочетании. Таким образом, терапия должна быть индивидуальной и включать междисциплинарный подход, направленный на решение как клинических, так и психологических аспектов этого расстройства.
- Следует оптимизировать лечение сопутствующих состояний, таких как диабет, хроническая болезнь почек, гипертония [14].
- Пациенты должны быть обучены самоконтролю в домашних условиях с помощью портативных устройств (пульсоксиметр, тонометр и глюкометр).
- Пациентов следует поощрять к здоровому сбалансированному питанию, поддержанию надлежащей гигиены сна, ограничению употребления алкоголя и отказу от курения [15].
- При необходимости следует рассмотреть возможность простого обезболивания ацетаминофеном.
- При переносимости следует рекомендовать структурированную программу упражнений, состоящую из компонентов аэробики и сопротивления, при условии, что они не являются противопоказанными [16].
- Пациентам со стойкими симптомами может быть полезно участие в программе реабилитации (с упором на сердечно-легочные последствия, психологическое бремя и усталость), которая имеет ключевое значение для более быстрого клинического выздоровления
- Пациентам после COVID-19 рекомендована вакцинация против гриппа и Streptococcus
- Необходимо тщательное наблюдение за всеми пациентами с COVID-19 во время выздоровления, чтобы разработать командный подход к пониманию этого сложного и развивающегося кризиса в области здравоохранения и управлению им.
- Ведение пост-острого синдрома COVID-19 требует целостного и междисциплинарного командного подхода, который включает врачей разных специальностей (первичная помощь, пульмонология, кардиология, инфекционные заболевания), физиотерапевтов, экспертов по поведенческому здоровью, физиотерапевтов и социальных работников.
Прогноз
Прогноз этого нового клинического состояния неизвестен и, вероятно, зависит от тяжести клинических симптомов, сопутствующих заболеваний и реакции на лечение. Необходимы дополнительные клинические исследования для оценки пациентов, перенесших COVID- 19, чтобы понять продолжительность и долгосрочные эффекты этого нового клинического синдрома.
Литература
- Nalbandian A, Sehgal K, Gupta A, Madhavan MV, McGroder C, Stevens JS, Cook JR, Nordvig AS, Shalev D, Sehrawat TS, Ahluwalia N, Bikdeli B, Dietz D, Der-Nigoghossian C, Liyanage-Don N, Rosner GF, Bernstein EJ, Mohan S, Beckley AA, Seres DS, Choueiri TK, Uriel N, Ausiello JC, Accili D, Freedberg DE, Baldwin M, Schwartz A, Brodie D, Garcia CK, Elkind MSV, Connors JM, Bilezikian JP, Landry DW, Wan EY. Post-acute COVID-19 Nat Med 2021; 27(4): 601-615.
- Michelen M, Manoharan L, Elkheir N, et al. Characterising long COVID: a living systematic BMJ Global Health 2021; 6: e005427. doi:10.1136/bmjgh-2021-005427
- Halpin S, O'Connor R, Sivan M. Long COVID and chronic COVID syndromes. J Med Virol. 2021 Mar;93(3):1242-1243.
- Huang C, Huang L, Wang Y, Li X, Ren L, Gu X, Kang L, Guo L, Liu M, Zhou X, Luo J, Huang Z, Tu S, Zhao Y, Chen L, Xu D, Li Y, Li C, Peng L, Li Y, Xie W, Cui D, Shang L, FanG, Xu J, Wang G, Wang Y, Zhong J, Wang C, Wang J, Zhang D, Cao B. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet 2021; 16; 397(10270): 220-232.
- Halpin SJ, McIvor C, Whyatt G, Adams A, Harvey O, McLean L, Walshaw C, Kemp S, Corrado J, Singh R, Collins T, O'Connor RJ, Sivan M. Postdischarge symptoms and rehabilitation needs in survivors of COVID-19 infection: A cross-sectional evaluation. J Med Virol 2021; 93(2): 1013-1022.
- Chopra V, Flanders SA, O'Malley M, Malani AN, Prescott HC. Sixty-Day Outcomes Among Patients Hospitalized with COVID-19. Ann Intern Med 2021; 174(4): 576-578.
- Arnold DT, Hamilton FW, Milne A, Morley AJ, Viner J, Attwood M, Noel A, Gunning S, Hatrick J, Hamilton S, Elvers KT, Hyams C, Bibby A, Moran E, Adamali HI, Dodd JW, Maskell NA, Barratt SL. Patient outcomes after hospitalisation with COVID-19 and implications for follow-up: results from a prospective UK cohort. Thorax 2021; 76(4): 399-401.
- Wu Q, Zhou L, Sun X, Yan Z, Hu C, Wu J, Xu L, Li X, Liu H, Yin P, Li K, Zhao J, Li Y, Wang X, Li Y, Zhang Q, Xu G, Chen H. Altered Lipid Metabolism in Recovered SARS Patients Twelve Years after Infection. Sci Rep 2017; 7(1):
- Chaudhary R, Kreutz RP, Bliden KP, Tantry US, Gurbel PA. Personalizing Antithrombotic Therapy in COVID-19: Role of Thromboelastography and Thromboelastometry. Thromb Haemost 2020; 120(11): 1594-1596.
- Kaseda ET, Levine AJ. Post-traumatic stress disorder: A differential diagnostic consideration for COVID-19 survivors. Clin Neuropsychol 2020; 34(7-8): 1498-1514.
- Brancatella A, Ricci D, Viola N, Sgrò D, Santini F, Latrofa F. Subacute Thyroiditis After Sars-COV-2 J Clin Endocrinol Metab 2020; 105(7)
- Rubino F, Amiel SA, Zimmet P, Alberti G, Bornstein S, Eckel RH, Mingrone G, Boehm B, Cooper ME, Chai Z, Del Prato S, Ji L, Hopkins D, Herman WH, Khunti K, Mbanya JC, Renard
- New-Onset Diabetes in Covid-19. N Engl J Med 2020; 383(8): 789-790.
- Jiang L, Tang K, Levin M, Irfan O, Morris SK, Wilson K, Klein JD, Bhutta ZA. COVID-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis 2020; 20(11): e276-e288.
- Greenhalgh T, Knight M, A'Court C, Buxton M, Husain L. Management of post-acute covid- 19 in primary care. BMJ 2020; 370:
- Mendelson M, Nel J, Blumberg L, Madhi SA, Dryden M, Stevens W, Venter FWD. Long- COVID: An evolving problem with an extensive S Afr Med J 2020; 111(1): 10-12.
- Dani M, Dirksen A, Taraborrelli P, Torocastro M, Panagopoulos D, Sutton R, Lim PB. Autonomic dysfunction in 'long COVID': rationale, physiology and management strategies. Clin Med (Lond) 2021; 21(1): e63-e67.
2.2 Функциональное состояние респираторной системы в постковидном периоде (Т.В. Глушкова, И.В. Лещенко, С.Н. Скорняков)
Функциональные респираторные нарушения являются одними из наиболее часто регистрируемых проявлений постковидного синдрома [1,2]. Определено, что функциональные респираторные нарушения были у больных с тяжелой формой CОVID- 19 в анамнезе и среди больных, нуждающихся в респираторной поддержке (ВПО/НИВЛ/ИВЛ) в остром периоде заболевания. Результаты мета-анализа 30 исследований, посвященных изучению распространенности функциональных респираторных нарушений при постковидном синдроме показали, что, наиболее часто регистрируемым показателем из них, являлась диффузионная способность легких, определяемая по монооксиду углерода (DLco) [3]. Установлено падение Dlco ниже должных величин при постковидном синдроме в 39% и в 31% случаев (через 6 месяцев и через 12 месяцев, соответственно) [3]. В годовом наблюдении, уровень Dlco<80% от должного определялся в 23-54% случаях, среди больных после респираторной поддержки в остром периоде COVID-19 [4]. Снижение уровня общей емкости легких (ОЕЛ) отмечено у пациентов, потребовавших проведения НИВЛ/ИВЛ и составило 13% и 9% на 6 и 12 месяцах постковидного синдрома, соответственно [4].
Снижение уровня форсированной жизненной емкости (ФЖЕЛ), выявлено только в 12 и 6% случаев через 6 и 12 месяцев, соответственно [3]. Объем форсированного выдоха за первую секунду (ОФВ1) у больных в постковидном периоде регистрировался в пределах нормальных величин [1,5]. Исключение составили пациенты после НИВЛ/ИВЛ среди которых зарегистрировано снижение ОФВ1 в 14 и 6% случаях через 6 и 12 месяцев, соответственно [4].
В постковидном периоде предлагается обращать внимание на тяжесть перенесенной COVID-19, пребывание в отделении реанимации и интенсивной терапии (ОРИТ), а также развитие острого респираторного дистресс-синдрома (ОРДС), как одного из серьезнейших и жизнеугрожающих осложнений острого периода заболевания [6-8]. Стадии ОРДС, а также характеристика степеней тяжести COVID-19 представлены в соответствующих разделах настоящих клинических рекомендаций.
В проведенном 6-месячном исследовании пациентов, перенесших COVID-19 среднетяжелой и тяжелой степени тяжести, получены результаты, согласующиеся с вышеприведенными данными литературы. Результаты функциональное исследование респираторной системы, проведенное через 93 (89-103) и 180 (135-196) дней постковидного синдрома представлены в таблице [9].
Кроме того, установлено снижение отношения Dlco к альвеолярному объему (Dlco/VA) - коэффициент переноса СО (Kco), у пациентов, представленных в исследовании (см. таблицу) и свидетельствующее о паренхиматозных нарушениях и о нарушении микроциркуляции в системе легочных сосудов [9, 10].
|
Таблица. Результаты функционального исследования дыхательной системы на 93 (89-103) и 180 (135-196) дни постковидного синдрома в зависимости от тяжести перенесенной COVID-19 [9] |
||||||
|
Тяжесть COVID-19 |
93-й (89-103) день |
|||||
|
ОФВ1, %долж. |
ФЖЕЛ, %долж. |
ОЕЛ, %долж. |
Dlco, %долж. |
Dlco, <80% долж. n=50 |
Dlco/VA, %долж. |
|
|
Среднетяжелая |
107 |
107 |
96 |
72 |
66 |
82 |
|
форма (n=36)¹ |
(97-124) |
(101-124) |
(83-109) |
(65-83) |
(56-71) |
(76-90) |
|
|
|
|
|
|
n=24 |
|
|
Тяжелая |
100 |
104 |
79 |
56 |
52 |
75 |
|
форма (n=29)² |
(94-116) |
(84-115) |
(68-91) |
(45-70) |
(44-64) |
(67-82) |
|
|
|
|
|
|
n=26 |
|
|
p¹¯² |
|
|
0,002 |
0,001 |
0,011 |
0,004 |
|
180-й (135-196)-день |
||||||
|
Тяжесть COVID- |
ОФВ1, |
ФЖЕЛ, |
ОЕЛ, |
Dlco, |
Dlco, |
Dlco/VA |
|
19 |
%долж. |
%долж. |
%долж. |
%долж. |
<80% |
%долж. |
|
|
|
|
|
|
долж. |
|
|
|
|
|
|
|
n=27 |
|
|
Среднетяжелая |
103 |
108 |
93 |
70 |
66 |
84 |
|
форма(n=16)¹ |
(91-118) |
(102-126) |
(82-103) |
(62-73) |
(59-71) |
(81-79) |
|
|
|
|
|
|
n=15 |
|
|
Тяжелая |
105 |
107 |
88 |
60 |
50 |
77 |
|
форма(n=15)² |
(98-111) |
(95-111) |
(82-100) |
(54-70) |
(47-59) |
(74-81) |
|
|
|
|
|
|
n=12 |
|
|
p¹¯² |
|
|
|
|
0,04 |
0,027 |
Таким образом, проведенный анализ данных литературы и результаты приведенного исследования позволяет определить факторы, предрасполагающие к респираторным функциональным нарушениям в течение 6-месячного постковидного периода:
- тяжесть перенесенной COVID-19;
- ОРДС;
- пребывание в ОРИТ;
- респираторная поддержка (ВПО/НИВЛ/ИВЛ).
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
В заявлении экспертов Европейского респираторного общества, посвященного длительному наблюдению за COVID-19 и включающего анализ накопленного фактического материала при постковидном синдроме, мы находим подтверждение вынесенным положениям о возможных факторах функциональных респираторных нарушений [11].
Литература
- Wu X., Liu X., Zhou Y. et al. 3-month, 6-month, 9-month, and 12-month respiratory outcomes in patients following COVID-19-related hospitalisation: a prospective Lancet Respir. Med. 2021; 9: 747–754. DOI:10.1016/S2213-2600(21)00174-0
- Chippa V., Aleem A., Anjum F. Post Acute Coronavirus (COVID-19) Syndrome. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan.
- Lee J.H., Yim J.J., Park J. Pulmonary function and chest computed tomography abnormalities 6-12 months after recovery from COVID-19: a systematic review and meta-analysis. Res. 2022; 23(1): 233. DOI: 10.1186/s12931-022-02163-x.
- Huang L, Yao Q, Gu X, et al. 1-year outcomes in hospital survivors with COVID-19: a longitudinal cohort study [published correction appears in Lancet. 2022; 399(10337): 1778. 2021; 398(10302): 747-758. DOI: 10.1016/S0140-6736(21)01755-4
- Magdy D.M., Metwally A., Tawab D.A. et al. Long-term COVID-19 effects on pulmonary function, exercise capacity, and health status. Ann. Thorac. Med. 2022; 17(1): 28-36. DOI: 4103/atm.atm_82_21.
- Huang L., Li X., Gu X. et al. Health outcomes in people 2 years after surviving hospitalisation with COVID-19: a longitudinal cohort study. Lancet Respir. Med. 2022: S2213-2600(22)00126- DOI: 10.1016/S2213-2600(22)00126-6.
- Long Q., Li J., Hu X. et al. Follow-Ups on Persistent Symptoms and Pulmonary Function Among Post-Acute COVID-19 Patients: A Systematic Review and Meta-Analysis. Front Med (Lausanne). 2021; 8:702635. DOI: 3389/fmed.2021.702635.
- Ekbom E., Frithiof R., Emilsson Öi. et al. EImpaired diffusing capacity for carbon monoxide is common in critically ill Covid-19 patients at four months post-discharge. Respir Med. 2021; 182: DOI: 10.1016/j.rmed.2021.106394.
- Лещенко И.В., Глушкова Т.В. Клинико-функциональная характеристика постковидного периода, 6-месячное наблюдение. Пульмонология. 2022; 6 (принято в печать)
- Hanidziar D., Robson S.C. Hyperoxia and modulation of pulmonary vascular and immune responses in COVID-19. Am. J. Physiol. Lung Cell. Mol. Physiol. 2021; 320(1): L12-L16. DOI: 1152/ajplung.00304.2020.
- Antoniou K.M., Vasarmidi E., Russell A.M. et al. European Respiratory Society statement on long COVID follow-up. Eur. Respir. J. 2022; 60(2): 2102174. DOI: 1183/13993003.02174-2021.
2.3 Патоморфология повреждения легких после острого периода COVID-19 (О.В. Зайратьянц, М.В. Самсонова, А.Л. Черняев)
В легких умерших от разных причин после перенесенного COVID-19 в 52,6% наблюдений были обнаружены участки с обтурирующими, как правило, фибриновыми, тромбами в мелких ветвях легочной артерии и в капиллярах межальвеолярных перегородок (МАП), в 5,3% наблюдений были обнаружены многоствольные сосуды, что свидетельствует о реканализации тромбов, в 10,5% - наблюдали ангиоматоз. В ткани легких, в зонах тромбоза в микроциркуляторном русле, имели место: полнокровие (расширение) капилляров межальвеолярных перегородок со стазом и слаждем эритроцитов в 68,4%, в 61,1% внутриальвеолярный отек - в 37,6% встречались единичные гиалиновые мембраны. В 42,1% наблюдений имели место кровоизлияния и скопления небольшого числа сидерофагов в просветах альвеол или небольшие геморрагические инфаркты, в 26,3% обнаруживали фибрин в просветах альвеол. В 31,6% наблюдений в стенках мелких ветвей легочной были обнаружены плазматическое пропитываниея и фибриноидное набухание. Кроме того, были выявлены: в 42,1% очаговая организующаяся пневмония и неспецифическая интерстициальная пневмония (НСИП), в 15,8% - очаги костной метаплазии среди новообразованной соединительной ткани.
В отдельных случаях выявляли формирование тонкостенных легочных кист, вероятно, вследствие ремоделирования ткани легких, особенно после внутриальвеолярных кровоизлияний. Редко они были причиной развития спонтанного пневмоторакса.
Литература
- Зайратьянц О.В. (ред.), Каниболоцкий А.А., Михалева Л.М., Мишнев О.Д., Савелов Н.А., Авдалян А.М., Астахова О.И., Варясин В.В., Волков А.В., Волобуева Е.А., Даабуль А.С., Добряков А.В., Золотенкова Н.В., Келли Е.И., Медников Г.Н., Орехов О.О., Петрова С.Ю., Тишкевич О.А., Цыганов С.Е. Новая коронавирусная инфекция (COVID-19). Организация работы московской патологоанатомической службы. Временные методические рекомендации ДЗМ, Москва, (Версия 4 от 28.10.2021).
- Самсонова М.В., Конторщиков А.С., Черняев А.Л., Михайличенко К.Ю., Михалева Л.М., Мишнев О.Д., Зайратьянц О.В. Патогистологические изменения в легких в отдаленные сроки после COVID-19. Пульмонология. 2021; 31 (5): 571–579. DOI:10.18093/0869-0189-2021-31-5-571-579.
2.4 Оценка изменений после перенесенного COVID-19 по данным лучевой диагностики (И.Е. Тюрин)
Рекомендации:
- В заключениях по данным рентгенологических исследований (рентгенография и КТ), проведенных после выписки пациентов с COVID-19, выявленных изменения рекомендовано определять как остаточные изменения после перенесенной коронавирусной (вирусной) пневмонии и избегать употребления терминов фиброз (пневмофиброз) или склероз (пневмосклероз) в связи с отсутствием доказательной базы для такой характеристики.
Изменения в легких у пациентов, перенесших COVID-19, наблюдаются при КТ через 3 месяца у 78% пациентов, через 6 месяцев у 48% и через 12 месяцев у 27%. Наиболее часто изменения в отдаленные сроки сохраняются у пациентов после лечения в отделениях ОРИТ с применением ИВЛ, в связи с крайне тяжелым течением заболевания и с обширным поражением легочной ткани.
Изменения в легких после перенесенной коронавирусной пневмонии обычно представляют собой обратное развитие (разрешение) организующейся пневмонии. Этот вид интерстициальной пневмонии формируется как типичный морфологический ответ легочной ткани на диффузное альвеолярное повреждение, вызванное вирусной инфекцией. Признаки организующейся пневмонии в острый период заболевания при рентгенографии и КТ описаны выше.
Опубликованные в настоящее время исследования содержат сведения о больных, перенесших коронавирусную пневмонию в течение не более одного года. В связи с этим судить об изменениях в более отдаленные сроки затруднительно.
Изменения в легких в течение первого года после перенесенной коронавирусной инфекции включают:
- Участки уплотнения легочной ткани по типу матового стекла, обычно расположенные в кортикальных отделах легких.
- Зоны ретикулярных изменений с видимыми в них расширенными просветами бронхов, тракционными бронхоэктазами.
Относительно толстые линейные участки консолидации и перилобулярные участки уплотнения как этап медленного разрешения организующейся пневмонии.
Линейные уплотнения/линейные ателектазы неправильной формы вдоль реберной плевры
- субплевральные линии
- Нарушение архитектоники (расположения) сосудов и бронхов, уменьшение размеров отдельных долей и сегментов.
В исследованиях показано, что к 12 месяцам наблюдения обычно исчезают ретикулярные изменения и расширенные бронхи, субплевральные линии и линейные тяжи. Остаточные изменения в этот период представлены в основном симптомом матового стекла. Ни у одного пациента не было обнаружено прогрессирование изменений в легких при наблюдении в динамике.
Результаты проведенных исследований не подтверждают развитие фиброза легочной ткани, но и не позволяют полностью исключить такую возможность у крайне ограниченного числа пациентов. В англоязычной литературе эти изменения часто определяются как «fibrotic-like changes» - фиброзоподобные или напоминающие фиброз [Martini, K., et al].
Не выявлено закономерностей в характере и объеме изменений легочной ткани при рентгенологическом исследовании и типе нарушений функции дыхания, в частности выраженности одышки, бронхиальной обструкции, снижения форсированную жизненную емкость легких и других показателей.
В связи с отсутствием доказательной базы, изменения в легких у пациентов, перенесших коронавирусную инфекцию, нецелесообразно определять как фиброз, в том числе как фиброзные изменения, остаточный фиброз, постковидный фиброз и др. В заключениях по данным проведенных рентгенологических исследований данную картину целесообразно определять как остаточные изменения после перенесенной коронавирусной (вирусной) пневмонии.
Выявленные остаточные изменения в легких требуют наблюдения в динамике в рамках программ диспансеризации для лиц, перенесших коронавирусную инфекцию. При наличии клинических показаний частота проведения рентгенографии или КТ исследований может быть изменена.
К изменениям в легких в отдаленные сроки не применяются полуколичественные критерии объема поражения («степени тяжести») при КТ и РГ (КТ1-4) в связи с отсутствием данных об их клиническом или прогностическом значении.
- Остаточные изменения в легких после перенесенной коронавирусной инфекции могут быть обусловлены не только основным патологическим процессом – вирусной пневмонией, но и ее осложнениями, что требует тщательной дифференциальной диагностики при рентгенологическом исследовании для исключения гипердиагностики. Остаточные изменения в легких после перенесенной коронавирусной инфекции могут быть следствием как вирусного поражения легочной ткани, так и его осложнениями. К относительно частым можно отнести инфаркты легких при ТЭЛА, бактериальную пневмонию, абсцесс легкого, эмпиему плевры и др. Рентгенологическая картина разрешения этих процессов может существенно отличаться от постковидных изменении□ и описана в специальных руководствах.
2.5 Небактериальные инфекции при COVID-19
2.5.1 Инвазивный кандидоз у пациентов с COVID-19 (Л.З. Болиева, А.Г. Малявин)
Инвазивные микозы у больных новой коронавирусной инфекцией COVID-19 – это тяжелые осложнения с высокой летальностью. Кандидоз является самым распространенным инвазивным микозом у больных с COVID-19 и наблюдается, по данным ряда исследований, с частотой до 10%. Присоединение вторичной грибковой инфекции происходит обычно через семь и более дней госпитализации, летальность составляет более 50% [1-7]. Наиболее частым проявлением инфекции, вызванной грибами рода Candida, является поверхностный кандидоз кожи и слизистых оболочек. Однако, у иммунокомпроментированных пациентов возможна грибковая инвазия в системный кровоток и через стенку кишечника [8].
Частота инвазивного кандидоза у пациентов с COVID-19 высока, даже если они не имеют дополнительных факторов риска [9-13]. Повышает вероятность развития инвазивного кандидоза наличие дополнительных факторов риска, таких как пожилой возраст, сахарный диабет, прием иммуносупрессантов, установка центрального венозного катетера, применение антибактериальных препаратов [14-22]. В ряде работ высказано предположение о возможной связи между применением блокатора рецепторов ИЛ-6 тоцилизумаба и развитием кандидоза [23, 24]. Также опубликованы результаты исследований, в которых на небольшой выборке получено подтверждение повышенного риска развития кандидемии и диссеминированного кандидоза при применении системных глюкокортикостероидов [25, 26].
Клинические признаки кандидемии неспецифичны и практически не отличаются от симптомов бактериального сепсиса: у 95–97% больных отмечается повышение температуры тела выше 38°C, рефрактерное к антибактериальной терапии, у 20–25% - острая дыхательная недостаточность, у 15–25% - инфекционно-токсический шок, у 30– 40% - признаки поражения различных органов. Острый диссеминированный кандидоз возникает в результате гематогенного распространения Candida spp. в организме. При этом возможно поражение практически всех органов и тканей организма, но наиболее часто в патологический процесс вовлекаются легкие, почки, органы зрения, головной мозг, сердце, кости, а также кожа и подкожная клетчатка [27]. У пациентов с инвазивным кандидозом, осложнившим течение новой коронавирусной инфекции COVID-19, описаны такие клинические проявления как лихорадка с ознобом, гипотензия, дезориентация, абдоминальные боли, инфекции мочевых путей, безболезненные пустулезные элементы на коже на фоне эритемы [28-30].
У больных с факторами риска и соответствующими клиническими признаками кандидемии или острого диссеминированного кандидоза диагностические мероприятия следует проводить незамедлительно. Рекомендованные лабораторные и инструментальные исследования приведены в таблице 1 [27].
Показанием для эмпирической терапии COVID-ИК у больных в ОРИТ является резистентная к адекватной терапии антибактериальными ЛС лихорадка продолжительностью более 4 суток, в сочетании с наличием ≥2 факторов риска (длительное применение ЦВК, полное парентеральное питание, применение ГКС или иммуносупрессоров). Всем пациентам с инвазивным кандидозом показано раннее удаление/замена всех внутрисосудистых катетеров и других возможных источников возбудителя (мочевые катетеры, шунты, протезы). Важным компонентом лечения являются устранение или уменьшение выраженности факторов риска (отмена или снижение дозы ГКС, компенсация сахарного диабета и др.). При наличии факторов риска и клинических признаков COVID-ИК эмпирическую терапию следует начинать немедленно.
Препараты выбора для эмпирической терапии всех вариантов COVID-ИК, кроме менингита и эндофтальмита, эхинокандины – анидулафунгин, каспофунгин и микафунгин. Раннее эмпирическое назначение эхинокандинов повышает выживаемость больных ИК. Триазолы (вориконазол, флуконазол) можно назначать только в случае выделения чувствительного к препарату возбудителя COVID-ИК при стабильном состоянии пациента, а также для лечения кандидозного менингита и эндофтальмита.
Кроме того, вориконазол и флуконазол используют для де-эскалационной терапии после стабилизации больного на фоне применения эхинокандина. Липосомальный АмВ или липидный комплекс АмВ применяют в случае неэффективности, токсичности или недоступности эхинокандинов. Амфотерицин В, позаконазол и итраконазол не рекомендованы для лечения COVID-ИК. Продолжительность лечения – не менее 14 суток после исчезновения клинических признаков COVID-ИК и отрицательного посева крови [31].
Таблица 1. Лабораторные и инструментальные методы диагностики инвазивного кандидоза [27]
|
Лабораторные исследования |
Инструментальные исследования |
|
- Повторные посевы крови на специализированные среды (Сабуро, сусло- агар) 2 раза в день в течение не менее 3 дней - Посев дистального фрагмента внутрисосудистого катетера - Прямая микроскопия и посевы доступных биосубстратов с обязательным определением вида возбудителя, выявленного при посеве любого стерильного в норме биосубстрата |
- КТ или рентгенография органов грудной клетки - КТ или УЗИ брюшной полости - Офтальмоскопия с расширением зрачка - Биопсия очагов поражения, прямая микроскопия, посев, гистологическое исследование биопсийного материала с использованием специальных окрасок (PAS, по Грокотту) |
Литература
- Arastehfar A., Carvalho A., Hong Nguyen M. et al. Covid-19-associated candidiasis (Cac): An underestimated complication in the absence of immunological predispositions? Journal of Fungi. 2020; 6: 1-13. doi: 10.3390/jof6040211.
- Chiurlo M., Mastrangelo A., Ripa M., Scarpellini P. Invasive fungal infections in patients with COVID-19: a review on pathogenesis, epidemiology, clinical features, treatment, and outcomes. New 2021; 44(2): 71-83.
- Cuntrò M., Manisco A., Guarneri D. et al. Blood stream infections during the first wave of COVID-19. A short microbiological retrospective picture at Papa Giovanni XXIII Hospital, Bergamo, New Microbiol. 2021; 44(1): 51-58.
- Falcone M., Tiseo G., Giordano C. et al. Predictors of hospital-acquired bacterial and fungal superinfections in COVID-19: a prospective observational study. Journal of Antimicrobial 2021; 76(4):1078-1084. doi: 10.1093/jac/dkaa530.
- Grasselli G., Scaravilli V., Mangioni D. et al. Hospital-acquired infections in critically-ill COVID-19 Chest. 2021; 160(2): 454-465. doi: 10.1016/j.chest.2021.04.002.
- Nucci M., Barreiros G., Guimarães L.F. et al. Increased incidence of candidemia in a tertiary care hospital with the COVID-19 pandemic. Mycoses. 2021; 64: 152-156. doi: 1111/myc.13225.
- Chowdhary A., Tarai B., Singh A., Sharma A. Multidrug Resistant Candida auris Infections in Critically Ill Coronavirus Disease Patients, India, April-July 2020. Infect. Dis. 2020; 26(11): 2694-2696. https://doi.org/10.3201/EID2611.203504.
- Jerez Puebla L.E. Fungal Infections in Immunosuppressed Patients. 2012. https://doi.org/10.5772/51512.
- Nucci M., Barreiros G., Guimarães L.F. et al. Increased incidence of candidemia in a tertiary care hospital with the COVID-19 pandemic. Mycoses. 2021; 64: 152-156. doi: 1111/myc.13225.
- Mastrangelo A., Germinario B.N., Ferrante M. et al. COVID-BioB Study Group. Candidemia in COVID-19 patients: incidence and characteristics in a prospective cohort compared to historical non-COVID-19 controls. Clin Infect Dis. 2021; 73(9): 2838-2839. doi: 1093/cid/ciaa1594.
- Arunachalam P.S., Wimmers F., Mok C.K.P. et al. Systems biological assessment of immunity to mild versus severe COVID-19 infection in humans. Science. 2020; 369: 1210-122. doi: 1126/science.abc6261.
- Lamers M.M., Beumer J., Vaart J. et al. SARS-CoV-2 productively infects human gut Science. 2020; 369: 50-54. doi: 10.1126/science.abc1669.
- Zuo T., Zhan H., Zhang F. et al. Alterations in Fecal Fungal Microbiome of Patients With COVID-19 During Time of Hospitalization until Discharge. Gastroenterology. 2020; 159: 1302- doi: 10.1053/j.gastro.2020.06.048.
- Abelenda-Alonso G., Padullés A., Rombauts A. et al. Antibiotic prescription during the COVID-19 pandemic: A biphasic pattern. Infection Control and Hospital Epidemiology. Infect Control Hosp Epidemiol. 2020; 1–2. doi: 10.1017/ice.2020.381.
- Grasselli G., Scaravilli V., Mangioni D. et al. Hospital-acquired infections in critically-ill COVID-19 Chest. 2021; 160(2): 454-465. doi: 10.1016/j.chest.2021.04.002.
- Guisado-Gil A.B., Infante-Domínguez C., Peñalva G. et al. Impact of the COVID-19 Pandemic on Antimicrobial Consumption and Hospital-Acquired Candidemia and Multidrug- Resistant Bloodstream Infections. Antibiotics (Basel). 2020; 9(11): 816. doi: 3390/antibiotics9110816.
- Langford B.J., So M., Raybardhan S., Leung V. et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol 2020; 26: 1622-1629. doi: 10.1016/j.cmi.2020.07.016.
- Rawson T.M., Moore L.S.P., Zhu N. et al. Bacterial and Fungal Coinfection in Individuals with Coronavirus: A Rapid Review to Support COVID-19 Clin Infect Dis. 2020; 71(9): 2459- doi: 10.1093/cid/ciaa530.
- Richardson S., Hirsch J.S., Narasimhan M. et al. Presenting Characteristics, Comorbidities, and Outcomes Among 5700 Patients Hospitalized With COVID-19 in the New York City Area. 2020; 323(20): 2052-2059. doi: 10.1001/jama.2020.6775.
- Ripa M., Galli L., Poli A. et al. Secondary infections in patients hospitalized with COVID- 19: incidence and predictive factors. Clinical Microbiology and Infection. 2021; 27: 451-457. doi: 1016/j.cmi.2020.10.021.
- Yapar N. Epidemiology and risk factors for invasive candidiasis. Ther Clin Risk Manag. 2014: 10; 95-105. doi: 10.2147/TCRM.S40160.
- Vaughn V.M., Gandhi T.N., Petty L.A. et al. Empiric antibacterial therapy and community- onset bacterial coinfection in patients hospitalized with coronavirus disease 2019 (COVID-19): A multi-hospital cohort study. Clin Infect Dis. 2021; 72(10): e533-e541. doi: 1093/cid/ciaa1239.
- Antinori S., Bonazzetti C., Gubertini G. et al. Tocilizumab for cytokine storm syndrome in COVID-19 pneumonia: an increased risk for candidemia? Autoimmun Rev. 2020; 19. doi: 1016/j.autrev.2020.102564.
- Kimmig L.M., Wu D., Gold M. et al. IL-6 inhibition in critically ill COVID-19 patients is associated with increased secondary infections. Front Med (Lausanne). 2020; 7. doi: 3389/fmed.2020.583897.
- Riche C.V.W., Cassol R., Pasqualotto A.C. Is the Frequency of Candidemia Increasing in COVID-19 Patients Receiving Corticosteroids? Journal of Fungi. 2020. 6, 286. https://doi.org/10.3390/
- Heidenreich S., Kubis T., Schmidt M., Fegeler W. Glucocorticoid-induced alterations of monocyte defense mechanisms against Candida albicans. Immunol. 1994; 157(2): 320-327. https://doi.org/10.1006/CIMM.1994.1230.
- Васильева Н.В., Климко Н.Н., Цинзерлинг В.А. Диагностика и лечение инвазивных микозом: современные рекомендации. Вестник Санкт Петербургской медицинской академии последипломного образования. 2010; 2(4): 5-18.
- Riad A., Gomaa E., Hockova B., Klugar M. Oral candidiasis of COVID-19 patients: Case report and review of evidence. Cosmet. Dermatol. 2021; 20(6): 1580-1584. https://doi.org/10.1111/ JOCD.14066.
- Corchuelo J., Ulloa F.C. Oral manifestations in a patient with a history of asymptomatic COVID-19: Case report. Int. J. Infect. Dis. : Off. Publ. Int. Soc. Infect. Dis. 2020; 100: 154-157. https: //doi.org/10.1016/J.IJID.2020.08.071.
- Jeronimo L.S., Esteves Lima R.P., Suzuki T. et al. Oral Candidiasis and COVID-19 in Users of Removable Dentures: Is Special Oral Care Needed? Gerontology. 2022; 68(1): 80-85. doi: 1159/000515214.
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции COVID-19». Версия 16 от 18.08.2022 г. 249 с.
2.5.2 Мукормикоз, ассоциированный с COVID-19 (Н.А. Карчевская)
Основными предрасполагающими факторами является сахарный диабет и применение кортикостероидов. Имеют так же значение наличие спор Mucorales как в помещении, так и на открытом воздухе, а также иммунотерапия, проводимая у пациентов в острой фазе заболевания.
Распространенные виды, вызывающие мукормикоз включают Rhizopus spp., Rhizomucor spp., Mucor spp., Lichtheimia spp ., Apophysomyces spp., Cunninghamella spp. и Saksenaea spp. [1-5].
Спорангиоспоры Mucorales различаются по размеру в зависимости от вида (диапазон 3–11 мкм).
Основным путем заражения мукормикозом является ингаляционный. Относительно более крупные споры R. arrhizus попадают в эпителий носа и пазухи и, таким образом, могут привести к риноорбитоцеребральному мукормикозу, тогда как относительно более мелкие споры Cunninghamella spp. могут достигать нижних дыхательных путей, что приводит к легочному мукормикозу. [6] Однако имеющиеся данные свидетельствуют о том, что любые патогенные виды Mucorales могут вызывать любые клинические проявления [7].
Перегрузка железом и терапия дефероксамином являются хорошо известными факторами риска развития мукормикоза [8]. Свободное железо, захваченное сидерофорами видов Rhizopus, способствует их росту.
Мукормикоз может возникнуть как на этапе острой фазы заболевания, так и после выздоровления [9-10].
Мукормикоз следует заподозрить у любого пациента перенесшего COVID-19, имеющего неконтролируемый сахарный диабет, получавшего глюкокортикостероиды и у которого развились следующие симптомы:
- риноорбитоцеребральный мукормикоз: симптомы не специфичны, особенно на первоначальном этапе и включают локальную боль в области придаточных пазух носа, глазных яблоках или лицевой части черепа, снижение остроты зрения, отек мягких тканей, птоз, нарушение кожной чувствительности, носовые кровотечения, язвы и корки в носу, некроз твердого неба. При вовлечении в процесс ЦНС могут появляться признаки отека головного мозга, а при инвазии в сосуды возникает тромбоз кавернозного синуса, облитерация и тромбоз внутренней сонной артерии, инфаркт головного мозга;
- легочный мукормикоз: поражение легких при мукормикозе сложно диагностировать, поскольку симптомы достаточно неспецифичны [11]. Может присутствовать лихорадка, кашель, кровохарканье, боль в грудной клетке и плевральный выпот. Для мукормикоза особенно характерны некроз паренхимы легкого и легочные кровотечения. [12] К более редким формам мукормикоза можно отнести кожный, гастроинтестинальный и диссеминированный.
Диагностика мукормикоза
Методы визуализации: при подозрении на риноцеребральный мукормикоз необходимо выполнение КТ или МРТ головного мозга и придаточных пазух носа. МРТ имеет преимущество перед КТ, так как позволяет определить степень грибковой инвазии, тогда как КТ лучше выявляет костную деструкцию, которая отмечается на поздних стадиях инфекции. При мукормикозе легких по данным КТ органов грудной клетки можно видеть: локальные инфильтративные и очаговые изменения, симптом «halo sign», обратный «halo sign», плеврит [13-14].
Лабораторные методы: окраска калькофлуором белым (характерный широкий (10-50 мкм) несептированный или редкосептированный мицелий, ветвящийся под прямым углом), посев, гистологическое исследование биопсийного или постоперационного материала (окраска ПАС, Гомори-Гроккоту). Малодоступным методом является определение ПЦР с последующим секвенированием и матрично-вспомогательной лазерной десорбцией/ионизацией по времени пролета (MALDI-TOF). В связи с низкой диагностической чувствительностью микроскопии и посева нередко необходимо повторное исследование.
Лечение мукормикоза
Лечение включает в себя антимикотическую терапию, хирургическое вмешательство (при наличии некроза ткани) и устранение факторов риска (коррекция нейтропении, диабета, кетоацидоза, отмена или снижение дозы ГКС, иммуносупрессантов и др).
Антимикотическая терапия: препаратами выбора являются препараты группы полиенов: липосомальный амфотерицин В или липидный комплекс амфотерицин В в дозе 5 мг/кг в день в 200 мл 5 % декстрозы в течение 2-3 часов в течение 3-6 недель.
При недоступности препаратов выбора, возможно применение Амфотерицина В деоксихолат 1-1,5 мг/кг/сут в течение 3-6 недель
При недоступности полиенов применяются изавуконазол 200 мг 3 раза в день в/в в течение 1-2 дней насыщающая доза, потом 200 мг в сутки в течение 3-6 недель или позаконазол в/в 300 мг 2 раза в день в первый день потом по 300 мг в день в течение 3-6 недель
При недоступности вышеперечисленных препаратов возможно использование итраконазола 200 мг 3 раза в день в течение 3-6 недель в инъекционной форме или форме суспензии.
При стабилизации состояния возможет переход на пероральные формы: изавуконазол 200мг 3 раза в день в течение 1-2 дней, потом по 200 мг в день в течение 3-6 месяцев.
Или позаконазол 300 мг 2 раза в день в первый день, потом по 300 мг в день в течение 3-6 месяцев.
Литература
- Patel A, Agarwal R, Rudramurthy SM, et al. Multicenter epidemiologic study of coronavirus disease-associated mucormycosis. India. Emerg Infect Dis. 2021; 27(9). https://doi.org/10.3201/eid2709.210934.
- Prakash H, Chakrabarti A. Global epidemiology of mucormycosis. J Fungi. 2019; 5(1): 26. https://doi.org/10.3390/jof5010026.
- Prakash H, Chakrabarti A. Epidemiology of mucormycosis in India. 2021; 9(3): 1- 12.
- Lanternier F, Dannaoui E, Morizot G, et al. A global analysis of mucormycosis in France: the RetroZygo study (2005–2007). Clin Infect Dis. 2012; 54(Suppl 1): S35- S43.
- Guinea J, Escribano P, Vena A, et al. Increasing incidence of mucormycosis in a large Spanish hospital from 2007 to 2015: Epidemiology and microbiological characterization of the isolates. PLoS 2017; 12(6): 1- 10. https://doi.org/10.1371/journal.pone.0229347.
- Prakash H, Chakrabarti Global epidemiology of mucormycosis. J Fungi. 2019; 5(1): 26.
- Rammaert B, Lanternier F, Zahar JR, et al. Healthcare-associated mucormycosis. Clin Infect 2012; 54(Suppl 1): S44- S54.
- Ibrahim AS, Spellberg B, Walsh TJ, Kontoyiannis DP. Pathogenesis of mucormycosis. Clin Infect 2012; 54(Suppl 1): S16- S22.
- Risk Factors for Procurence of Mucormycosis and its Manifestations Post Covid-19: a Single Arm Retrospective Unicentric Clinical Study. Gupta S, Ahuja P. Indian J Otolaryngol Head Neck Surg. 2021 Sep 18:1-8. doi: 10.1007/s12070-021-02825-0. Online ahead of print. PMID:
- Hoenigl M, Seidel D, Carvalho A, et al. The emergence of COVID-19 associated mucormycosis: analysis of cases from 18 Bioxriv. 2021.
- Garg D, Muthu V, Sehgal IS, et al. Coronavirus Disease (Covid-19) Associated Mucormycosis (CAM): case report and systematic review of literature. Mycopathologia. 2021; 186(2): 289- 298. https://doi.org/10.1007/s11046-021-00528-2.
- Patel A, Agarwal R, Rudramurthy SM, et al. Multicenter epidemiologic study of coronavirus disease-associated mucormycosis. India. Emerg Infect Dis. 2021; 27(9). https://doi.org/10.3201/eid2709.210934.
- Hoenigl M, Seidel D, Carvalho A, et al. The emergence of COVID-19 associated mucormycosis: analysis of cases from 18 countries. 2021. https://doi.org/10.2139/ssrn.3844587ю
- Cornely OA, Alastruey-Izquierdo A, Arenz D, et al. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium. Lancet Infect Dis. 2019; 19(12): e405- e421.
- ECMM/ISHAM recommendations for clinical management of COVID-19 associated mucormycosis in low- and middle-income countries. Rudramurthy SM, Hoenigl M, Meis JF, Cornely OA, Muthu V, Gangneux JP, Perfect J, Chakrabarti A; ECMM and ISHAM. Mycoses. 2021 Sep;64(9):1028-1037. doi: 10.1111/myc.13335. Epub 2021 Jul 26. PMID: 34133816.
2.5.3 Ковид-ассоциированный аспергиллез (Н.А. Карчевская)
Распространенность аспергиллеза на этапе стационарного лечения по поводу COVID-19 по данным разных исследований составляет от 1,7 до 47,4% в зависимости от тяжести состояния, выраженности дыхательной недостаточности и потребности в ИВЛ. [1-4]
Распространенность же аспергиллезной инфекции в постковидный период остается малоизученной, вероятно в связи с низким уровнем диагностики и информированности врачей амбулаторного звена.
Фоновые состояния и факторы риска для развития аспергиллеза описаны в многочисленных работах посвященных Ковид-ассоциированному аспергиллезу развившемуся в стационарных условиях.
К ним относятся относятся пожилой возраст, масса тела более 80 кг, мужской пол, применение ГКС до и во время лечения в ОИТ, прием иммуносупрессивных препаратов (ИЛ -1β и ингибиторы рецепторов ИЛ-6 и др.), длительная (медиана — 15 дней) лимфоцитопения (<1,0×109/л), нейтропения (<0,5×109/л), декомпенсированный СД, ХОБЛ, ОРДС, длительно лечение в ОРИТ, длительная искусственная вентиляция легких, злокачественные новообразования, цитостатическая или иммуносупрессивная терапия до ОРИТ и применение экстракорпоральной мембранной оксигенации (ЭКМО) [5-11]
Одной из основных трудностей диагностики аспергиллеза как у пациентов в острой фазе COVID-19, так и у постковидных больных является неспецифичность клинических и рентгенологических признаков.
Сохраняющиеся или рецидивирующие симптомы дыхательной недостаточности после выписки из стационара, кровохарканье, рефрактерная к антибиотикам лихорадка могут натолкнуть на мысль о присоединении или прогрессировании грибковой инфекции.
Из рентгенологических проявлений наиболее характерна кавитация, но могут быть и достаточно неспецифические изменения в виде локальных зон консолидации и матового стекла [12].
Окончательный диагноз выставляется на основании данных лабораторной диагностики, которая включает в себя микроскопию и посев БАЛ и/или трахеобронхиального аспирата, исследование ГМ в БАЛ и/или сыворотки крови, гистологическое исследование биоптата. Как показывают исследования, выявление ГМ в БАЛ у пациентов с COVID-19 обладало наибольшей чувствительностью [13-15].
Согласно рекомендациям ECMM/ISHAM 2020, препаратами выбора для лечения COVID-ассоциированного аспергиллеза являются вориконазол и изавуконазол [16,17]
В качестве альтернативной схемы можно рассматривать липосомальный амфотерицин В. Рекомендуемая начальная доза липосомального амфотерицина В составляет 3 мг/кг в сутки.
Комбинированная терапия может применяться при неэффективности исходной монотерапии или при сочетании аспергиллеза с другими инвазивными микозами (мукормикоз и др.).
Оптимальная продолжительность терапии неизвестна, но группа экспертов предлагает курс лечения 6–12 недель. Имеет смысл оценивать динамически КТ органов грудной клетки и, при возможности повторять ФБС с исследованием БАЛ.
У пациентов с ослабленным иммунитетом (например, с гематологическими злокачественными новообразованиями или получающих иммуносупрессивную терапию) может потребоваться более длительное лечение, чем у других пациентов.
Литература
- Mitaka H., Kuno T., Takagi H., Patrawalla P. Incidence and mortality of COVID-19- associated pulmonary aspergillosis: A systematic review and meta-analysis. 2021;64:993–1001. doi: 10.1111/myc.13292.
- Dellière S., Dudoignon E., Fodil S., Voicu S., Collet M., Oillic P.-A., Salmona M., Dépret F., Ghelfenstein-Ferreira T., Plaud B., et al. Risk factors associated with COVID-19-associated pulmonary aspergillosis in ICU patients: A French multicentric retrospective cohort. Clin. Infect. 2020;27:790.e1–790.e5. doi: 10.1016/j.cmi.2020.12.005.
- Gangneux J.P., Dannaoui E., Fekkar A., Luyt C.E., Botterel F., De Prost N., Tadié J.-M., Reizine F., Pharm S.H., Timsit J.-F., et al. Characterization of Fungal Infections in COVID-19 Infected Mechanically Ventilated Patients in I.C.U. the MY-CO-VID Clinical
- Rutsaert L., Steinfort N., Van Hunsel T., Bomans P., Naesens R., Mertes H., Dits H., Van Regenmortel N. COVID-19-associated invasive pulmonary aspergillosis. Intensiv. Care. 2020;10:528–534. doi: 10.1186/s13613-020-00686-4.
- COVID-19-Associated Pulmonary Aspergillosis in Russia. Shadrivova O, Gusev D, Vashukova M, Lobzin D, Gusarov V, Zamyatin M, Zavrazhnov A, Mitichkin M, Borzova Y,Kozlova O, Desyatik E, Burygina E, Ignatyeva S, Oganesyan E, Vasilyeva N, Klimko N, Working Group. J Fungi (Basel). 2021 Dec 0;7(12):1059. doi: 10.3390/jof7121059.
- Bartoletti M., Pascale R., Cricca M., Rinaldi M., Maccaro A., Bussini L., Fornaro G., Tonetti , Pizzilli G., Francalanci E., et al. Epidemiology of Invasive Pulmonary Aspergillosis Among Intubated Patients With COVID-19: A Prospective Study. Clin. Infect. Dis. 2020:ciaa1065. doi: 10.1093/cid/ciaa1065
- Koehler P., Bassetti M., Chakrabarti A., Chen S.C.A., Colombo A.L., Hoenigl M., Klimko N., Lass-Flörl C., Oladele R.O., Vinh D.C., et al. Defining and managing COVID-19-associated pulmonary aspergillosis: The 2020 ECMM/ISHAM consensus criteria for research and clinical Lancet Infect. Dis. 2021;21:e149–e162. doi: 10.1016/S1473-3099(20)30847-1.
- Arastehfar A., Carvalho A., Van De Veerdonk F.L., Jenks J.D., Koehler P., Krause R., Cornely O.A., Perlin D.S., Lass-Flörl C., Hoenigl M. COVID-19 Associated Pulmonary Aspergillosis (CAPA)—From Immunology to Treatment. Fungi. 2020;6:91. doi: 10.3390/jof6020091.
- Prattes J., Wauters J., Giacobbe D.R., Salmanton-García J., Maertens J., Bourgeois M., Reynders M., Rutsaert L., Van Regenmortel N., Lormans P., et al. Risk factors and outcome of pulmonary aspergillosis in critically ill coronavirus disease 2019 patients—a multinational observational study by the European Confederation of Medical Mycology. Clin. Microbiol. 2021;27:2892. doi: 10.1016/j.cmi.2021.08.014.
- White P.L., Dhillon R., Cordey A., Hughes H., Faggian F., Soni S., Pandey M., Whitaker H., May A., Morgan M., et al. A National Strategy to Diagnose Coronavirus Disease 2019— Associated Invasive Fungal Disease in the Intensive Care Unit. Infect. Dis. 2021;73:e1634– e1644. doi: 10.1093/cid/ciaa1298.
- Wang J., Yang Q., Zhang P., Sheng J., Zhou J., Qu T. Clinical characteristics of invasive pulmonary aspergillosis in patients with COVID-19 in Zhejiang, China: A retrospective case Crit. Care. 2020;24:4. doi: 10.1186/s13054-020-03046-7.
- Defining COVID-19-associated pulmonary aspergillosis: systematic review and meta- Kariyawasam RM, Dingle TC, Kula BE, Vandermeer B, Sligl WI, Schwartz IS. Clin Microbiol Infect. 2022 Jul;28(7):920-927. doi: 10.1016/j.cmi.2022.01.027. Epub 2022 Feb 10. PMID: 35150878
- L Rutsaert, N Steinfort, T Van Hunsel, et al. COVID-19-associated invasive pulmonary aspergillosis Ann Intensive Care, 10 (2020), p. 71
- S Antinori, R Rech, L Galimberti, et al. Invasive pulmonary aspergillosis complicating SARS-CoV-2 pneumonia: a diagnostic challenge Travel Med Infect Dis (2020) published online May https://doi.org/10.1016/j.tmaid.2020.101752
- COVID-19-Associated Pulmonary Aspergillosis in Russia. Shadrivova O, Gusev D, Vashukova M, Lobzin D, Gusarov V, Zamyatin M, Zavrazhnov A, Mitichkin M, Borzova Y, Kozlova O, Desyatik E, Burygina E, Ignatyeva S, Oganesyan E, Vasilyeva N, Klimko N, Working J Fungi (Basel). 2021 Dec 0;7(12):1059. doi: 10.3390/jof7121059.
- Koehler P., Bassetti M., Chakrabarti A., Chen S.C.A., Colombo A.L., Hoenigl M., Klimko , Lass-Flörl C., Oladele R.O., Vinh D.C., et al. Defining and managing COVID-19-associated pulmonary aspergillosis: The 2020 ECMM/ISHAM consensus criteria for research and clinical guidance. Lancet Infect. Dis. 2021;21:e149–e162. doi: 10.1016/S1473-3099(20)30847-1.
- AJ Ullmann, JM Aguado, S Arikan-Akdagli, et al. Diagnosis and management of aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline Clin Microbiol Infect, 24 (suppl 1) (2018), pp. e1-38
2.6 Критерии развития фибротических изменений в легких в постковидном периоде (И.В. Лещенко, Т.В. Глушкова)
По данным компьютерной томографии высокого разрешения (ВРКТ) патологические изменения в легочной ткани, относящиеся к фиброзным, традиционно интерпретируются согласно понятиям, отраженным в глоссарии Общества Флейшнера [1]. В настоящее время терминология, используемая при описании результатов ВРКТ у пациентов в постковидном периоде, разноречива и дискутабельна.
В представленном разделе под термином «фиброзоподобные» следует понимать изменения, соответствующие таковым по данным лучевого исследования, но постепенно регрессирующие при динамическом наблюдении, в том числе и до полного исчезновения.
«Фибротическим (фиброзным)» соответствуют изменения, не подлежащие регрессу через 6-12 и более месяцев от начала острых симптомов COVID-19, а в отдельных случаях- прогрессирующие в постковидном периоде.
Наиболее частым осложнением тяжелого течения COVID-19 является развитие ОРДС. У части пациентов прогрессирование ОРДС, ассоциированного с COVID-19, в связи с нарастанием объема пораженной части легких, требует проведения дополнительной респираторной поддержки в виде НИВЛ и ИВЛ [1-4]. Длительность ИВЛ при ОРДС, более частое развитие баротравмы, ассоциированной с ИВЛ у пациентов с тяжелым COVID-19, обширным поражением легких и нозокомиальная инфекция способствуют развитию, как обратимых (фиброзоподных), так и необратимых, сохраняющихся более 12 месяцев, фибротических (фиброзных) изменений в легких в постковидном периоде наблюдаемых авторами в публикациях [4,5]. Известно, что активные формы кислорода необходимы для уничтожения вирусов, но в тоже время гипероксия, как следствие проводимой дополнительной респираторной поддержки, может привести к нарушению окислительно-восстановительного гомеостаза и развитию прогрессирующего разрушения альвеоло-капиллярных мембран, обструкции капилляров, образующих микротромбы, и утечке воздуха через уже поврежденные альвеолы в окружающие ткани [6]. Гипероксия, необходимая для поддержания адекватной оксигенации у больных c COVID-19 и ОРДС и возникающая во время проведения высокопоточной кислородотерапии (ВПО) и ИВЛ, может оказывать неблагоприятное воздействие на легочную ткань, в том числе и в виде формирования фибротических изменений [7].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Факторы риска развития фибротических изменений после острого периода COVID-19
В сравнительном исследовании 81 пациента, завершивших лечение в стационаре после COVID-19 и разделенных по признаку наличия/отсутствия фибротических изменений в легочной ткани по данным ВРКТ, определены статистически значимые различия в целом ряде исследуемых параметров [8]. Группа пациентов, имеющих фибротические изменения в легких (n=42), в среднем через 58 дней характеризовалась преобладанием мужчин, старшим возрастом, более частой распространенностью коморбидной патологии (сахарный диабет, гипертоническая болезнь, хронические заболевания легких и печени, сердечно-сосудистые и цереброваскулярные заболевания), по сравнению с пациентами без фибротических изменений в легочной ткани (n=39) [8].
Отличия определены и по особенностям течения COVID-19, а именно: пациенты с фиброзными изменениями чаще госпитализировались в отделения ОРИТ и нуждались в проведении ИВЛ, а также более длительное время страдали от повышенной температурной реакции в догоспитальном периоде и от присоединения нозокомиальной инфекции [8].
По данным сравнения лабораторных обследований также были выявлены статистически значимые различия, в частности, эозинопения и лимфопения чаще наблюдались в группе с фиброзными изменениями в легких [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Исследования, проводимые другими авторами, аналогично направленные на выявление возможных факторов риска развития фиброзоподобных/фибротических изменений в легочной ткани, демонстрируют схожие характеристики пациентов и особенности течения заболевания в соответствующих группах [9]. А именно: мужской пол, более старший возраст, ИМТ, лейкоцитоз, более высокие уровни СРБ, Д-димера и ферритина, более низкий уровень лимфопении, а также необходимость в проведении ИВЛ [9,10].
Помимо вышеуказанных особенностей, обращает на себя внимание объем повреждения легочной ткани в остром периоде COVID-19, как особый, прогностически неблагоприятный фактор, ассоциированный с более высоким риском фиброзоподобных или фибротических изменений в легочной ткани в исходе заболевания [9,10].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Метаанализ, включающий 618 статей и 13 исследований, посвященных проблеме, так называемого, постковидного фиброза в легочной ткани, выявил высокую распространенность изменений, выявленных ВРКТ, которые можно интерпретировать, либо как фиброзоподобные, либо, как фибротические у пациентов с постковидным синдромом (44,9%) [11]. Основные выводы метаанализа, по результатам сравнения двух групп пациентов с фибротическими изменениями в легких и без таковых, подтверждают, что предрасполагающими факторами развития патологических изменений в легочной ткани в постковидном периоде являются: мужской пол, старший возраст, объем поражения легочной ткани в остром периоде COVID-19 ≥18 баллов*, длительность догоспитального этапа лечения, а также необходимость проведения ИВЛ/НИВЛ [11].
* – Балльная оценка объема поражения легких при COVID-19. Каждая из 5 долей оценивается по 5-ти балльной шкале от 0 до 5 в зависимости от % поражения легочной ткани [12]:
- 0 баллов: 0%;
- 1 балл <5%;
- 2 балла: 5–25%;
- 3 балла: 26–50%;
- 4 балла: 51–75%;
- 5 баллов >75%.
В дальнейшем баллы, соответствующие каждой доле, суммируются и отражают общую балльную оценку поражения легочной ткани (от 0 до 25 баллов) [12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
В одном из исследований, посвященных оценке ВРКТ легких у больных COVID-19, показано, что поражение легочной ткани более 18 баллов ассоциировалось с большим риском смертельного исхода заболевания [13].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Помимо этого, в группе пациентов с постковидными патологическими изменениями в легких, а среди коморбидной патологии преобладала ХОБЛ, отмечен более высокий ИМТ, хотя и без статистически значимых различий, а среди лечебных мероприятий предрасполагающим фактором обозначена терапия такими группами препаратов как: стероиды, антибактериальные препараты и иммуноглобулины [11].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3) Вместе с тем возможно определение в крови и специфических биомаркеров повреждения легочной ткани, как предикторов неблагоприятного течения COVID-19. Одними из наиболее известных и изученных являются KL-6 и SP–D [14].
KL-6 является пролиферативным и хемотаксическим фактором для фибробластов, а также усиливает экспрессию коллагена I и III типов, что позволяет рассматривать его как чувствительный биомаркер фиброзирующих процессов в легочной ткани [15,16].
Известно также и о повышении уровня KL-6 в сыворотке крови больных с ОРДС [17]. SP-D вырабатывается альвеолоцитами II типа [18]. При развивающемся повреждении легочной ткани и нарушении целостности альвеолярно – капиллярной мембраны SP-D попадает в кровоток и становится доступным для определения в сыворотке крови, становясь еще одним биомаркером деструктивных процессов в легочной ткани[18].
Сывороточные биомаркеры, ассоциированные с процессами фиброгенеза у больных со среднетяжелой и тяжелой формами COVID-19 представлены в таблице [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
|
Таблица. Сывороточные биомаркеры, ассоциированные с процессами фиброгенеза у больных со среднетяжелой и тяжелой формами COVID-19 [19] |
|||
|
Биомаркеры |
Среднетяжелый COVID-19 |
Тяжелый COVID-19 |
p |
|
ММР 7, нг/мл |
7,36 (5,17) |
14,11 (10,09) |
0,001 |
|
ММР 1, нг/мл |
6,93 (9,19) |
10,04 (7,33) |
0,001 |
|
Периостин, нг/мл |
0,87 (0,40) |
1,28 (0,89) |
0,004 |
|
Остеопонтин, нг/мл |
13,99 (23,18) |
8,54 (8,67) |
0,345 |
|
EGFR, нг/мл |
1,48 (0,98) |
1,35 (1,12) |
0,303 |
|
sVEGF, пг/мл |
268,20 (252,12) |
331,30 (298,94) |
0,308 |
|
|
Фибротический КТ-паттерн |
Нефибротический КТ-паттерн |
|
|
ММР 7, нг/мл |
13,20 (9,20) |
7,92 (6,32) |
0,001 |
|
ММР 1, нг/мл |
10,40 (8,21) |
6,97 (8,89) |
0,023 |
|
Периостин, нг/мл |
1,36 (0,93) |
0,87 (0,39) |
0,001 |
|
Остеопонтин, нг/мл |
12,66 (23,78) |
12,56 (19,64) |
0,976 |
|
EGFR, нг/мл |
1,50 (1,00) |
1,43 (1,02) |
0,673 |
|
sVEGF, пг/мл |
246,76 (225,76) |
184,07 (207,61) |
0,084 |
|
|
DLCO <80% |
DLCO ≥80% |
|
|
ММР 7, нг/мл |
11,54 (8,96) |
6,71 (4,25) |
0,001 |
|
ММР 1, нг/мл |
8,94 (8,52) |
6,55 (9,03) |
0,056 |
|
Периостин, нг/мл |
1,11 (0,07) |
0,84 (0,40) |
0,001 |
|
Остеопонтин, нг/мл |
12,75 (24,96) |
12,42 (15,33) |
0,909 |
|
EGFR, нг/мл |
1,33 (0,91) |
1,55 (1,10) |
0,127 |
|
sVEGF, пг/мл |
230,07 (223,33) |
166,74 (198,15) |
0,035 |
|
Примечание: MMP 1 и 7 – матриксные металлопротеинзы (ферменты, участвующие в регуляции деградации внеклеточного матрикса); периостин – секретируемый белок внеклеточного матрикса; остеопонтин – белок внеклеточного матрикса; EGFR – эпидермальный фактор роста; sVEGF – фактор роста эндотелия сосудов. |
|||
Распространенность ожирения среди пациентов с COVID-19 по данным проведенного мета-анализа, составляет 33% [20]. Неоднократно исследователями отмечалось, что наличие ожирения связано не только с повышенным риском заболевания, но и риском госпитализации, в том числе в ОРИТ, проведением ИВЛ, летальностью, а также ассоциировано с тяжелым и критическим течением COVID-19 [21,22]. Предполагаемые механизмы неблагоприятного влияния ожирения на течение COVID-19 связаны с увеличением экспрессии к рецепторам АПФ-2, нарушением регуляции пути mTOR, способствующего созданию благоприятной среды для репликации вируса SARS-CoV-2, гиперактивации РААС, приводящей к еще большей дисрегуляции при инфицировании SARS-CoV-2[23]. Жировая ткань, как резервуар, увеличивает латентность вируса и может косвенно способствовать его мутации. У пациентов с ожирением развиваются нарушение оксилительно-восстановительного равновесия, дисбаланс между про- и противовоспалительными цитокинами и адипокинами, увеличивается количество жирных кислот, что способствует повреждению эндотелия сосудов, а также нарушению регуляции иммунных клеток и развитию местного и системного воспаления [23]. Результаты двух мета-анализов демонстрируют риск неблагоприятного течения COVID-19 при ИМТ>25 кг/м2, в то же время систематтический обзор и мета-анализ, включающий 45 650 пациентов, обозначают значимым ИМТ>30 кг/м2 [24,25]. Учитывая, что значение ИМТ разнится и в исследованиях и обзорах других авторов от 24,9 до 30 и выше кг/м2, нам представляется возможным рассматривать ИМТ>25 кг/м2 в качестве предиктора неблагоприятного течения COVID-19 [26-28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Таким образом, обосновывая данные, полученные при обследовании пациентов, перенесших COVID-19, основными факторами развития фибротических или фиброзоподбных изменений в легких в постковидном периоде являются:
- мужской пол;
- пожилой возраст;
- ИМТ >25 кг/м2;
- коморбидная патология (ХОБЛ, сахарный диабет, гипертоническая болезнь, кардиоваскулярные заболевания, цереброваскулярные заболевания, хроническая болезнь почек);
- тяжесть COVID-19 в остром периоде (анамнестические сведения):
- «цитокиновый шторм»;
- объем поражения легочной ткани более 18 баллов [12];
- респираторная поддержка (ВПО/ИВЛ/НИВЛ);
- ОРДС;
- высокие уровни маркеров воспаления (СРБ, Д-димер, ферритин);
- повышенное содержание специфических биомаркеров фибротических процессов в легочной ткани (KL-6, MMP1 и 7, SP-D и др., см. таблицу).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Основные механизмы развития фибротических изменений в легочной ткани, предпосылками которых являются особенности течения острого периода COVID-19, могут быть представлены следующим образом: вирус SARS-CoV-2 вызывает повреждение альвеолярного эпителия и индуцирует выработку эпителиальных и макрофагальных воспалительных и иммунных цитокинов, приводящих к повреждению легочной ткани [29].
Установлена следующая последовательность развития фибротических изменений легочной ткани:
- вирус SARS-CoV-2, посредством связывания спайкового белка с рецептором к АПФ 2, проникает в пневмоциты II типа и способствует накоплению ангиотензина II за счет к дисрегуляции РААС [30,31];
- ангиотензин II активирует IL-6, TNF-α, увеличивает количество нейтрофилов и макрофагов в альвеолярных пространствах и, являясь мощным вазоконстриктором, оказывает прямое повреждающее действие на эндотелий сосудов [32,33];
- ангиотензин II способствует активации гена коллагена I через сигнальный путь MAPK/ERK и способствует генерации фиброзного ответа [34,35];
- в ответ на травму, вызванной SARS-CoV-2, пневмоциты II типа мигрируют в поврежденный участок легкого, дифференцируются в пневмоциты I типа и пролиферируют, способствуя реэпителизации [36].
Далее:
- в результате повреждения альвеолярных эпителиальных клеток инфильтрация фибробластами и воспалительными клетками приводит к высвобождению и активации профибротических медиаторов, таких как TGF-β и PDGF, что приводит к синтезу и накоплению внеклеточного матрикса [37];
- нуклеокапсидный белок SARS-CoV-1 может непосредственно способствовать усилению экспрессии TGF-β. Учитывая, что сходство нуклеокапсидного белка между SARS-CoV-2 и SARS-CoV-1 составляет до 90%, можно предположить, что SARS-CoV-2 также будет способствовать аналогичному пути активации экспрессии TGF-β [31,38];
- TGF-β, воздействуя на альвеолярные макрофаги, стимулирует секрецию IL-4, IL-6 и IL- 13 способствуя развитию фиброзных изменений в легочной ткани [31,39] и активирует внутриклеточные сигнальные пути, ассоциированные с повышением экспрессии генов, связанных с фиброзом (COL1A1, COL3A1, TIMP1 и др.) и способствует отложению внеклеточного матрикса [31,39];
- IL-4 способствует активации попеременно активированных макрофагов 2 типа (М2), которые, в свою очередь, секретируют TGF-β1, стимулируют пролиферацию фибробластов и участвуют в реорганизации внеклеточного матрикса [31,40];
- IL-6 является ключевым провоспалительным цитокином. Известно, что его экспрессия повышается в гиперпластическом альвеолярном эпителии при легочном фиброзе [41];
- SARS-CoV-2 увеличивает экспрессию гена матричного белка фибулина-1 (FN1) внеклеточного матрикса в клетках альвеолярного эпителия, который в свою очередь индуцирует активацию TGF-β, приводя к увеличению количества миофибробластов и отложению коллагена [42, 43];
- в то же время, миофибробласты образуют плотный внеклеточный матрикс и приводят к пространственной реорганизацией волокон коллагена с поcледующим формированием жесткого внеклеточного матрикса, что приводит к застыванию легочной ткани, аналогичному ИЛФ [44]. Перестройка цитоскелета играет важную роль в стимулировании межклеточного распро-странения вируса SARS-CoV-2 [45];
- альвеолярный эпителий регулирует продукцию урокиназы и ингибитора активатора плазминогена 1 (PAI1) и тем самым контролирует коагуляцию и фибринолиз на поверхности альвеол. В ответ на высвобождение урокиназы и PAI-1 из поврежденного альвеолярного эпителия активируются пути коагуляции, приводящие к отложению фибрина [29]. Отслойка альвеолярного эпителия от базальной мембраны приводит к нарушению альвеолярной архитектоники в виде неравномерного распределения альвеолярного эпителия, расширению межальвеолярных перегородок за счет отложения волокон коллагена и, тем самым, способствует уменьшению альвеолярных пространств [46];
- ММР-9, связываясь с рецептором гиалируновой кислоты CD44v6, активирует TGF-β. Комплекс CD44v6/гиалуроновая кислота приводит к активации пути, уменьшающего апоптоз фибробластов. Гиалуроновая кислота, присутствующая во внеклеточном матриксе может способствовать увеличению продолжительности миофибробластов, и, тем самым, способствовать застыванию легочного фиброза [40,46-48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
Предложенный механизм развития SARS-CoV-2-ассоциированного фиброза в легочной ткани представлен на рисуноке 1 [29].
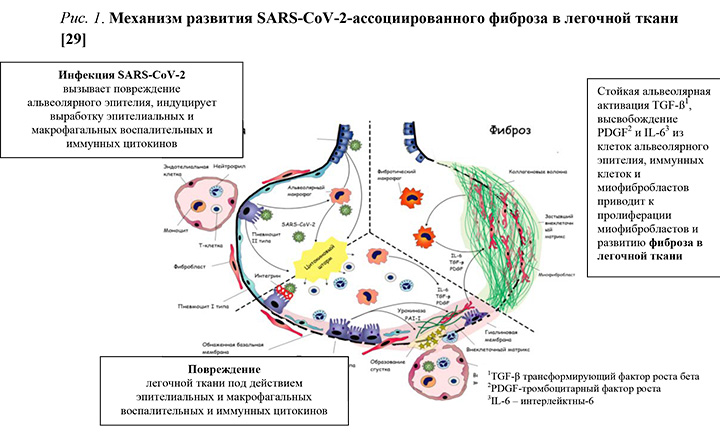
Таким образом, COVID-19 может непосредственно способствовать развитию фибротичексих легких за счет следующих механизмов:
- SARS CoV-2 индуцирует снижение клиренса АПФ-2 в легких, что приводит к нарушению регуляции TGF-β, CTGF, PDGF, а также выработке провоспалительных цитокинов, участвующих в разнообразных каскадах путей фиброзобразования в легких;
- SARS CoV-2 способен непосредственно усиливать сигнал TGF-β, который является мощным профибротическим стимулом;
- SARS-CoV-2 стимулирует пролиферацию миофибробластов и образование плотного внеклеточного матрикса.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Литература
- Burnham E.L., Janssen W.J., Riches D.W. et al. The fibroproliferative response in acute respiratory distress syndrome: mechanisms and clinical significance. Respir. J. 2014; 43(1): 276-85. DOI: 10.1183/09031936.00196412.
- Ngai J.C., Ko F.W., Ng S.S. et al. The long-term impact of severe acute respiratory syndrome on pulmonary function, exercise capacity and health status. Respirology 2010 Apr;15(3):543-50. DOI: 1111/j.1440-1843.2010.01720.x.
- Wu C., Chen X., Cai Y. et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020; 180(7): 934-943. DOI: 1001/jamainternmed.2020.0994.
- Gosangi B., Rubinowitz A.N., Irugu D. et al. COVID-19 ARDS: a review of imaging features and overview of mechanical ventilation and its complications. Emerg. Radiol. 2022; 29(1): 23- DOI: 10.1007/s10140-021-01976-5.
- Gupta V.K., Alkandari B.M., Mohammed W. et al. Ventilator associated lung injury in severe COVID-19 pneumonia patients - case reports: ventilator associated lung injury in COVID-19. J. Radiol. Open. 2020; 9(8): 100310. DOI: 10.1016/j.ejro.2020.100310.
- Chernyak A.V., Popova E.N., Prikhodko A.S. et al. COVID-19 and Oxidative Stress. Biochemistry (Mosc). 2020; 85(12): 1543-1553. DOI: 1134/S0006297920120068.
- Hanidziar D., Robson S.C. Hyperoxia and modulation of pulmonary vascular and immune responses in COVID-19. Am. J. Physiol. Lung Cell Mol. Physiol. 2021; 320(1): L12-L16. DOI: 1152/ajplung.00304.2020.
- Huang W., Wu Q., Chen Z. et al. The potential indicators for pulmonary fibrosis in survivors of severe COVID-19. Infect. 2021; 82(2): e5-e7. doi:10.1016/j.jinf.2020.09.027.
- Aul D.R., Gates D.J., Draper D.A., et al. Complications after discharge with COVID-19 infection and risk factors associated with development of post-COVID pulmonary fibrosis. Med. 2021; 188: 106602. DOI:10.1016/j.rmed.2021.106602.
- Li X., Shen C., Wang L. et al. Pulmonary fibrosis and its related factors in discharged patients with new corona virus pneumonia: a cohort study. Respir. Res. 2021; 22(1): 203. DOI:10.1186/s12931-021-01798-6.
- Hama Amin B.J., Kakamad F.H., Ahmed G.S. et al. Post COVID-19 pulmonary fibrosis; a meta-analysis study. Ann. Med. (Lond). 2022; 77: 103590. doi:10.1016/j.amsu.2022.103590.
- Pan F., Ye T., Sun P. et al. Time Course of Lung Changes at Chest CT during Recovery from Coronavirus Disease 2019 (COVID-19). Radiology 2020; 295(3): 715-721. DOI: 1148/radiol.2020200370.
- Francone M., Iafrate F., Masci G.M. et al. Chest CT score in COVID-19 patients: correlation with disease severity and short-term prognosis. Eur. Radiol. 2020; 30(12): 6808-6817. DOI: 1007/s00330-020-07033-y.
- Chinese Research Hospital Association; Respiratory Council. [Expert recommendations for the diagnosis and treatment of interstitial lung disease caused by novel coronavirus pneumonia]. (in Chinese). Zhonghua Jie He He Hu Xi Za Zhi. 2020; 43(10): 827-833. DOI: 3760/cma.j.cn112147-20200326-00419.
- Hesselstrand R., Wildt M., Bozovic G. et al. Biomarkers from bronchoalveolar lavage fluid in systemic sclerosis patients with nterstitial lung disease relate to severity of lung fibrosis. Med. 2013; 107(7): 1079-86. DOI: 10.1016/j.rmed.2013.03.015.
- Xu L., Yan D.R., Zhu S.L. et al. KL6 regulated the expression of HGF, collagen and myofibroblast Eur. Rev. Med. Pharmacol. Sci. 2013; 17 (22): 3073–3077.
- Sato H., Callister M.E., Mumby S. et al. Evans KL-6 levels are elevated in plasma from patients with acute respiratory distress syndrome. Eur. Respir. J. 2004; 23: 142-145; DOI:10.1183/09031936.03.00070303.
- Eisner, M.D., Parsons, P., Matthay, M. et al. Plasma surfactant protein levels and clinical outcomes in patients with acute lung injury. Thorax. 2003; 58(11): 983-988. DOI:10.1136/thorax.58.11.983
- Seafront B., Tarraso J., Rodriguez-Borja E. et al. Lung Function, Radiological Findings and Biomarkers of Fibrogenesis in a Cohort of COVID-19 Patients Six Months After Hospital Arch. Bronconeumol. 2022; 58(2) DOI:142-149. : 10.1016/j.arbres.2021.08.014.
- Raeisi T., Mozaffari H., Sepehri N. et al. The negative impact of obesity on the occurrence and prognosis of the 2019 novel coronavirus (COVID-19) disease: a systematicreview and meta-analysis. Eat. Weight Disord. 2022; 27(3): 893-911. DOI: 10.1007/s40519-021- 01269-3.
- de Siqueira J.V.V., Almeida L.G., Zica B.O. ert al. Impact of obesity on hospitalizations and mortality, due to COVID-19: A systematic review. Obes. Res. Pract. 2020 Sep- Oct;14(5):398-403. doi: 10.1016/j.orcp.2020.07.005.
- Foldi M., Farkas N., Kiss S. et al. Obesity is a risk factor for developing critical condition in COVID-19 patients: A systematic review and meta-analysis. Obes Rev. 2020 Oct;21(10):e13095. DOI: 1111/obr.13095.
- Sudhakar M., Winfred S.B., Meiyazhagan G. et al. Mechanisms contributing to adverse outcomes of COVID-19 in obesity. Mol. Cell. Biochem. 2022; 477(4): 1155-1193. DOI:10.1007/s11010-022-04356-w.
- Malik P., Patel U., Patel K. et al. Obesity a predictor of outcomes of COVID-19 hospitalised patients—a systematic review and meta Med. Virol. 2020; DOI 10.1002/jmv.26555
- Popkin B.M., Shufa D., Green W.D. et al. Individuals with obesity and COVID-19; a global perspective on the epidemiology and biological relationships. Obesity Rev. . 2020; 21: e13128. DOI: 1111/obr.13128.
- Caussy C., Pattou F., Wallet F. et al. Prevalence of obesity among adult inpatients with COVID-19 in France. Lancet Diabetes Endocrinol. 2020; 8: 562–564. DOI: 10.1016/S2213- 8587(20)30160-1.
- Chiumello D., Pozzi T., Storti E. et al. Body Mass Index and ARDS severity in patients with and without SARS-CoV-2 infection. Br. J. Anaesth. 2020; 125: e376–e377. DOI: 1016/j.bja.2020.07.006.
- Recalde M., Pistillo A., Fernandez-Bertolin S. et al. BMI and risk of COVID-19 diagnosis, hospitalisation and death; a population based multi state cohort analysis including 2524926 people in Сatalonia Spain. Med. Rxiv preprint. 2020; https://doi.org/10.101101/2020.11.25.20237776.
- John A.E., Joseph C., Jenkins G. et al. COVID-19 and pulmonary fibrosis: A potential role for lung epithelial cells and fibroblasts. Rev. 2021. DOI: 10.1111/imr.12977.
- Конради А. О., Недошивин А. О. Ангиотензин II и COVID-19. Тайны взаимодействий. РКЖ. 2020; 4. URL: https://cyberleninka.ru/article/n/angiotenzin-ii-i-covid-19-tayny- vzaimodeystviy (дата обращения: 09.04.2022).
- Bergantini L., Mainardi A., d'Alessandro M. et al. Common Molecular Pathways Between Post-COVID19 Syndrome and Lung Fibrosis: A Scoping Review. Front Pharmacol. 2022; 13: DOI: 10.3389/fphar.2022.748931
- Chang R., Mamun A., Dominic A., Le N.T. SARS-CoV-2 Mediated Endothelial Dysfunction: The Potential Role of Chronic Oxidative Stress. Front Physiol. 2021; 11: 605908. DOI: 3389/fphys.2020.605908.
- Giacomelli C., Piccarducci R., Marchetti L. et al. Pulmonary fibrosis from molecular mechanisms to therapeutic interventions: lessons from post-COVID-19 patients. Biochem. 2021; 193: 114812. DOI: 10.1016/j.bcp.2021.114812.
- Tharaux P.L., Chatziantoniou C., Fakhouri F. et al. Angiotensin II activates collagen I gene through a mechanism involving the MAP/ER kinase pathway. Hypertension 2000; 36: 330-336. DOI:10.1161/01.HYP.36.3.330.
- McDonald L.T., Healing after COVID-19: are survivors at risk for pulmonary fibrosis? Am. Physiol. Lung Cell. Mol. Physiol. 2021; 320(2): L257-L265. DOI:10.1152/ajplung.00238.2020
- Camelo A., Dunmore R., Sleeman M.A. et al. The epithelium in idiopathic pulmonary fibrosis: breaking the Front. Pharmacol. 2014; 4: 173. DOI: 10.3389/fphar.2013.00173.
- Martinez F.J., Collard H.R., Pardo A., et al. Idiopathic pulmonary fibrosis. Nat. Rev. Dis. 2017; 3: 17074. DOI: 10.1038/nrdp.2017.74.
- Wang F., Kream R.M., Stefano G.B. Long-Term Respiratory and Neurological Sequelae of COVID-19. Sci. Monit. 2020; 26: e928996. DOI: 10.12659/MSM.928996.
- Delpino M.V., Quarleri J. SARS-CoV-2 Pathogenesis: Imbalance in the Renin-Angiotensin System Favors Lung Fibrosis. Front Cell. Infect. Microbiol. 2020; 10: 340. DOI: 3389/fcimb.2020.00340.
- Vaz de Paula C.B., Nagashima S., Liberalesso V. et al. COVID-19: Immunohistochemical Analysis of TGF-β Signaling Pathways in Pulmonary Fibrosis. Int. J. Mol. Sci. 2021; 23(1): 168. DOI: 3390/ijms23010168. PMID: 35008594
- Crestani B., Cornillet P., Dehoux M. et al. Alveolar type II epithelial cells produce interleukin-6 in vitro and in vivo. Regulation by alveolar macrophage secretory products. J. Clin. 1994; 94(2): 731-40. DOI: 10.1172/JCI117392.
- Xu J., Xu X., Jiang L. et al. SARS-CoV-2 induces transcriptional signatures in human lung epithelial cells that promote lung fibrosis. Respir. Res. 2020; 21(1): 182. DOI: 10.1186/s12931- 020-01445-6
- Liu G., Cooley M.A., Jarnicki A.G. et al. Fibulin-1c regulates transforming growth factor-β activation in pulmonary tissue fibrosis. JCI. Insight. 2019; 5(16): e124529. DOI: 1172/jci.insight.124529.
- Sgalla G., Iovene B., Calvello M. et al. Idiopathic pulmonary fibrosis: pathogenesis and Respir Res. 2018; 19(1): 32. DOI: 10.1186/s12931-018-0730-2.
- Bouhaddou M., Memon D., Meyer B. et al. The Global Phosphorylation Landscape of SARS-CoV-2 Cell. 2020; 182(3): 685-712.e19. DOI: 10.1016/j.cell.2020.06.034.
- Cortese K., Holland G., Möller L. et al. Ultrastructural examination of lung "cryobiopsies" from a series of fatal COVID-19 cases hardly revealed infected cells. Virchows Arch. 2022; 16: 1–11. DOI: 1007/s00428-022-03308-5.
- Tammi M.I., Day A.J., Turley E.A. Hyaluronan and Homeostasis: A Balancing Act. Chem. 2002; 277: 4581–4584. DOI: 10.1074/jbc.R100037200.
- Atkinson J.J., Senior R.M. Matrix metalloproteinase-9 in lung remodeling. Am. J. Respir. Cell Mol. Biol. 2003; 28: 12–24. DOI: 10.1165/rcmb.2002-0166TR.
2.7 Лечебная тактика
2.7.1 Целесообразность назначения противовирусной и иммуномодулирующей терапии (А.В. Горелов, Н.Ю. Пшеничная, Е.В. Эсауленко)
Через несколько месяцев после инфицирования в биоптатах кишечника людей, перенесших COVID-19, обнаружен мРНК вируса SARS-CoV-2, а также вирусный белок, на который может реагировать иммунная система. Сохранение мРНК или ее фрагментов SARS-CoV2 в клетках организма человека может способствовать развитию хронического воспалительного процесса и дисрегуляции иммунной системы.
Вирус, отвечающий за репликацию в большинстве случаев исчезает максимум через 20 дней от начала заболевания, за исключением людей с иммуносупрессией. У них вирус персистирует и выделяется в течение длительного времени. Появились исследования, которые доказывают сохранение вирусом репликативной активности до 400 дней и более, что сопровождается эволюцией SARS-CoV-2 с накоплением новых мутаций. Как правило, это иммуносупрессивные пациенты, в том числе с онкологической патологией, заболеваниями системы крови, ВИЧ-инфекцией и другие [1].
Исходя из вышеизложенного, возможно назначение противовирусных препаратов пациентам, у которых на протяжении нескольких месяцев сохраняется положительный результат ПЦР на SARS-CoV2 в назофарингеальных мазках. Альтернативный подход может быть связан с использованием в таких ситуациях иммуномодулирующих средств. С учетом высокой вероятности персистенции вируса при Long-COVID-19 представляется вполне обоснованным использование уже за пределами острого периода препаратов прямого противовирусного действия, таких как РНК-зависимый ингибитор РНК- полимеразы фавипиравир. В проведенных в нескольких странах клинических исследованиях доказано угнетение репликации вируса COVID-19 и последовательный регресс клинической симптоматики в остром периоде. В некоторых клиниках России успешно используют повторное назначение фавипиравира при затянувшемся COVID-19.
Рекомендации:
Рекомендовано использование противовирусных препаратов прямого действия иммуносупрессивным пациентам с подтвержденной персистенцией вируса в течение длительного времени для прекращения репликации:
- фавипиравир [2-4].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2) Комментарии: возможно применение препаратов фавипиравира – прямого противовирусного действия РНК-зависимый ингибитор РНК-полимеразы с учетом высокой вероятности персистенции вируса при Long-COVID-19 в особых группах пациентов (с иммуносупрессивной коморбидностью: онкологические заболевания, после трансплантации солидных органов, ВИЧ-инфицированных, заболеваниями крови и прочими). Входит в международные клинические рекомендации по лечению и профилактике новой коронавирусной инфекции COVID19. Представляется обоснованным использование фавипиравира за пределами острого периода.
Рекомендовано использование препаратов с широким противовирусным и иммуномодулирующим действием пациентам с подтвержденной персистенцией вируса в течение длительного времени для прекращения его репликации, а также коррекции иммунного статуса:
- энисамия йодид [5].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2) Комментарий: препарат комплексного действия: обладает противовирусной и иммуномодулирующей активностью (индукция синтеза интерферона). Рекомендованная схема назначения препарата по 500 мг 3 раза/сут перорально, курс 5–7 дней.
Противопоказан при повышенной чувствительности к компонентам препарата, дефиците лактазы, непереносимости лактозы, глюкозно-галактозной мальабсорбции, дефиците сахаразы/изомальтазы, непереносимости фруктозы, беременности и периоде грудного вскармливания, аллергических реакциях в анамнезе, тяжёлых органических поражениях печени и почек.
- азоксимера бромид [6-10].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2) Комментарии: обладает выраженной иммуномодулирующей (в том числе интерферонпродуцирующей) активностью. Кроме того, препарат имеет антитоксическое и антиоксидантное свойства. В период репликации вируса применяется в комплексе со средствами этиотропной терапии, а в период реабилитации или с целью иммунопрофилактики респираторных инфекций, включая COVID-19, особенно при реабилитации вирусного поражения легких при SARS COV-2 инфекции – в качестве монотерапии. Таблетки: по 1 таблетке сублингвально 2 раза/сут 7 дней; Раствор: в дозе 12 мг внутривенно 1 ра/сут в течение 3 дней, затем внутримышечно через день пациентам с COVID-19 общим курсом 10 инъекций; Интраназально или сублингвально 6 мг/ сут, суточная доза препарата (6 мг) вводится за 2-3 приема в сутки.
- имидазолилэтанамид пентандиовой кислоты [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5) Комментарии: препарат с комплексным действием: противовирусным, иммуномоделирующим и противовоспалительным. Механизм действия имидазолилэтанамид пентандиовой кислоты реализуется на уровне инфицированных клеток за счет стимуляции факторов врожденного иммунитета, подавляемых вирусными белками. Вызывает повышение уровня интерферона в крови до физиологической нормы, обладает противовоспалительной активностью. Препарат назначается внутрь независимо от приема пищи по 1 капсуле (90 мг) 1 раз/сут в течение 5-7 дней.
- риамиловир [12-15].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2) Комментарии: риамиловир обладает широким спектром противовирусной активности в отношении РНК-содержащих вирусов, в том числе SARS-CoV-2, подавляя синтеза вирусных РНК и репликации геномных фрагментов. Активное вещество является синтетическим аналогом оснований пуриновых нуклеозидов (гуанина). Прием препарата внутрь независимо от приема пищи по 1 капсуле (250 мг) 3 раза/сут (суточная доза - 750 мг) в течение 7 дней. Отрицательный результат ПЦР у большинства больных, получавших Риамиловир, отмечался уже к 7-м суткам.
- оксиэтиламмония метилфеноксиацетат [16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5) Комментарии: препарат обладает иммуностимулирующими, антиоксидантными и широкими адаптогенными свойствами. Повышает устойчивость организма к физическим нагрузкам, гипоксии, иммобилизационному стрессу, компенсирует когнитивные расстройства. Режим дозирования и длительность курса зависят от показаний.
Литература
- Glynne P, Tahmasebi N, Gant V, Gupta R. Long COVID following mild SARS-CoV-2 infection: characteristic T cell alterations and response to antihistamines. Journal of Investigative 2022 Jan 1;70(1):61-7.
- Балыкова Л.А., Грановская М.В., Заславская К.Я. и др. Новые возможности направленной противовирусной терапии COVID-19: результаты многоцентрового клинического исследования эффективности и безопасности применения препарата Арепливир. Инфекционные болезни: новости, мнения, обучение. Том 9, № 3, 2020, 16-29.
- Краткий отчет о результатах клинического исследования «Открытое рандомизированное многоцентровое сравнительное исследование эффективности и безопасности препарата АРЕПЛИВИР, таблетки, покрытые пленочной оболочкой (ООО «ПРОМОМЕД РУС», Россия) у пациентов, госпитализированных с COVID-19»; ttps://promomed.ru/upload/iblock/9d2/482de2bwschpke9cn1cmxh4f96q9dqr6/АРЕПЛИВИР_к раткии. отчет КИ.pdf.
- Руженцова Т.А., Чухляев П.В., Хавкина Д.А., Гарбузов А.А., Никольская М.В., Разживина В.А., Филон О.В.; Ruzhentsova T.A., Oseshnyuk R.A.,Soluyanova TN et al. Phase 3 trial of coronavir (favipiravir) in patients with mild to moderate COVID-19. Am J Transl Res 2021;13(11):12575-12587. ajtr.org /ISSN:1943-8141/AJTR0125434.
- Пшеничная Н.Ю., Жданов К.В. и др. Предварительные результаты адаптивного рандомизированного открытого контролируемого исследования эффективности и безопасности препарата энисамия йодид для лечения госпитализированных больных с COVID-19. РМЖ. Медицинское обозрение. 2021;5(11):705–711. DOI: 10.32364/2587-6821- 2021-5-11-705-711.
- Мухамадиева Л.Р., Мавзютова Г.А., Мирсаева Г.Х. и др. Возможности иммунокоррекции в терапии COVID-19 у амбулаторных пациентов. РМЖ.Медицинское обозрение. 2021;5(7):468-472. DOI: 32364/2587-6821-2021-5-7-468-472.
- Костинов М. П. Ммунопатогенные свойства SARS-CoV-2 как основа для выбора патогенетической терапии //Иммунология. – – Т. 41. – №. 1. – С. 83-91.
- Efimov S. V. et al. The effect of azoximer bromide (Polyoxidonium®) in patients hospitalized with coronavirus disease (COVID-19): an open-label, multicentre, interventional clinical study//Drugs in Context. – 2021. – Т. 10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8007208/.
- Efimov S. V. et al. The effect of azoximer bromide (Polyoxidonium®) in patients hospitalized with coronavirus disease (COVID-19): an open-label, multicentre, interventional clinical study//Drugs in Context. – 2021. – Т. 10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8007208/.
- Мухамадиева Л. Р. и др. Возможности иммунокоррекции в терапии COVID-19 у амбулаторных пациентов// РМЖ «Медицинское обозрение».-2021. - №7 - 468-472.
- Малявин А.Г., Крихели Н.И., Рогова И.В. и соавт. Терапия пациентов с COVID-19: результаты оценки эффективности и безопасности включения препарата Ингавирин® в схему рекомендованной стандартной терапии в реальной клинической практике. Терапия. 2021, №5, 22-26.
- Крюков Е.В., Чернецов В.А., Паценко М.Б., и др. Алгоритмы ведения пациентов с новой коронавирусной инфекцией COVID-19 в стационаре: методические рекомендации. Consilium 2020;22(11) doi: 10.26442/20751753.2020.11.200520.
- Сабитов А.У., Сорокин П.В., Дашутина С.Ю. Эффективность и безопасность применения препарата Риамиловир в лечении пациентов с COVID-19. Антибиотики и химиотерапия, 2021, Т. 66, № 1-2:35-37.
- Касьяненко К.В., Мальцев О.В., Козлов К.В., и др. Клиническая эффективность и безопасность применения Риамиловира при лечении пациентов с инфекцией, вызванной SARS-CoV-2. Антибиотики и химиотерапия. 2020;65:11-2 doi: 0.37489/0235-2990-2020-65- 11-12-16-21.
- Xiaoke Wu, Kaijiang Yu, Yongchen Wang, Wanhai Xu, Hongli Ma, Yan Hou, Yue Li, Benzhi Cai, Liying Zhu, Min Zhang, Xiaoli Hu, Jingshu Gao, Yu Wang, Huichao Qin, Mingyan Zhao, Yong Zhang, Kang Li, Zhimin Du, Baofeng Yang. The Efficacy and Safety of Triazavirin for COVID-19: A Trial Protocol. Engineering (Beijing). 2020 Oct;6(10):1199-1204. doi: 1016/j.eng.2020.06.011.
- Фролова Ю.В., Голанова Н.М., Листраденкова Д.Г., Амон Е.П., Малинникова Е.Ю. Результаты наблюдательного пострегистрационного исследования эффективности и безопасности применения препарата трекрезан® у взрослых больных острой респираторной вирусной инфекцией. Терапия. 2021. Т. 7. № 8 (50). С. 172-181.
2.7.2 Ингаляции сурфактанта (С.Н. Авдеев)
В среднем у 40% пациентов после выписки из ковидного стационара сохраняется одышка на протяжении более 6 мес, а изменения на КТ легких продолжают обнаруживаться после острого периода инфекции у 76% лиц, госпитализированных в отделение реанимации и интенсивной терапии, еще в течение 6–12 мес [1,2].
Продолжительные рентгеноморфологические признаки поражения легких после COVID- 19 и сопутствующие симптомы обусловлены несколькими механизмами. Во-первых, разрастанием грануляционной ткани в просветах альвеол по типу организующейся пневмонии, которое является потенциально обратимым процессом, особенно под воздействием системных ГКС [3]. Во-вторых, посттромботической облитерацией капиллярного русла, которая со временем может быть преодолена за счет неоангиогенеза. Наконец, множественные участки альвеолярного коллапса и дистелектазы, наблюдаемые у больных COVID-19 в острой фазе заболевания, вероятно, определяют длительное на- рушение газообмена и сохранение зон «матового стекла» и консолидации на КТ высокого разрешения. Появление ателектазов в легких при COVID-19 связано с прямым повреждением SARS-CoV-2 альвеолоцитов II типа, продуцирующих эндогенный сурфактант и одновременно несущих на своей поверхности рецепторы к ангиотензинпревращающему ферменту [4,5].
Введение экзогенного сурфактанта способно привести к разрешению множественных ателектазов.
Легочный сурфактант представляет собой липопротеидный комплекс, покрывающий поверхность альвеолярного эпителия и располагающийся на границе раздела фаз воздух- гликокаликс [6,7]. Его основными компонентами являются липиды, более 80% из которых — фосфолипиды, а также холестерин, его эфиры, триглицериды, свободные жирные кислоты. Около 10% массы сурфактанта представлено сурфактант-ассоциированными белками [8]. Легочный сурфактант синтезируется альвеолоцитами 2-го типа (А-II), хранится в ламеллярных тельцах и секретируется в альвеолярное пространство.
В пилотном исследовании, проведенном в РФ, было показано, что у большинства пациентов, перенесших тяжелую COVID-19-пневмонию, выписанных из стационара с гипоксемией, после начала лечения сурфактантом к 10-му дню наблюдалась положи- тельная динамика – уменьшение признаков ДН, снижение потребности в кислородотерапии [3]. Наиболее значимое и более быстрое снижение потоков кислородной смеси наблюдалось у пациентов, получавших НИВЛ [3].
Методика приготовления эмульсии сурфактанта для ингаляций [9]
Для ингаляционной терапии используют эмульсию с содержанием Сурфактанта-БЛ от 5 до 15 мг в 1 мл физиологического раствора (содержимое флакона (75 мг) разводят в 5–10 мл физиологического раствора). В зависимости от тяжести повреждения легких и выраженности гипоксемии используют от 2 до 4 ингаляций 75–150 мг Сурфактанта-БЛ в сутки, обычно на протяжении 5 дней и более. Для ингаляции Сурфактанта-БЛ могут быть использованы струйные небулайзеры (аэрозоль образуется под воздействием потока воздуха) и так называемые меш-небулайзеры (аэрозоль образуется в результате колебаний сетки-мембраны). Меш-небулайзеры имеют некоторые преимущества перед струйными из-за более высокой производительности (до 0,5 мл в минуту). Меш-небулайзеры могут использоваться при спонтанном дыхании пациентов, а также встраиваться в дыхательный контур аппаратов во время проведения НИВЛ и ВПО [9].
Рекомендации:
Пациентам, перенесших тяжелую COVID-19-пневмонию, выписанным из стационара с гипоксемией (т.е. нуждающимся в кислородотерапии в домашних условиях), рекомендуется назначение ингаляционной терапии сурфактантом
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Для ингаляции Сурфактанта-БЛ могут быть использованы струйные небулайзеры или меш-небулайзеры; используют 2 ингаляции в сутки в дозе 75–150 мг Сурфактанта-БЛ, обычно на протяжении 10-14 дней.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Литература
- Cares-Marambio K, Montenegro-Jiménez Y, Torres-Castro R, Vera-Uribe R, Torralba Y, Alsina-Restoy X, Vasconcello-Castillo L, Vilaró J. Prevalence of potential respiratory symptoms in survivors of hospital admission after coronavirus disease 2019 (COVID-19): a systematic review and meta-analysis. Chronic Respiratory Disease 2021 Jan-Dec;18:14799731211002240.
- Sonnweber T, Tymoszuk P, Sahanic S, Boehm A, Pizzini A, Luger A, Schwabl C, Nairz M, Grubwieser P, Kurz K, Kop¬pelstätter S, Aichner M, Puchner B, Egger A, Hoermann G, Wöll E, Weiss G, Widmann G, Tancevski I, Löffler-Ragg J. Investigating phenotypes of pulmonary COVID-19 recovery: a longitudinal observational prospective multicenter trial. eLife 2022 Feb;11:e72500.
- Аверьянов А.В., Дивакова Т.И., Балионис О.И., Перкина А.С., Сотникова А.Г. Постковидное поражение легких с дыхательной недостаточностью: есть ли терапевтические инструменты? Практическая пульмонология 2021; №3: 15-18.
- Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS. Angio¬tensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 recep¬tor: molecular mechanisms and potential therapeutic target. Intensive Care Medicine 2020 Apr;46(4):586-90.
- Schousboe P, Ronit A, Nielsen HB, Benfield T, Wiese L, Scout¬aris N, Verder H, Berg RMG, Verder P, Plovsing RR. Reduced levels of pulmonary surfactant in COVID-19 ARDS. Scientific Reports 2022 Mar;12(1):4040.
- Розенберг О.А. Препараты легочного сурфактанта и сурфактант-терапия ОРДС в условиях хирургической реанимации (обзор литературы). Креативная хирургия и онкология 2019; 9(1): 55–65 https://doi.org/10.24060/2076-3093-2019-9-1-50-65.
- Clements J.A. Surface tension of lung extracts. Proc. Soc. Exp. Biol. Med. 1957; 95(1): 170– http://dx.doi.org/10.3181/00379727 95 23156. PMID: 13432025.
- King R.J., Clements J.A. Surface active materials from dog lung: composition andphysiological Am. J. Physiol 1972; 223(3): 715–726. PMID: 506862.
- Баутин А.Е. Применение препарата сурфактанта в комплексной терапии острого респираторного дистресс-синдрома. Методические рекомендации. 2021: 42с.
2.7.3 Антифибротическая терапия (И.В. Лещенко, А.Г. Малявин, А.В. Кривоногов, Т.В. Глушкова)
|
Таблица. Лечебная стратегия при возможных фибротических нарушениях в легких в постковидном периоде по данным ВРКТ (согласовано с проф. И.Е.Тюриным) |
||
|
Изменения на ВРКТ |
Лечебные Мероприятия |
Медикаментозная терапия |
|
Типичная картина организующейся пневмонии, сохраняющаяся от 4 до 12 недель в постковидном периоде |
Немедикаментозная терапия Симптоматическая терапия, О2- терапия (по показаниям) Рассмотреть возможность назначения средних/низких доз системных кортикостероидов [1, 2]* |
Преднизолон или другой ГКС в эквипотентной дозе: 25 мг/сут 1 нед.; 20 мг/сут 1 нед; 15 мг/сут 1 нед.; 10 мг/сут 1 нед.; 5 мг/сут 1 нед. 2,5 мг/сут 1 нед. Продолжительность 6 недель |
|
Фибротические изменения в легких: ретикулярные изменения с тракционными бронхоэктазами/ бронхиолоэктазами, с наличием или отсутствием «сотовой |
Немедикаментозная терапия Симптоматическая терапия, О2- терапия (по показаниям) Рассмотреть возможность назначения антифибротических препаратов [7-9] |
Нинтеданиб 300 мг/ сут или пирфенидон по схеме в течение 6 и более месяцев при сохраняющемся нарушении функциональных показателей (ФЖЕЛ < 70% и/или |
|
перестройки», сохраняющиеся 24 и более недель в постковидном периоде [3, 4]** |
|
DLco<60% от должных величин) |
|
Субплевральные ретикулярные изменения, «матовые» уплотнения сохраняющиеся от 4 до 12 недель в постковидном периоде [5, 6]*** |
Немедикаментозная терапия Симптоматическая терапия, О2- терапия (по показаниям) Рассмотреть возможность назначения N-ацетилцистеина [10] |
N-ацетилцистеин 1800 мг/сут в течение 3-6- месяцев при сохраняющихся патологических отклонениях от нормы функциональных показателей (ФЖЕЛ, DLcо) во время лечения без КТ признаков фиброобразования |
|
«Новые» эмфизематозные или кистозные изменения в легких |
Немедикаментозная терапия Симптоматическая терапия, О2- терапия (по показаниям) |
- |
|
Примечание: * - в зависимости от клинической ситуации по показаниям доза, кратность и продолжительность применения кортикостероидов может меняться на основе решения врачебного консилиума. Возможно применение низких суточных доз системных кортикостероидов (преднизолон 10 мг/сут) в течение всего лечебного периода [2]; ** - фибротические изменения в легких через 24 и более недели постковидного синдрома, могут быть связаны, как с недиагностируемыми до перенесенной НКИ, так и впервые определяемыми, в единичных случаях [3,4]; *** - КТ- паттерн «матового стекла», может не регрессировать полностью в течение последующих 12 месяцев³, коррелирует с нарушением функции внешнего дыхания□ и связан с персистирующим остаточным или автономным воспалением [5,6]. |
||
В заявлении Европейского респираторного общества о длительном наблюдении после COVID-19 подчеркивается [11]:
- несмотря на имеющиеся данные, неясно, представляют ли «фиброзоподобные» признаки на КТ необратимое заболевание (например, после ОРДС) или медленно регрессирующий инфильтрат, вторичный по отношению к организующейся пневмонии, также наблюдаемый с легкой деформацией, имитирующей настоящий фиброз;
- риск выраженного фиброза легких при контрольной КТ выше, по-видимому, при наличии ОРДС и в зонах с признаками организующейся пневмонии. Члены Рабочей группы ERS не называют такое искривление бронхов тракционными бронхоэктазами, которые по определению представляют собой установленный на КТ признак необратимого фиброза легких.
Большинство членов Целевой группы ERS проявляют осторожность при выявлении фиброза, особенно при раннем КТ, когда паренхиматозные изменения встречаются часто и более склонны к разрешению. Учитывая высокую долю пациентов, у которых развивается ОРДС или проводится ИВЛ, развитие фиброза легких остается проблемой.
Необходимы дополнительные данные визуализации [11].
Методы немедикаментозной терапии:
- Инспираторный тренинг: дыхательные упражнения. при коронавирусном поражении легких, вследствие повреждения альвеол для улучшения вентиляционной способности легких, улучшения механики дыхания, работы дыхательной мускулатуры.
- Вибрационно-перкуссионная терапия: метод сочетает механическое воздействие высокочастотной вибрацией и компрессией на грудную клетку
- Индивидуальные рекомендации по питанию – персонифицированные:
- витамин С;
- витамин D;
- витаминно-минеральные комплексы;
- мультивитамины + омега-3 ПНЖК;
- нутритивная поддержка;
- разработка индивидуальной диеты с учетом наличия сопутствующей патологии. Выявленные по данным ВРКТ ОГК фиброзоподобные изменения, сохраняющиеся в постковидном периоде более 24 недель, а также знания о механизмах возможного фиброзообразования при инфицировании SARS-CoV- 2, закономерно способствует обсуждению роли антифибротических препаратов в лечебной тактике COVID-19 [7-9]. Исследование 18 хирургических биопсий у пациентов, перенесших COVID-19 (в среднем на 145 день от острых симптомов) выявило в 9 случаях морфологический паттерн обычной интерстициальной пневмонии (ОИП) [12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5) В публикациях отражены результаты назначения антифибротических препаратов у пациентов с COVID-19 в разные сроки от появления первых симптомов заболевания. Так напимер, в Японии описан случай назначения нинтеданиба в комбинации с метилпреднизолоном 78-летней женщине на 75 день от острых симптомов заболевания с положительной динамикой в виде уменьшения потребности в проведении малопоточной кислородотерапии [13]. Учитывая, что тяжелая форма COVID-19, а также необходимость в проведения ИВЛ являются факторами риска развития фиброзных изменений в легочной ткани, проведено сравнительное исследование назначения нинтеданиба пациентам в ОРИТ с первого дня интубации [9]. Пациенты, получающие нинтеданиб в течение 28 дней на период проведения ИВЛ (препарат вводился через назогастральную трубку) (n=30), по сравнению с аналогичными пациентами, но не получающими нинтеданиб (n=30), имели меньшую продолжительность механической вентиляции легких, меньший объем поражения легких при контрольном исследовании, но не имели преимущества в выживаемости [9]. В таком случае, назначение нинтеданиба может дать потенциальные преимущества для возможного уменьшения повреждения легких при COVID-19 за счет влияния на механизмы фиброзообразования [14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Выявленные патофизиологические сходства механизмов фиброзообразования при COVID-19 и ИЛФ предполагает и использование схожей терапевтической тактики [15]. Группа антифибротических препаратов, используемых для лечения ИЛФ, представлена двумя препаратами: нинтеданиб и пирфенидон. Нинтеданиб ингибирует тирозинкиназу, действует на фактор роста фибробластов (FGF), PDGF и фактор роста эндотелия сосудов (VEGF), а также ингибирует каскады активации фибробластов и миофибробластов [16- 18]. Пирфенидон оказывает прямое ингибирующее влияние на один из самых мощных факторов фиброзообразования – TGF-β, активация которого запускает каскад фиброзообразования как при ИЛФ, так и при COVID-19 [19]. Кроме этого, пирфенидон регулирует передачу сигналов к рецепторам АПФ, обладает противовоспалительным свойством, ингибирует CTGF, ТNF-α, уменьшает оксидативный стресс, апоптоз, а также влияет на регуляцию гиулоронана, основного компонента ECM [19-21].
В рекомендациях по наблюдению и лечению пациентов с длительным COVID-19, разработанных группой экспертов из Швейцарии, рассматривается вопрос о назначении антифибротических препаратов [8]. Стоит отметить, что эксперты оставляют вопрос открытым, учитывая отсутствие завершенных рандомизированных клинических исследований (NCT04619680, NCT04541680, NCT04338802 – нинтеданиб; NCT04607928, NCT04653831 – пирфенидон) и резюмируют об отсутствии ясности в необходимости их назначения [8].
Учитывая знания о механизмах фиброзообразования при COVID-19, положительный опыт использования препаратов в клинической практике, назначение антифибротических препаратов, стоит, однако, рассматривать в качестве лечебной стратегии у некоторой части пациентов с COVID-19.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
В России проведено национальное многоцентровое открытое проспективное когортное исследование DISSOLVE, которое включало 13 центров и было посвящено оценке эффективности и безопасности бовгиалуронидазы азоксимера в профилактике и лечении поствоспалительного пневмофиброза и интерстициальных заболеваний легких после COVID-19, осложненного легочными проявлениями (07.20–07.21). В интерстициальной ткани накапливается большое количество гиалуроновой кислоты, которая стимулирует пролиферацию фибробластов, которые, в свою очередь, трансформируются в миофибробласты. В совокупности это приводит к феномену «жженой резины», когда объем легочной ткани начинает уменьшаться. Одна из целей предотвращения ЛФ – вмешательство в метаболизм гиалуроновой кислоты. Дисбаланс между гиалуроновой кислотой и ферментом гиалуронидазой, имеющимися различные генетические контроллеры, характерен для острых состояний и повреждений. Патогенетическая терапия с применением бовгиалуронидазы азоксимера направлена на выравнивание этой диспропорции, т. к. способствует энзиматической деградации гиалуроновой кислоты. Под действием гиалуронидазы уменьшается количество гиалуроновой кислоты, что изменяет целый ряд параметров. Так, например, резко возрастает количество лимфоцитов, т. к. высокий уровень гиалуроновой кислоты имеет прямое отношение к смерти клеток. Под воздействием бовгиалуронидазы азоксимера восстанавливается нормальная структура легочной ткани, регрессируют проявления ЛФ. В исследовании DISSOLVE оценивалась эффективность назначения бовгиалуронидазы азоксимера не позднее 2 мес. после острой фазы НКВИ у пациентов с остаточными COVID-ассоциированными поражениями легких. Показано преимущество раннего назначения данного препарата в действии на легочную функцию. Пациенты, которым был назначен бовгиалуронидазы азоксимер, обладающий антифибротическим потенциалом, демонстрировали достоверно более ранние и быстрые сроки восстановления клинико-функциональных показателей по сравнению с группой контроля. У этих пациентов отмечено более выраженное снижение одышки по шкале mMRС, повышение толерантности к физической нагрузке по данным 6-МШТ и повышение уровня SpO2 в покое. Наиболее выраженный эффект бовгиалуронидазы азоксимера был выявлен у пациентов с более тяжелым поражением функции легких, когда ФЖЕЛ статистически значимо повышалась как относительно исходного значения, так и по завершении периода наблюдения (на 180-й день). Рекомендуется назначение бовгиалуронидазы азоксимера у пациентов с остаточными COVID-ассоциированными поражениями легких (3000 ME в 2,0 мл 0,5 %-ного раствора новокаина внутримышечно 1 раз в 5 дней или в ректальных свечах 1 раз в 3 дня курсом 15 процедур) [22].
Критерии назначения антифибротических препаратов:
- фиброзные изменения в легких по данным ВРКТ (паттерн ОИП или вероятной ОИП) или
- сохраняющиеся фиброзоподобные изменения в легких по данным ВРКТ в течение 6месяцев от начала заболевания в сочетании с:
- SpO2 ≤89% в покое или после теста с 6-МШП
- ФЖЕЛ <70% и/или DLco <60% от должных величин или
- снижение ФЖЕЛ ≥10% и/или DLco ≥15% в течение 3-6 мес в сравнении с исходными величинами, измеренными впервые в период от 4 до 12 недот острых симптомов COVID- 19
- отсутствие других известных причин развития фиброзирующих ИЗЛ.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
В крайне тяжелых случаях COVID-19 альтернативным лечением может стать проведение трансплантации легких [23]. По данным гистологического исследования легочной ткани экплантированных легких обнаруживаются дтффузное альвеолярной повреждение (ДАП), кровотечение, участки сотового легкого, организующаяся пневмония, волокна фибрина, утолщение интерстиция [24, 25].
Литература
- Myall K.J., Mukherjee B., Castanheira A.M. et al. Persistent Post-COVID-19 Interstitial Lung An Observational Study of Corticosteroid Treatment. Ann. Am. Thorac. Soc. 2021; 18(5): 799-806. DOI:10.1513/AnnalsATS.202008-1002OC.
- Dhooria S, Chaudhary S, Sehgal IS, et al. High-dose versus low-dose prednisolone in symptomatic patients with post-COVID-19 diffuse parenchymal lung abnormalities: an open- label, randomised trial (the COLDSTER trial). Eur Respir J 2022; 59: 2102930 [DOI: 1183/13993003.02930-2021.
- Hyun Lee, Hayoung Choi, Bumhee Yang et al. Interstitial lung disease increases susceptibility to and severity of COVID-19. Eur Respir J 2021; 58:
- Li X., Shen C., Wang L. et al. Pulmonary fibrosis and its related factors in discharged patients with new corona virus pneumonia: a cohort study. Respir. Res. 2021; 22: 203. doi:10.1186/s12931-021-01798-6.
- Wu X., Liu X., Zhou Y. et al. 3-month, 6-month, 9-month, and 12-month respiratory outcomes in patients following COVID-19-related hospitalisation: a prospective Lancet Respir. Med. 2021; 9: 747-754. doi:10.1016/S2213-2600(21)00174-0.
- Frija-Masson J., Debray M-P., Boussouar S. et al. Residual ground glass opacities three months after Covid-19 pneumonia correlate to alteration of respiratory function the post Covid M3 Respir Med 2021; 184: 106435. doi:10.1016/j.rmed.2021.106435
- Seifirad S. Pirfenidone: A novel hypothetical treatment for COVID-19. Hypotheses. 2020; 144: 110005. DOI:10.1016/j.mehy.2020.110005.
- Funke-Chambour M., Bridevaux P.O., Clarenbach C.F.et al. Swiss COVID Lung Study Group and the Swiss Society of Swiss Recommendations for the Follow-Up and Treatment of Pulmonary Long COVID. Respiration 2021; 100(8): 826-841. DOI: 10.1159/000517255.
- Umemura Y., Mitsuyama Y., Minami K. et al. Efficacy and safety of nintedanib for pulmonary fibrosis in severe pneumonia induced by COVID-19: An interventional study. Int. J. Dis. 2021; 108: 454-460. DOI: 10.1016/j.ijid.2021.05.055.
- Micheletto et al. European Review for Medical and Pharmacological Sciences 2022; 26: 4872-4880.
- Katerina M. Antoniou et al. European Respiratory Society statement on long COVID follow- Eur. Resp. J. 2022 60: 2102174; DOI: 10.1183/13993003.02174-2021.
- Konopka K.E., Perry W., Huang. Usual Interstitial Pneumonia is the Most Common Finding in Surgical Lung Biopsies from Patients with Persistent Interstitial Lung Disease Following Infection with SARS-CoV-2 [published online ahead of print, 2021 Nov 23]. 2021; 101209. DOI:10.1016/j.eclinm.2021.101209.
- Ogata H., Nakagawa T., Sakoda S. et al. Nintedanib treatment for pulmonary fibrosis after coronavirus disease-19. Case Rep. 2021; 9(5): e00744. DOI: 10.1002/rcr2.744.
- Vitiello A, Pelliccia C, Ferrara F. COVID-19 Patients with Pulmonary Fibrotic Tissue: Clinical Pharmacological Rational of Antifibrotic Therapy [published online ahead of print, 2020 Aug 27]. SN Compr. Clin. Med. 2020; 1-4. DOI: 1007/s42399-020-00487-7.
- Grześk G., Woźniak-Wiśniewska A., Błażejewski J. et al. The interactions of nintedanib and oral anticoagulants-molecular mechanisms and clinical implications. Int. J. Mol. Sci. 2020; 22:
- Richeldi L. et al. Efficacy and Safety of Nintedanib in Idiopathic Pulmonary Fibrosis. New England Journal of 2014; 370: 2071-2082. Published online on May 18, 2014.
- Richeldi L. et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J 2011; 365: 1079-1087.
- Wollin L., et al. Antifibrotic and Anti-inflammatory Activity of the Tyrosine Kinase Inhibitor Nintedanib in Experimental Models of Lung Fibrosis. J. Pharmacol. Exp. Ther. 2014; 349: 209–
- Lin X., Yu M., Wu K. et al. Effects of pirfenidone on proliferation, migration, and collagen contraction of human Tenon's fibroblasts in vitro. Investigative ophthalmology & visual science. 2009; 50(8): 3763-70.
- Grattendick K.J., Nakashima J.M., Feng L. et al. Effects of three anti-TNF-alpha drugs: etanercept, infliximab and pirfenidone on release of TNF-alpha in medium and TNF-alpha associated with the cell in vitro. Int Immunopharmacol. 2008; 8(5): 679-87. DOI: 1016/j.intimp.2008.01.013.
- Tzouvelekis A, Wolters PJ. Pirfenidone in the kaleidoscope: reflecting mechanisms through different Eur. Respir. J. 2018; 52(5): 1802046. DOI: 10.1183/13993003.02046-2018.
- Статистический отчет исследования DISSOLVE 0 от 20.09.2021.
- Chen X.J., Li K., Xu L. et al. Novel insight from the first lung transplant of a COVID-19 Eur. J. Clin. Invest. 2021; 51(1): e13443. DOI: 10.1111/eci.13443.
- Bharat A., Querrey M., Markov N.S. et al. Lung transplantation for pulmonary fibrosis secondary to severe COVID-19. Sci. Transl. 2020; 12(574): eabe4282. DOI: 10.1101/2020.10.26.20218636.
- Croci G.A., Vaira V., Trabattoni D. et al. Emergency Lung Transplantation after COVID-19: Immunopathological Insights on Two Affected Patients. Cells. 2021; 10(3): 611.DOI: 10.3390/cells10030611.
2.7.4 Продолженная антитромботическая и дезагрегантная терапия (Т.В. Адашева)
- С учетом патогенеза органных повреждений при COVID-19 и значении сосудистой дисфункции и гиперкоагуляции в отдаленном периоде после перенесенной коронавирусной инфекции антитромботическая терапия имеет огромное значение. Следует рассмотреть несколько клинических сценариев.
- Наличие показаний к длительной терапии антикоагулянтами и/или дезагрегантами: ФП, ТГВ/ТЭЛА в анамнезе, протезы клапанов, тромбофилии, периферический атеросклероз, НМК в анамнезе, ИБС, ОКС, стентирование в анамнезе. Необходимо продолжить прием препаратов или инициировать терапию в соответствии с текущими рекомендациями. Пересмотреть показания для пролонгации терапии.
У пациентов с имеющимися ССЗ определяющими показаниями к приему ацетилсалициловой кислоты (АСК) и других дезагрегантов следует рассмотреть возможность продолжения приема препаратов во время коронавирусной инфекции и после перенесенного заболевания.
- Нет показаний к антитромботической терапии. Текущие рекомендации позволяют пролонгировать терапию антикоагулянтами до 45 дней после выписки в соответствии с рассчитанным тромботическим риском. В соответствии с текущими рекомендациями Минздрава – продленная профилактика ТГВ (вплоть до 30-45 дней после выписки) рекомендуется при сохраняющемся повышенном тромботическом риске у пациентов при наличии одного из следующих признаков: возраст старше 60 лет, госпитализация в ОРИТ, активное злокачественное новообразование, ТГВ/ТЭЛА в анамнезе, известная тромбофилия, сохраняющееся выраженное ограничение подвижности, концентрация D- димера в крови, в 2 и более раза превышающая верхнюю границу нормы. ПрофилактикуТГВ нижних конечностей/ТЭЛА стоит рассматривать для больных со среднетяжелой формой COVID-19, которые лечатся дома и имеют высокий риск венозных тромбоэмболических осложнений, низкий риск кровотечений. Длительность применения антикоагулянтов при амбулаторном лечении COVID-19 не ясна, и, по-видимому, может продолжаться вплоть до 30 суток в зависимости от динамики клинического состояния пациента и сроков восстановления двигательной активности [1].
Нет оснований пролонгации применения антикоагулянтов более 30 для амбулаторных пациентов и более 45 дней после выписки из стационара с целью тромбопрофилактики, без четких показаний. С точки зрения некоторых исследователей анализ клинического статуса пациентов: гиперкоагуляционное состояние, повышение СРБ, Д-димера, фибриногена позволяют не использовать унифицированную стратегию длительности применения АК после у пациентов с синдромом длительного COVID-19 [2].
С учетом отсутствия клинических показаний для пролонгации терапии оральными антикоагулянтами в долгосрочной перспективе могут быть использованы эндотелийкорректоры и антитромботические препараты с альтернативными механизмами действия, не требующие контроля гипокоагуляции и имеющие низкий риск кровотечений (сулодексид).
Сулодексид занимает особое место между вазопротекторами, гепаринами, антиагрегантами и активаторами фибринолиза. Эффекты сулодексида связаны с восстановлением гликокаликса, защитного барьера эндотелия, расположенного на его поверхности. Улучшение целостности гликокаликса не только восстанавливает барьерную функцию эндотелия, но также позволяет эндотелиоцитам модулировать генерацию ключевых воспалительных молекул, включая ИЛ-1β, ИЛ-6, ИЛ-8 и ФНО-α, а также подавлять ответ эндотелия на эти молекулы [3-4].
Важная характеристика препарата – низкий риск кровотечений, так как его антитромботическая активность при пероральном приеме является результатом многофакторного действия препарата на сосудистую стенку (ангиопротектор), профибринолитического действия и ингибирование адгезии тромбоцитов без антикоагулянтного действия. Не требует рутинного контроля показателей коагуляции. В соответствии с европейскими рекомендациями по ведению острого легочного эмболизма препарат рекомендуется к применению для продленной профилактики венозных тромбэмболических осложнений при невозможности применения оральных антикоагулянтов [5-7].
В отличии от прямых оральных антикоакулянтов, целесообразность применения которых после перенесенной коронавирусной инфекции связана с профилактикой тромботических событий, применение сулодексида, помимо безопасной профилактики тромбоза, благодаря коррекции эндотелиальной функции позволяет облегчить симптомы постковидного синдрома и улучшить параметры микроциркуляции [8,9].
Литература
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 16, 18.08.2022
- Siddiqi H.K., Libby P., Ridker Р.M. .et al. COVID-19 – A vascular disease. Trends in Cardiovascular Medicine 31 (2021) 1–5 https://doi.org/10.1016/j.tcm.2020.10.005
- Broekhuizen L.N., Lemkes B.A., Mooij H.L. et al. Effect of sulodexide on endothelial glycocalyx and vascular permeability in patients with type 2 diabetes mellitus. Diabetologia. 2010; 53 (12): 2646–2655.
- Masola Glycosaminoglycans, proteoglycans and sulodexide and the endothelium: biological roles and pharmacological effects International angiology: a journal of the International Union of Angiology · June 2014
- Mannello F., Ligi D., Сanale M. and Raffetto J. Sulodexide Down-Regulates the Release of Cytokines, Chemokines and Leukocyte Colony Stimulating Factors from Human Macrophages: Role of Glycosaminoglycans in Inflammatory Pathways of Chronic Venous. Current Vascular Pharmacology, 12, no. 1, pp. 173-185, 2014
- 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Epub 2020 Jan 30
- Management of chronic venous disorders of the lower limbs. Guidelines According to Scientific Part II. journal of the International Union of Angiology · March 2020 DOI: 10.23736/S0392-9590.20.04388-6].
- Charfeddine S, Ibnhadjamor H, Jdidi J, Torjmen S, Kraiem S, Bahloul A, Makni A, Kallel N, Moussa N, Boudaya M, Touil I, Ghrab A, Elghoul J, Meddeb Z, Thabet Y, Ben Salem K, Addad F, Bouslama K, Milouchi S, Hammami R, Abdessalem S, Abid L. Sulodexide Significantly Improves Endothelial Dysfunction and Alleviates Chest Pain and Palpitations in Patients With Long-COVID-19: Insights From TUN-EndCOV Study. Front Cardiovasc Med. 2022 May 12;9:866113. doi: 10.3389/fcvm.2022.866113. PMID: 35647070; PMCID:
- Андожская Ю. С. Возможности высокочастотной ультразвуковой допплерографии в оценке микроциркуляторных расстройств у больных сердечно-сосудистого профиля,перенесших COVID-19 / Ю. С. Андожская // Регионарное кровообращение и микроциркуляция. – 2021. – Т. 20. – № 4(80). – С. 101-105. – DOI 10.24884/1682-6655- 2021-20-4-101-105. – EDN QZSKMK.
2.7.5 Тактика ведения пациентов с легочными кистами и развитием осложнений (пневмоторакс, пневмомедиастинум и др.) (А.Г. Малявин)
Особую проблему при Long-COVID-19 может представлять относительно редкое формирование в продуктивную фазу воспаления тонкостенных легочных кист вследствие ремоделирования ткани легких после внутриальвеолярных кровоизлияний. Как правило, они не требуют специального вмешательства, поскольку имеют тенденцию обратного развития и практически никогда не нагнаиваются.

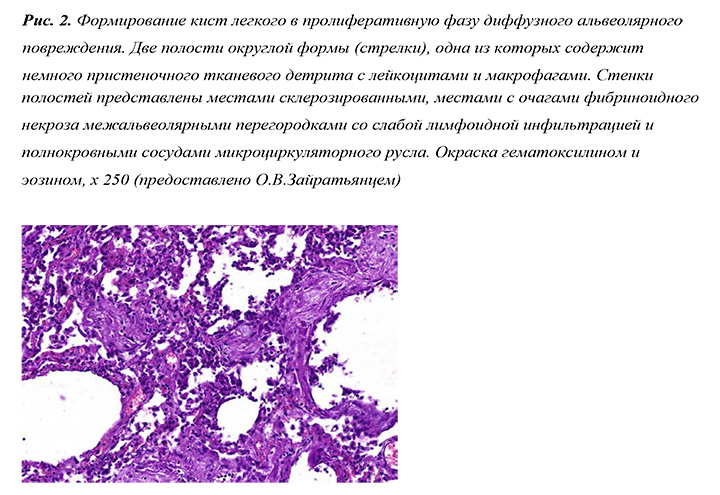
Тем не менее при субплевральном расположении кист нередко развивается пневмоторакс и пневмомедиастинум. Лечебная тактика в этом случае сводится в дренировании плевральной полости с целью формирования открытого пневмоторакса и спонтанного закрытия дефекта легочной ткани. В ряде случаев необходима активная аспирация из дренажа. Радикальное хирургическое вмешательство (торакоскопия, плевродез или диссекция кист) крайне ограничено и показано только при множественных рецидивах пневмоторакса и неэффективности консервативной терапии.



