1.1 Клиническое определение (С.Н. Авдеев, А.А. Зайцев, А.Г. Малявин)
В основе патогенеза заболевания лежит вирусная инфекция с преимущественным поражением альвеолоцитов II типа, эндотелиальных клеток, клеток иммунной системы. В результате в разные временные промежутки от дебюта инфекции разворачивается вирусное, цитокиновое, микрососудистое повреждение, протекающее с нарушением газообменной функции легких [1-3].
Его клинико-морфологическая характеристика существенно отличается от пневмонических изменений в традиционном понимании этого патологического процесса. По морфологической сущности это поражение весьма сходно с обычной интерстициальной пневмонией, но обязательное присутствие тромбогеморрагического компонента придает ему специфические черты.
В связи с этим целесообразно выделять формы заболевания без поражения и с поражением основного органа «мишени» -легких, используя при этом термин не пневмония, а «повреждение» или вирусное «поражение» [2-4]. Это дает возможность дистанцировать изменения легких у пациентов с COVID-19 от тех, которые имеются при
«классической» пневмонии. Такие состояния как ОРДС, ДВС-синдром, тромбозы и тромбоэмболии стоит рассматривать как осложнения заболевания. В этом случае и нозокомиальная бактериальная пневмония находит свое законное место в осложнениях болезни и именно это состояние является единственным показанием к назначению антимикробной терапии. И конечно сепсис, септический шок – развиваются вследствие присоединения бактериальной инфекции. Ряд авторов считают возможным использовать термины «сепсис» и «септический шок» при тяжелом течении COVID-19 с возможной генерализацией вирусной инфекции и развитием синдрома полиорганной недостаточности. Однако сам факт существования вирусного сепсиса разделяется не всеми специалистами. В итоге сформулированный диагноз в полной мере отражает клиническое представление о больном, становится основой для обоснованного рационального выбора диагностических и лечебных решений.
1.1.1. Клинические варианты COVID-19
Инаппарантная (субклиническая) форма
Острая респираторная вирусная инфекция легкого течения Вирусное поражение легких
Вирусное поражение других органов и систем
Осложнения: ОДН, ОРДС, нозокомиальная пневмония, тромбозы/тромбоэмболии артерий и/или вен, синдром диссеминированного внутрисосудистого свертывания, и др.
1.1.2. Пример формулировки диагноза:
Основное заболевание:
Новая коронавирусная инфекция (COVID-19), подтвержденная ПЦР тестом (номер и дата исследования), тяжелое течение. Двустороннее вирусное поражение легких. U07.1
Осложнения: ОРДС, ОДН. Нозокомиальная двусторонняя нижнедолевая пневмония, вызванная K. pneumoniae.
Такая формулировка диагноза дает полное представление о заболевании, а специалист получает достаточно информации для обоснования и начала стартовой терапии. Она складывается из нескольких направлений. Это противовирусное лечение, если сроки заболевания не превышают 5 суток, противовоспалительная, антикоагулянтная и симптоматическая терапия.
Подтвержденныи□ случаи□ COVID-19
Положительныи□ результат лабораторного исследования на наличие РНК SARS-CoV-2
с применением методов амплификации нуклеиновых кислот (МАНК) или антигена SARS- CoV-2 c применением иммунохроматографического анализа вне зависимости от клинических проявлении□.
Литература
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции COVID-19». Версия 15 (22.02.2022).
- Зайцев А.А., Чернов С.А., Крюков Е.В., Голухова Е.З. Рыбка М.М. Практический опыт ведения пациентов с новой коронавирусной инфекцией COVID-19 в стационаре (предварительные итоги и рекомендации). Лечащий врач. 2020, №6, с. 76-80.
- Зайцев А.А. Письмо в редакцию. Клиническая микробиология и антимикробная химиотерапия. 2020; 22(2):84-86. doi: 10.36488/cmac.2020.2.84-86.
- Зайцев А.А., Чернов С.А., Стец В.В., Паценко М.Б., Кудряшов О.И., Чернецов В.А., Крюков Е.В. Алгоритмы ведения пациентов с новой коронавирусной инфекцией COVID- 19 в стационаре. методические рекомендации. Consilium 2020. Т. 22., №11,с. 91-97.
1.2 Патоморфология острого повреждения легких (О.В. Зайратьянц, М.В. Самсонова, А.Л. Черняев)
Патоморфология поражения легких при COVID-19 была детально изучена по материалам большого числа патологоанатомических вскрытий умерших от тяжелой формы заболевания. Поражение легких было выявлено во всех таких аутопсиях. Легкие, как правило, были увеличены в размерах, заполняли весь объем грудной полости. Масса обоих легких составила, в среднем, 1450 г. (700-3200 г., при норме – 700-1100 г.).
Макроскопически типична картина «шоковых легких»: лаковый вид темно-вишневой поверхности легких, резиновая плотность ткани, на разрезе от темно-вишневого до коричневато-красного цвета при наличии маловоздушности, с поверхностей разрезов стекала малиновая непрозрачная густая жидкость, с трудом выдавливаемая из ткани. Как правило, в передних отделах наблюдаются участки острого вздутия, встречались ателектазы (дистелектазы), геморрагические инфаркты, а также и кровоизлияния, местами сливающиеся между собой различных размеров, иногда захватывая целые доли. В части наблюдений уже макроскопически были обнаружены обтурирующие тромбы в ветвях легочных артерий и вен, тромбоэмболы легочных артерий разного калибра. На поздних сроках легкие были уплотнены, на разрезе в этих зонах ткань была сероватого или серовато-желтого цвета.
При гистологическом исследовании выявляются изменения, изестные как экссудативная (ранняя) и пролиферативная (поздняя) фазы диффузного альвеолярного повреждения (ДАП). В экссудативной фазе ДАП в легочной ткани наблюдаются выраженный внутриальвеолярный отек, гиалиновые мембраны, выстилающие контуры респираторных бронхиол, альвеолярных ходов и мешочков, альвеол в виде полосок разной толщины.
Одним из обязательных морфологических признаков при вирусным воздействии является повреждение эпителия в виде десквамации бронхиального и значительной степени альвеолярного эпителия (альвеолоцитов I и II типа) с одновременной пролиферацией альвеолоцитов II типа. Кроме того, имеет место цитопатическое повреждения эпителия с появлением уродливых альвеолоцитов, характеризующихся разнообразием форм, изменением ядра с появлением ядрышек, атипических митозов, в части клеток обнаруживали просветления вокруг ядра в виде гало, а также округлые базофильные включения в цитоплазме. В просветах альвеол нередко встречались небольшие симпласты, а в части наблюдений многоядерные альвеолоциты и макрофаги. В десквамированном бронхиальном эпителии наблюдали эпителиоциты с укрупненными ядрами. В части наблюдений в просветах бронхов, бронхиол и альвеол был обнаружен фибрин. У большинства пациентов имело место полнокровие ветвей легочных артерий и вен, капилляров межальвеолярных перегородок с повреждением и десквамацией эндотелиоцитов, при наличии сладжей эритроцитов, организующимися и фибриновыми тромбами, очагами периваскулярных кровоизлияний, внутрибронхиолярное и внутриальвеолярное скопление эритроцитов. В эндотелии сосудов у пациентов с COVID- 19 обнаружена выраженная экспрессия FVIII. Интерстициальное воспаление в эту фазу представлено преимущественно лимфоидной инфильтрацией межальвеолярных перегородок и довольно выраженным внутриальвеолярным скоплением лимфоцитов и макрофагов с примесью нейтрофильных лейкоцитов. В редких наблюдениях в цитоплазме альвеолярных макрофагов наблюдали фагоцитированные фрагменты клеток и эритроциты.
В пролиферативную фазу ДАП, которая выявлялась у умерших с продолжительностью заболевания, в среднем, 17 суток (от 9 до 23 суток), наблюдали внутриальвеолярные скопления фибрина разной степени зрелости, отек межальвеолярных перегородок разной степени выраженности с инфильтрацией их лимфоцитами, плазматическими клетками, макрофагами, единичными нейтрофилами, у части пациентов обнаружили миксоидный отек межальвеолярных перегородок и периваскулярной соединительной ткани; имели место пролиферация фибробластов, а также выраженное интерстициальное воспаление и отложения коллагена в стенках альвеол, что прявлялось выраженным утолщением межальвеолярных перегородок. В просветах альвеол наблюдали организацию фибрина с появлением разрозненных фибробластов, разрастания фибробластической полиповидной ткани в просветах альвеол и респираторных бронхиол. У части пациентов были обнаружены очаговые участки молодой соединительной ткани в виде «клубочков».
Наряду с вышеописанными изменениями наблюдаются репаративные изменения бронхиолярного и альвеолярного эпителия в виде пролиферации альвеолоцитов 2 типа и плоскоклеточной метаплазии. Кроме того, встречаются участки фиброателектазов, состоящих из нежной соединительной ткани с небольшим количеством коллагеновых волокон и пролиферацией гладких мышц. В 13% наблюдений в пролиферативной фазе ДАП в полостях альвеол среди разрастаний соединительной ткани были обнаружены мелкие очаги ее костной метаплазии.
Во многих наблюдениях с длительностью заболевания более 9 суток, было характерно сочетание экссудативной и пролиферативной фаз ДАП в разных отделах легких.
|
Таблица. Частота встречаемости гистологических признаков поражения легких по материалам аутопсий умерших от тяжелой формы COVID-19 |
|
|
Отек |
104 (84,55%) |
|
Крахмальные тельца |
9 (7,32%) |
|
Гиалиновые мембраны |
99 (80,49%) |
|
Цитотоксический эффект |
63 (51,22%) |
|
Десквамация бронхов |
92 (74,80%) |
|
Метаплазия эпителия бронхов |
35 (28,45%) |
|
Десквамация эпителия альвеол |
91 (73,98%) |
|
Метаплазия эпителия альвеол |
60 (48,78%) |
|
Мегакариоциты |
37 (30,08%) |
|
Макрофаги в альвеолах |
89 (72,36%) |
|
Плазматические клетки в альвеолах |
73 (53,35%) |
|
Нейтрофилы |
40 (32,52%) |
|
Эритроциты в альвеолах |
93 (75,6%) |
|
Эритроциты в бронхах |
15 (12,2%) |
|
Сидерофаги и гемосидерин в альвеолах |
46 (37,36) |
|
Инфаркты/кровоизлияния |
51 (41,46%) |
|
Тромбы в артериях |
60 (42,78%) |
|
Тромбы в венах |
31 (25,20%) |
|
Микротромбы (в капиллярах, артериолах, венулах) |
12 (9,76%) |
|
Отечная миксоидная строма |
11 (8,94%) |
|
Интерстициальное воспаление |
69 (56,1%) |
|
Фибрин в альвеолах |
80 (65,04%) |
|
Фибрин в бронхах |
6 (4,9%) |
|
Соединительная интраальвеолярная ткань |
61 (49,59%) |
|
Фиброз межальвеолярных перегородок |
16 (13,01%) |
|
Полнокровие межальвеолярных перегородок |
17 (13,82%) |
|
Острое вздутие |
15 (12,20%) |
|
Аспирация |
3 (2,44%) |
|
Костные балки в альвеолах |
7 (5,69%) |
|
Васкулит/микроваскулит |
10 (8,13) |
|
Бактериальная пневмония |
30 (24,39%) |
Гистологические изменения, косвенно свидетельствующие в пользу нарушения коагуляции, а именно появление внутриальвеолярных кровоизлияний, тромбов в ветвях легочных артерий и вен были обнаружены при всех фазах заболевания. В 18,5% наблюдений имели место признаки иммунного васкулита в виде лимфоидной инфильтрации стенок сосудов. При этом лейкоцитарный васкулит и эндотелиит был обнаружен при присоединении в 24,4% наблюдений бактериальной пневмонии. В капиллярах межальвеолярных перегородок более чем в трети наблюдений обнаруживали мегакариоциты. При этом в капиллярах межальвеолярных перегородок были обнаружены сладжи эритроцитов, а в ветвях легочных артерий и вен – фибриново-эритроцитарные микротромбы и сладжи эритроцитов с частичным их лизисом.
Изменения в плевре были выявлены в единичных наблюдениях в виде очаговой лимфоплазмоцитарной инфильтрации, соответствовавшие мелким белесоватым высыпаниям, определявшимся на висцеральной плевре при макроскопическом исследовании.
При long COVID изменения в легких соответствовали пролиферативной фазе ДАП.
Литература
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции COVID-19». Версия 15 (22.02.2022).
- Зайратьянц О.В., Малявин А.Г., Самсонова М.В., Черняев А.Л., Мишнев О.Д., Михалева Л.М., Крупнов Н.М., Калинин Д.В. Патоморфологические изменения в легких при COVID-19: клинические и терапевтические параллели. Терапия. 2020. Т. 6., № 5(39), С. 35-46. DOI: 18565/therapy.2020.5.35-46
- Зайратьянц О.В. (ред.), Каниболоцкий А.А., Михалева Л.М., Мишнев О.Д., Савелов Н.А., Авдалян А.М., Астахова О.И., Варясин В.В., Волков А.В., Волобуева Е.А., Даабуль А.С., Добряков А.В., Золотенкова Н.В., Келли Е.И., Медников Г.Н., Орехов О.О., Петрова С.Ю., Тишкевич О.А., Цыганов С.Е. Новая коронавирусная инфекция (COVID-19). Организация работы московской патологоанатомической службы. Временные методические рекомендации ДЗМ, Москва, (Версия 4 от 28.10.2021).
- Mikhaleva LM, Cherniaev AL, Samsonova MV, Zayratyants OV, Kakturskiy LV, Vasyukova OA, Birukov AE, Kontorshchikov AS, Sorokina AV and Sinelnikov Pathological Features in 100 Deceased Patients With COVID-19 in Correlation With Clinical and Laboratory Data. Pathology & Oncology Research. 27:1609900. doi: 10.3389/pore.2021.1609900.
- Патологическая анатомия легких при COVID-19. Атлас. Зайратьянц О.В., Cамсонова М.В., Михалева Л.М., Черняев А.Л., Мишнев О.Д., Крупнов Н.М. Под общей ред. О.В. Зайратьянца. Москва; Рязань; Издательство ГУП РО «Рязанская областная типография», 2020. – 52 с., ил.
- Патологическая анатомия COVID-19: Атлас. Зайратьянц О.В., Самсонова М.В., Михалева Л.М., Черняев А.Л., Мишнев О.Д., Крупнов Н.М., Калинин Д.В. Под общей ред. О.В.Зайратьянца. Москва, ГБУ «НИИОЗММ ДЗМ», 2020, 140 с., ил.
- Родионов В.Э., Авдалян А.М., Коновалов Д.М., Борискин Н.В., Тюрин И.Н., Проценко Д.Н., Зайратьянц О.В., Филипенко М.Л., Оскорбин И.П., Корюков М.А.Особенности клеточного состава воспалительного инфильтрата в разные фазы диффузного альвеолярного повреждения легких при COVID-19. Архив патологии. 2022. Т. 84., №3. С. 5-13.
- Самсонова М.В., Михалева Л.М., Зайратьянц О.В., Варясин В.В., Быканова А.В., Мишнев О.Д., Березовский Ю.С., Тишкевич О.А., Гомзикова Е.А., Черняев А.Л., Хованская Т.Н. Патология легких при COVID-19 в Москве. Архив патологии. Т. 82,№4. С. 32-40. doi: 10.17116/patol20208204132
- Самсонова М.В., Черняев А.Л., Омарова Ж.Р., Першина Е.А., Мишнев О.Д., Зайратьянц О.В., Михалева Л.М., Калини Д.В., Варясин В.В., Тишкевич О.А., Виноградов С.А., Михайличенко К.Ю., Черняк А.В. Особенности патологической анатомии легких при COVID-19. Пульмонология. 2020; 30 (5): 519–532. doi: 18093/0869-0189-2020-30-5-519-532.
1.3 Лучевая диагностика (И.Е. Тюрин)
Методы визуализации (лучевой диагностики) применяют для выявления поражения легких при COVID-19, их осложнений, дифференциальной диагностики с другими заболеваниями легких, а также для определения степени выраженности и динамики изменений, оценки эффективности проводимой терапии.
Методы визуализации также необходимы для выявления и оценки характера патологических изменений в других анатомических областях и как средства контроля для инвазивных (интервенционных) медицинских вмешательств.
К методам визуализации патологии органов грудной полости пациентов с предполагаемой/установленной COVID-19 пневмонией относят:
обзорную рентгенографию легких (РГ),
компьютерную томографию легких (КТ),
ультразвуковое исследование легких и плевральных полостей (УЗИ).
Стандартная РГ имеет низкую чувствительность в выявлении начальных изменений в первые дни заболевания и не может применяться для ранней диагностики.
Рентгенография также недостаточно эффективна в выявлении ограниченных изменений в легких по типу матового стекла небольшого объема. Чувствительность РГ повышается с увеличением длительности течения заболевания и становится наибольшей к концу первой недели в связи с нарастанием изменений по типу консолидации. Рентгенография позволяет уверенно выявлять распространенные изменения в легких, которые требуют госпитализации, в том числе направления в отделение реанимации и интенсивной терапии. Рентгенография с использованием передвижных (палатных) аппаратов является основным методом визуализации патологии органов грудной полости в отделениях реанимации/интенсивной терапии. Применение передвижного (палатного) аппарата оправдано и для проведения исследований в рентгеновском кабинете/отделении. Важным преимуществом РГ в сравнении с КТ являются большая пропускная способность и меньшее время для противоэпидемических мероприятий в кабинете.
Компьютерная томография имеет высокую чувствительность в выявлении изменений в легких, характерных для COVID-19. Применение КТ целесообразно для первичной оценки органов грудной полости в целях медицинской сортировки, у пациентов с тяжелыми прогрессирующими формами заболевания, а также для дифференциальной диагностики выявленных изменений и оценки динамики процесса.
У пациентов с COVID-19 применение КТ легких может выявлять характерные изменения в легких без/до положительных лабораторных тестов на инфекцию, что определяет клиническое значение данного метода.
В то же время КТ позволяет обнаружить изменения легких у значительного числа пациентов с бессимптомной и легкой формами заболевания, которым не требуется госпитализация. Результаты КТ в этих случаях не влияют на тактику лечения и прогноз заболевания, особенно при наличии лабораторного подтверждения COVID-19. Поэтому применение КТ для скрининга бессимптомных и легких форм болезни не рекомендуется.
Ограничениями КТ в сравнении с РГ являются меньшая доступность метода в отдельных медицинских организациях, городах и регионах; недоступность исследования для части пациентов, находящихся на ИВЛ; необходимость проведения в большем объеме противоэпидемических мероприятий в кабинетах; высокая потребность в КТ-исследованиях для диагностики других заболеваний. В связи с этим КТ может быть исследованием «первой линии» в тех медицинских организациях/территориях и в тех клинических ситуациях, когда имеется достаточное количество аппаратов и есть кадровое обеспечение для выполнения требуемого объема исследований без ущерба для своевременной диагностики других болезней (онкологических, неврологических и т.д.) у наиболее нуждающихся в этом исследовании пациентов.
Ультразвуковое исследование легких у пациентов с предполагаемой/известной COVID- 19 пневмонией является дополнительным методом визуализации, который не заменяет и не исключает проведение РГ и КТ. При соблюдении правильной методики и выборе правильных показаний это исследование отличается высокой чувствительностью в выявлении интерстициальных изменений и консолидаций в легочной ткани, но только при субплевральном их расположении. Данные УЗИ не позволяют однозначно определить причину возникновения и/или действительную распространенность изменений в легочной ткани.
Следует учитывать, что УЗИ не является стандартной процедурой в диагностике пневмоний, оно не включено в клинические рекомендации и стандарты оказания медицинской помощи по диагностике и лечению внебольничной пневмонии. В связи с этим результативность исследований в значительной степени зависит от имеющегося опыта и квалификации врача, проводящего исследование, в конкретном медицинском учреждении.
Другие методы визуализации, такие как МРТ и радионуклидные исследования, включая ПЭТ, не имеют значения в диагностике и оценке динамики изменений в легких при COVID-19, но могут быть использованы по другим клиническим показаниям (онкологические заболевания, нарушения мозгового кровообращения и проч.)
Рекомендации:
- Рекомендовано выбирать методы визуализации при известной/предполагаемой COVID- 19 инфекции дифференцированно, в соответствии с имеющимися оборудованием и кадровыми ресурсами медицинской организации, а также структурой и количеством обследуемых пациентов.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
- Данные любого метода визуализации не заменяют результаты обследования на РНК или антиген SARS-CoV-2. Отсутствие изменений при КТ не исключают наличие COVID-19 и возможность развития изменений в легких после проведения исследования.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Методы визуализации не являются методами этиологической диагностики, они не позволяют установить этиологию инфекционного процесса или дифференцировать инфекционные процессы различной этиологии. Все выявляемые при визуализации признаки, включая КТ симптомы, не являются специфичными для какого-либо вида инфекции и не позволяют установить этиологический диагноз. Вне клинической (эпидемической) ситуации, знания клинической вероятности инфекции, они не позволяют отнести выявленные изменения к COVID-19 и дифференцировать их с внебольничной пневмонией и не воспалительными заболеваниями.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- Не рекомендовано применение методов визуализации при отсутствии симптомов респираторной инфекции у пациентов с положительными ПЦР тестами на COVID-19 инфекцию, а также при наличии эпидемиологические данных, указывающие на ее возможность.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии. В доступных на данный период времени клинических рекомендациях указано, что применение РГ, КТ и УЗИ для скрининга (выявления патологии при отсутствии клинических симптомов) изменений в легких при COVID-19 инфекции не целесообразно. Это положение относится также к неэффективности и нецелесообразности применения КТ при госпитализации бессимптомных в отношении COVID-19 пациентов, при обследовании лиц без клинических симптомов заболевания в организованных коллективах при выявлении в них больных COVID-19.
- Применение визуализации, включая РГ и КТ, у пациентов с симптомами ОРВИ при легкой степени тяжести течения заболевания и стабильном состоянии пациента не рекомендуется.
Комментарии: Проведение КТ в этой группе пациентов возможно только по конкретным клиническим показаниям, при наличии существенных факторов риска прогрессирования болезни, при условии достаточных технических и организационных возможностей. Методом выбора в этом случае является КТ легких по стандартному протоколу без внутривенного контрастирования или РГ при ограниченной доступности КТ. Использование УЗИ в этих случаях не целесообразно.
Применение КТ в сроки ранее 4-6 дней с момента появления симптомов заболевания нецелесообразно.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
- Рекомендовано проведение РГ или КТ исследования пациентам с клинической картиной среднетяжелой, тяжелой и крайне тяжелой респираторной инфекции, признаками дыхательной недостаточности с целью медицинской сортировки, оценки объема поражения легких и выявления осложнений:
- показано выполнение КТ легких по стандартному протоколу без внутривенного контрастирования в стационарных условиях;
- показано выполнение РГ легких в двух проекциях, если проведение КТ в данной медицинской организации/клинической ситуации невозможно.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии. При проведении КТ возможно использование низкодозного протокола сканирования с целью экономии ресурсов аппарата и снижения лучевой нагрузки на пациентов.
Внутривенное контрастирование при КТ у пациентов с известной/предполагаемой COVID-19 пневмонией проводится при подозрении на заболевания и патологические состояния (ТЭЛА, онкологические заболевания др.), диагностика которых невозможна без использования контрастных средств. Решение о внутривенном контрастировании принимает врач-рентгенолог совместно с врачом, направляющим пациента на КТ. Введение контрастного средства выполняется в соответствии с общими правилами проведения рентгеноконтрастных исследований.
- Методы визуализации рекомендованы пациентам с тяжелым и крайне тяжелым течением респираторной инфекции в условиях отделения реанимации и интенсивной терапии:
- выполнение экстренного КТ исследования легких по стандартному протоколу без внутривенного контрастирования, если возможна транспортировка пациента в кабинет КТ из отделения реанимации и интенсивной терапии;
- выполнение экстренной РГ легких в отделении реанимации/интенсивной терапии с использованием передвижного (палатного) аппарата;
- выполнение УЗИ для оценки состояния плевральных полостей и, при необходимости, легких по клиническим показаниям; данные УЗИ грудной клетки имеют высокую корреляцию с результатами КТ, но не заменяют КТ и РГ исследования.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии. Применение РГ и КТ позволяет объективно оценивать динамику изменений в легких и возникающие осложнения. Частота и вид проводимых исследований определяется клиническими показаниями
Применение УЗИ легких возможно только при наличии технических возможностей и подготовленного персонала, имеющего опыт проведения исследований легких. Данные УЗИ дополняют, но не заменяют РГ и КТ легких. Подробная информация о применении УЗИ легких при COVID-19 пневмонии размещена на сайте http://www.rasudm.org
- Оценка динамики течения выявленной пневмонии COVID-19 проводится по клиническим показаниям с применением следующих методов визуализации:
- выполнение КТ легких по стандартному протоколу без внутривенного контрастирования;
- РГ в двух проекциях в рентгеновском кабинете;
- выполнение УЗИ легких в дополнении к РГ и КТ при наличии клинических показаний, первоначальной информации об истинном объеме и причине поражения легких и подготовленного врачебного персонала.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: кратность повторения КТ, РГ или УЗИ зависит от клинических показаний, диктующих необходимость оценки динамики. Следует избегать частых (более 1 раза за период госпитализации) РГ и КТ исследований при отсутствии клинических показаний, отсутствия признаков прогрессирования болезни или возникновения осложнений.
Повторное выполнение КТ или РГ перед выпиской пациента из стационара не является обязательным при благоприятной клинической картина заболевания, отсутствии признаков ухудшения состояния пациента и развития осложнений.
Объективная оценка динамики возможна только при сопоставлении данных одного вида исследования, например КТ и КТ или РГ и РГ. Сравнение визуальной картины пневмонии при использовании различных методов визуализации затруднено и, как правило, субъективно.
- Оценка динамики пневмонии COVID-19 в отделениях реанимации и интенсивной терапии проводится по клиническим показаниям:
- выполнение КТ исследования легких по стандартному протоколу без внутривенного контрастирования при наличии технической возможности транспортировки пациентов в кабинет КТ;
- выполнение РГ с помощью передвижного (палатного) рентгеновского аппарата;
- выполнение РГ легких при возможности транспортировки пациентов в рентгеновский кабинет и при невозможности КТ;
- выполнение УЗИ легких и плевральных полостей по клиническим показаниям вне зависимости от данных КТ и РГ.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: следует учитывать ограниченную информативность РГ в отделении реанимации и интенсивной терапии с использованием передвижного (палатного) рентгеновского аппарата, в том числе из-за обычной практики исследования в одной прямой проекции. Выполнение УЗИ легких и плевральных полостей может быть альтернативным исследованием при невозможности проведения КТ.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
- Рекомендовано использовать специальные меры по ограничению доз облучения при обследовании беременных, новорожденных и детей младшего возраста при возможности развития у них COVID-19 пневмонии. Не рекомендовано проведение КТ беременным без снижения уровня сатурации ниже 95%.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии. Обследование беременных женщин с известной/предполагаемой COVID- 19 пневмонией осуществляется с использованием стандартных методик РГ, КТ. Необходимо использовать предустановленные программы по ограничению доз облучения, нужна защита радиочувствительных органов и плода (области живота и таза) с применением стандартных защитных средств (фартуки, воротники), имеющихся в кабинетах. При невозможности и отказе от проведения КТ и РГ применяется УЗИ легких при наличии подготовленного врачебного персонала.
Обследование новорожденных и детей младшего возраста с известной/предполагаемой COVID-19 пневмонией по возможности начинается с применения УЗИ легких, плевральных полостей и средостения, при наличии клинических показаний продолжается с использованием РГ и/или КТ органов грудной полости.
- При всех лучевых исследованиях должны быть обеспечены эпидемическая безопасность и защита персонала и пациентов согласно временным рекомендациям МЗ РФ для работы медучреждений в условиях эпидемии COVID-19.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Коммендации. Основными компонентами защиты персонала являются зонирование кабинетов лучевой диагностики, ограничение контактов между потоками потенциально инфицированных и неинфицированных пациентов, ограничение контактов персонала отделения/кабинетов лучевой диагностики, сменная работа персонала, обязательное применение средств индивидуальной защиты.
Уборка помещений кабинетов РГ, КТ и УЗИ, стерилизация оборудования и мебели кабинетов выполняются согласно настоящим временным методическим рекомендациям МЗ РФ.
- Работа кабинетов/отделений рентгенологических, рентгенодиагностических, лучевой диагностики организуется в круглосуточном режиме (смены по 6, 12 или 24 часа в сутки в зависимости от штатного расписания и загрузки конкретной медицинской организации). Рекомендуется создание в медицинских организациях системы дистанционного описания изображений дежурными врачами-рентгенологами.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии. Возможны следующие модели работы кабинетов/отделений лучевой диагностики медицинской организации:
А. Врач-рентгенолог и рентгенолаборант (лучше два рентгенолаборанта – в зависимости от их наличия и клинической потребности) проводят исследования в кабинете КТ или РГ, имея контакт с потенциально инфицированными пациентами. Персонал одет в комплекты СИЗ согласно настоящим временным методическим рекомендациям МЗ РФ. Другие врачи (их число зависит от нагрузки и потребности в описаниях исследований) работают дистанционно в «чистой» зоне.
Б. Рентгенолаборант (лучше два рентгенолаборанта – в зависимости от их наличия и клинической потребности) проводит исследования в кабинете КТ или РГ, имея контакт с потенциально инфицированными пациентами. Персонал одет в комплекты СИЗ согласно настоящим временным рекомендациям МЗ РФ. Дежурные врачи (их число зависит от нагрузки и потребности в описаниях исследований) работают дистанционно в «чистой» зоне. При необходимости дежурный врач-рентгенолог надевает комплект СИЗ и перемещается в диагностический кабинет – потенциально инфицированную зону.
В. Врачи ультразвуковой диагностики проводят исследования, имея непосредственный контакт с инфицированными и потенциально инфицированными пациентами.
Рекомендовано использование комплектов СИЗ согласно настоящим временным методическим рекомендациям МЗ РФ.
- Рекомендации по формированию описаний и оценке изменений в легких и органах грудной полости при имеющейся/подозреваемой COVID-19 пневмонии представлены в Приложении
1.4 Формулировка клинического диагноза (С.Н. Авдеев, А.А. Зайцев, И.В. Лещенко, А.Г. Малявин)
Термин «пневмония» как осложнение новой коронавирусной инфекции COVID-19 не отражает клинико-рентгенологические и морфологические признаки патологического процесса, наблюдающегося при вирусном поражении легких COVID-19. Логичным является термин «вирусное поражение легких», что и должно быть отражено в диагнозе. Данный факт имеет важное практическое значение, так как термин «пневмония» заставляет врачей ошибочно назначать антимикробную терапию при отсутствии объективных признаков бактериальной инфекции.
Напротив, термин «вирусное поражение легких» позволит практическому врачу правильно оценить ситуацию и назначить противовоспалительную терапию (глюкокортикостероиды и генно-инженерные препараты).
В настоящее время подавляющее большинство пациентов с новой коронавирусной инфекцией, в том числе не имеющих признаков поражения легких, получают антибактериальную терапию даже в амбулаторных условиях, что не приносит никакого клинического эффекта, а лишь ведет к росту антибиотикорезистентности!
Среди лабораторных маркеров, использующихся при ведении больных с COVID-19, фигурирует С-реактивный белок (СРБ). До настоящего времени в большинстве публикаций он рассматривался в первую очередь, как маркер присоединения бактериальной инфекции, требующей применения антибиотиков. Однако, очевидно, СРБ в случае COVID-19 является основным лабораторным маркером активности системного процесса, то есть не маркером присоединения бактериального поражения респираторных отделов легких, а маркером активности инициированного коронавирусом вирусного поражения легких. Обращается внимание, что патологические тени в легких, определяемые на компьютерной томографии у больных с новой коронавирусной инфекции COVID19 носят 2-х сторонний характер по типу матового стекла с участками консолидации, являются отражением данного заболевания и свидетельствуют о вирусном поражении легких («вирусный пневмонит», «диффузное альвеолярное повреждение»), шифры по МКБ-10: U07.1 и U07.2.
Пневмония – группа самостоятельных, различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся, как правило, односторонним очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации (шифры по МКБ-10: J12-J16, J18). Новая коронавирусная инфекция CОVID-19 с поражением легких и пневмония – разные самостоятельные заболевания!
Примеры формулировки диагнозов:
Пример 1. Основное заболевание. Новая коронавирусная инфекция CОVID-19 (подтвержденная), среднетяжелая форма. Двустороннее вирусное поражение легких. (код по МКБ-10: U07.1).
Осложнения основного заболевания: ДН 0-I
Пример 2. Основное заболевание. Новая коронавирусная инфекция CОVID-19 (вероятная), тяжелая форма. Двустороннее вирусное поражение легких (код по МКБ-10: U07.2).
Осложнения основного заболевания: ОРДС, ОДН
Пример 3. Основное заболевание. Новая коронавирусная инфекция CОVID-19 (вероятная), тяжелая форма. Двустороннее вирусное поражение легких (код по МКБ-10: U07.2).
Осложнения основного заболевания: нозокомиальная нижнедолевая пневмония, вызванная K. Pneumoniae. Синдром полиорганной недостаточности, ОРДС, ОДН.
Пример 4. Основное заболевание. Правосторонняя нижнедолевая тяжелая пневмония (код по МКБ-10: J18.1).
Осложнения основного заболевания: Синдром полиорганной недостаточности, ОДН
Пример 5. Основное заболевание. Левосторонняя нетяжелая сегментарная пневмония в нижней доле легкого (S9) (код по МКБ-10: J18.8)
Осложнения основного заболевания: ДН 0-1
Литература
- Зайцев А.А. Клиническая микробиология и антимикробная химиотерапия. 2020; 2: 84-
- Алгоритмы ведения пациентов с новой коронавирусной инфекцией COVID-19 в стационаре, (Методические рекомендации). М.: ГВКГ имени Н.Н. Бурденко 2020, 16 с.
- Письмо Минздрава РФ от 06.03.2020 N 30-4/И/2-2702 – О направлении алгоритма оказания медицинской помощи взрослому населению с внебольничными пневмониями – действующая первая редакция.
1.5 Критерии развития острого респираторного дистресс-синдрома и тактика ведения пациентов (С.Н. Авдеев)
ОРДС – форма острого диффузного повреждения легких, для которого характерно воспаление с повышением проницаемости сосудов и снижением аэрации легочной паренхимы. В указанных документах предлагаются следующие диагностические критерии ОРДС [1]:
- Временной интервал: возникновение синдрома (новые симптомы или усугубление симптомов поражения легких) в пределах 1 недели от момента действия известного причинного фактора.
- Данные визуализации органов грудной клетки: наличие двусторонних затемнений, которые нельзя объяснить выпотом, ателектазом, узлами.
- Механизм отека: дыхательную недостаточность (ДН) нельзя объяснить сердечной недостаточностью или перегрузкой жидкостью. Если факторов риска сердечной недостаточности нет, необходимы дополнительные исследования, прежде всего ЭхоКГ.
- Нарушение оксигенации:
- Легкая степень: 200 <PaO2/FiO2 ≤300 мм рт. ст. при РЕЕР или CPAP ≥ 5 см вод. ст.
- Средняя степень: 100 <PaO2/FiO2 ≤200 мм рт. ст. при РЕЕР или CPAP ≥5 см вод. ст.
- Тяжелая степень: PaO2/FiO2 ≤100 мм рт. ст. при РЕЕР или CPAP ≥5 см вод. ст. Тяжесть течения ОРДС является достоверным прогностическим предиктором. Так, летальность при легкой степени синдрома составляет 27% (24–30%), при ОРДС средней степени – 32% (29–34%), а при ОРДС тяжелой степени – 45% (42–48%) [2].
Этиология и патогенез острого респираторного дистресс-синдрома
Вне зависимости от исходных причин поражения и различных начальных механизмов патогенеза в основе ОРДС лежат дисфункция эндотелия капиллярного русла легких и повреждение альвеолярного эпителия с последующим развитием интерстициального и альвеолярного отека легких в сочетании с образованием обширных регионов микроателектазирования [1,3].
Кодирование по МКБ-10
Диагноз в соответствии с Международной классификацией болезней десятого пересмотра (МКБ-10):
Синдром респираторного расстройства (дистресса) у взрослого (J80)
Классификация
По типу ведущего этиологического фактора [4,5]:
первичный (прямой, «лёгочный») ОРДС - первичное повреждение лёгких этиологическим агентом;
вторичный (непрямой, «внелёгочный») ОРДС - вторичное повреждение лёгких при исходной внелёгочной патологии.
Морфологические стадии ОРДС (при COVID-19 характерно нарушение сроков развития стадий, чаще в сторону удлинения, а также их сочетание) [6]:
- Экссудативная стадия («ранний» ОРДС, 1-5 сутки);
- Пролиферативная стадия (6-10 сутки);
- Фибротическая стадия (10-15 сутки от развития ОРДС).
Острый респираторный дистресс-синдром является полиэтиологическим заболеванием. Основные факторы риска развития ОРДС могут быть разделены на две группы [1,4]: прямые повреждающие факторы (легочная инфекция, аспирационный синдром, утопления, вдыхание токсических веществ, тупая травма груди и др.); непрямые повреждающие факторы (шок, сепсис, травма, кровопотеря, гемотрансфузии, отравления, искусственное кровообращение и т.д.).
Основные причины ОРДС представлены в таблице 1.
Поражения легких при COVID-19 отличаются выраженной артериальной гипоксемией, часто не соответствующей объёму поражения и степени снижения податливости лёгочной ткани, что связано с феноменом избыточной перфузии пораженных альвеол при COVID- 19 (расширение сосудов) и несоответствием между вентиляцией и перфузией. При развитии ОРДС у этих пациентов, как правило, нет других причин для интубации трахеи – нарушения сознания, мышечной слабости (дисфункция диафрагмы при полинейромиопатии критических состояний), нестабильной гемодинамики, интраабдоминальной гипертензии, низкой податливости грудной стенки, нарушений биомеханики дыхания, ведущих к повышенной работе дыхания. Вследствие этого у значимой части таких пациентов компенсация гипоксемии и ОДН достигается неинвазивными методами – оксигенотерапией и неинвазивной вентиляцией легких (НВЛ) даже при снижении индекса PaO2/FiO2 до 100 мм рт.ст., а у некоторых – и ниже [6-8].
Диффузное повреждение альвеол (ОРДС) при COVID-19 диагностируют в среднем на 8-е сутки от начала болезни, при поступлении в ОРИТ частота ОРДС около 60%, а индекс PaO2/FiO2 – 136 (103-234) мм рт.ст. [6].
При ОРДС у пациентов с COVID-19 высока частота гиперкапнии, сохраняющейся даже на фоне инвазивной ИВЛ из-за роста альвеолярного мертвого пространства (микротромбоз легочных капилляров, тромбоэмболия легочной артерии) и/или увеличения шунта (венозного примешивания), что ведет к большой (выше 5 мм рт.ст.) разнице напряжений СО2 в артериальной крови и в конце выдоха [6-8].
|
Таблица 1. Причины острого респираторного дистресс-синдрома [4] |
|
|
Оказывающие прямое воздействие на легкие (легочные) |
Не оказывающие прямое воздействие на легкие (внелегочные) |
|
Более частые Легочная инфекция (пневмония неаспирационного генеза, вирусные инфекции - грипп, новый коронавирус, цитомегаловирус) Аспирационная пневмония вследствие аспирации жидкостей (желудочный сок, жидкие углеводороды) |
Более частые Шок любой этиологии Инфекция (сепсис, перитонит и т. п.) Тяжелая травма Острый панкреатит Массивные гемотрансфузии |
|
Менее частые Ингаляция токсических веществ (высокие концентрации кислорода, дым, едкие химикалии – двуокись азота, соединения аммония, кадмия, хлора, фосген) Ушиб легкого Жировая эмболия Радиационный пневмонит Эмболия легочной артерии Утопление Реперфузионное повреждение легких |
Менее частые Искусственное кровообращение Острые отравления Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром) Ожоги Тяжелая черепно-мозговая травма (ТЧМТ) Уремия Лимфатический карциноматоз Эклампсия Состояние после кардиоверсии Инфаркт кишечника Внутриутробная гибель плода Тепловой удар Гипотермические повреждения Обширные хирургические вмешательства Сердечно-легочная реанимация |
Рекомендации:
У пациента с диагностированным ОРДС рекомендовано ответить на вопрос, какие повреждающие факторы (прямые или непрямые) стали причинами развития ОРДС. Для этого необходимо проанализировать данные анамнеза, выделить ведущий повреждающий фактор (прямой или непрямой) и время от момента начала действия этого фактора.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3)
У пациентов с острым развитием ОДН (в первую неделю при наличии этиологического фактора) с целью дифференциальной диагностики рекомендовано исключить другие частые причины острого развития ОДН: шок, ателектазы, пневмоторакс, тромбоэмболию легочной артерии, пневмонию, патологию органов грудной стенки, внутрибрюшную гипертензию, обострение хронических заболеваний легких, а также «повреждающие» настройки режимов и параметров респираторной поддержки (при проведении респираторной поддержки).
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3)
Пациентам с ОРДС рекомендовано исследование газового состава и кислотно-основного состояния (КОС) артериальной крови для лабораторной оценки дыхательной недостаточности: для ОРДС характерно снижение индекса PaO2/FiO2 в сочетании с низким PaCO2 и развитием респираторного алкалоза или (при тяжелом ОРДС) снижение индекса PaO2/FiO2 в сочетании с увеличением PaCO2 и развитием респираторного ацидоза. При наличии этиологических причин развития метаболического ацидоза возможно сочетание респираторного алкалоза или ацидоза с метаболическим ацидозом. Уровень убедительности рекомендаций В (уровень достоверности доказательств 5)
У пациента с ОРДС рекомендовано проанализировать характер изменений на рентгенограмме (диффузные, очаговые, сливные) с целью дифференциальной диагностики - для ОРДС характерно наличие двусторонних диффузных инфильтратов, а при доступности метода и транспортабельности пациента рекомендовано провести компьютерную томографию легких для определения степени негомогенности повреждения лёгких и наличия участков консолидации и «матового стекла» для оценки ведущего патогенетического механизма и потенциала рекрутабельности альвеол.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3)
Всем пациентам с предполагаемым или подтвержденным ОРДС рекомендовано мониторировать насыщение гемоглобина кислородом при помощи пульсоксиметра (SpO2) для оценки степени гипоксемии.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3)
У пациентов с ОРДС рекомендовано оценить примерное соотношение парциального давления кислорода в артериальной крови к инспираторной фракции кислорода (PaO2/FiO2) при помощи пульсоксиметрии и рассчитать коэффициент SpO2/FiO2) для оценки степени тяжести ОРДС.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3)
У пациентов с ОРДС рекомендовано использовать Берлинское определение ОРДС для диагностики и оценки степени его тяжести.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3)
Литература
- Acute respiratory distress syndrome: the Berlin JAMA 2012; 307: 2526–2533.
- Villar J., Sulemanji D., Kacmarek R. The acute respiratory distress syndrome: incidence and mortality, has it changed? Curr Opin Crit Care2014; 20: 3–9.
- Диагностика и интенсивная терапия острого респираторного дистресс-синдрома: клинические рекомендации Федерациии анестезиологов и реаниматологов России [Электрон. ресурс]. А.И. Ярошецкий, А.И. Грицан, С.Н. Авдеев [и др.] – 2020. – Режим доступа: http://www.far.org.ru/recomendation.
- Ware L.B., Matthay M.A. The Acute Respiratory Distress Syndrome. N Engl J Med. Massachusetts Medical Society; 2000;342(18):1334–1349.
- Gattinoni L., Pelosi P., Suter P.M. et al. Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease: Different syndromes? Am J Respir Crit Care Med. 1998;158(1):3–11.
- Gattinoni L, Gattarello S, Steinberg I, et al. COVID-19 pneumonia: pathophysiology and Eur Respir Rev 2021; 30: 210138 [DOI: 10.1183/16000617.0138-2021].
- Gattinoni L, Chiumello D, Caironi P, et al. COVID-19 pneumonia: different respiratory treatment for different Intensive Care Med 2020; 46: 1099–1102.
- Marini JJ, Gattinoni L. Management of COVID-19 respiratory distress. JAMA 2020; 323: 2329–2330.
1.6 Мультисистемный воспалительный синдром у взрослых, ассоциированный с COVID-19 (Л.З. Болиева)
Определение
Мультисистемный синдром взрослых, ассоциированный с COVID-19 (MIS-A) - редкое жизнеугрожающее иммунопатологическое осложнение новой коронавирусной инфекцией COVID-19, развивающееся у лиц старше 21 года в течение 12 недель от начала заболевания и характеризующееся развитием тяжелого поражения ≥ 1 органа или системы, за исключением органов дыхания, и наличием лабораторных признаков системного воспаления.
Точных статистических данных о частоте MIS-A к настоящему времени нет. Согласно имеющимся данным, этот синдром описан у лиц в возрасте до 50 лет и чаще развивается при наличии у больного сопутствующих заболеваний. Также у взрослых отмечается более тяжелое поражение сердечно-сосудистой системы и более высокая частота тромбозов, чем у детей [1, 2].
Патогенез
Патофизиология MIS-A изучена недостаточно.
Известно, что острый период COVID-19 может протекать тяжело с развитием острого респираторного дистресс-синдрома, при этом триггером быстрого прогрессирования и полиорганной недостаточности является системное воспаление. Развитие MIS-C/A также характеризуется гипериммунной воспалительной реакцией с высвобождением цитокинов, имеющей определенное сходство с синдромом активации макрофагов. Также, возможно, определенную роль играет длительная экстрапульмональная персистенция вируса, который, как известно, обнаруживается во многих органах и тканях, включая сердце, печень, головной мозг, почки, желудочно-кишечный тракт. Важное значение может иметь вызванное вирусом SARS-CoV-2 повреждение эндотелия, тромботическая микроангиопатия, дисрегуляция иммунного ответа и ренин-ангиотензин-альдостероновой системы [3].
Эндотелиальная дисфункция определенно является одним из основных патогенетических механизмов тяжелого течения острого периода COVID-19 [4]. Повреждение эндотелия, вызванное прямым действием вируса или развивающееся в рамках системного воспаления приводит к гиперкоагуляции, коагулопатии и тромбоэмболическим осложнениям как в остром периоде коронавирусной инфекции, так и в постковидном периоде, в том числе при развитии MIS-A [5-8].
Особенности иммунного ответа у пациентов с MIS-A могут быть связаны с экстрафолликулярной активацией В-лимфоцитов, и агрессивная воспалительная реакция может быть ответственна за опосредованное иммунной системой повреждение тканей [9, 10]. В процессе формирования ответа на SARS-CoV-2 активируются моноциты и натуральные киллеры, продуцирующие большое количество провоспалительных цитокинов, что приводит к «цитокиновому шторму» и дисрегуляции РААС [11-14]
Также известно, что тяжесть течения и смертность при новой коронавирусной инфекции коррелирует с тяжестью лимфопении, при которой снижается число как CD4+, так и CD8+ субпопуляций Т-лимфоцитов. Причина лимфопении до конца неизвестна, возможно определенную роль играет прямое повреждающее действие вируса на Т-лимфоциты, как при MERS-CoV, или это влияние воспаления на секвестрацию Т-лимфоцитов [15-18].
Если индукция Т-клеточного иммунитета является обязательной для формирования эффективного противовирусного иммунитета, то дисрегуляция Т-клеточного ответа может вносить определенный вклад в развитие гипериммунного воспаления. [19].
По аналогии с мультисистемным воспалительным синдромом у детей, важную роль может играть нарушение интерферонового статуса с гиперпродукцией IFN-c [20]
Клиническая картина и диагностика
Основными клиническими проявлениями мультисистемного воспалительного синдрома у взрослых являются персистирующая лихорадка (96%), гипотензия и другие нарушения со стороны сердечно сосудистой системы (60%), одышка (52%) и диарея (52%). Наиболее часто поражаются система крови, сердечно-сосудистая система, желудочно-кишечный тракт. Тяжелое течение мультисистемного воспалительного синдрома отмечается примерно у 50% больных, летальность составляет около 7% [21].
Что касается лабораторных данных, то в большинстве описанных к настоящему времени случаев у пациентов отмечалось повышение уровней Д-димера (91%) и лимфопения (86%). У большинства больных были повышены маркеры коагулопатии и/или воспаления (90%), такие как интерлейкин 6, ферритин, фибриноген, С-реактивный белок, натрийуретический пептид [21].
Предложены диагностические критерии MIS-A, согласно которым определенным случаем мультисистемного воспалительного синдрома у взрослых, ассоциированного с COVID-19, можно диагностировать при наличии следующих критериев: возраст от 21 года и старше, персистирующая лихорадка в течение 3 и более дней, ≥ 2 клинических признаков (поражение кожи и слизистых – сыпь, конъюнктивит, эритема и отеки кистей и стоп; поражение желудочно-кишечного тракта – абдоминальные боли, рвота, диарея; шок/гипотензия; неврологические симптомы – нарушение сознания, головная боль, парестезии и др.), лабораторные маркеры воспаления и коагулопатии (СРБ, СОЭ, ферритин, прокальцитонин), ≥ 2 признаков активности заболевания (повышение уровней NaproBNP и/или тропонина; нейтрофилия, лимфопения и/или тромбоцитопения; симптомы сердечной недостаточности; изменения на ЭКГ и ЭхоКГ, характерные для миокардита/перикардита), подтвержденная связь с новой коронавирусной инфекцией COVID-19 [22].
У всех пациентов, особенно в случаях, которые не соответствуют критериям определенного случая MIS-A, следует исключать альтернатичные причины, продолжая при этом наблюдение и лечение, особенно в случае подтвержденной связи, в том числе эпидемиологической, с SARS-CoV-2. Также необходимо дифференцировать данный синдром от волнообразного течения острого периода COVID-19. В этом могут помочь повторные исследования на РНК SARS-CoV-2 методом ПЦР и серологические тесты на наличие антител. При этом нужно иметь ввиду, что у ряда коморбидных больных образование антител может быть более поздним, и в течение длительного времени может наблюдаться положительный тест на РНК SARS-CoV-2.
Терапия
В настоящее время нет каких-либо четких рекомендаций по лечению MIS-A, основанных на принципах доказательной медицины. Препаратами выбора, согласно данным литературы, являются системные глюкокортикостероиды (преднизолон или метилпреднизолон в дозе 2 мг/кг в сутки) и/или препараты иммуноглобулинов для внутривенного введения в дозе 2 г/кг однократно или в течение двух дней. Всем пациентам рекомендовано назначение антикоагулянтов и/или антиагрегантов. Описано применение генно-инженерных биологических препаратов – ингибиторов ИЛ-1, ИЛ-6. По показаниям назначаются вазопрессоры, антибактриальные средства, инфузионная терапия, топические стероиды и др. [23].
Литература
- Chau V.Q., Giustino G., Mahmood K. Cardiogenic Shock and Hyperinflammatory Syndrome in Young Males With COVID-19. Circulation: Heart FailureVolume 13, Issue 10, October 2020; Page e007485 https://doi.org/10.1161/CIRCHEARTFAILURE.120.007485
- Morris S.B. et al. Case series of multisystem inflammatory syndrome in adults associated with SARS-CoV-2 infection - United Kingdom and United States, March-August 2020. MMWR Morb Mortal Wkly Rep 2020;69(40):1450–1456.
- Bamrah M.S., Schwartz N., Patel P. et al. Case series of multisystem inflammatory syndrome in adults associated with SARS-CoV-2 infection-United Kingdom and United States, March– August Morbid/Mortal. Wkly. Rep.2020;69:1450–1456.
- Stratton C.W., Tang Y.W., Lu H. Pathogenesis-directed therapy of 2019 novel coronavirus J. Med.Virol. 2021;93:1320–1342. doi: 10.1002/jmv.26610.
- Nazy I., Jevtic S.D., Moore J.C. et al. Platelet-activating immune complexes identified in critically ill COVID-19 patients suspected of heparin-induced thrombocytopenia. J. Thromb. 2021;19:1342–1347. doi: 10.1111/jth.15283.
- Brodard J., Kremer H.J.A., Fontanam P. et al. COVID-19 patients often show high-titer non- platelet-activating anti-PF4/heparin IgG antibodies. J. Thromb. Haemost. 2021;19:1294–1298. doi: 1111/jth.15262.
- Kumar M.A., Krishnaswamy M., Arul J.N. Post COVID-19 sequelae: Venous thromboembolism complicated by lower GI bleed. BMJ Case Rep. 2021;14:e241059. doi: 1136/bcr-2020-241059.
- Townsend L., Fogarty H., Dyer A. et al. Prolonged elevation of D-dimer levels in convalescent COVID-19 patients is independent of the acute phase response. J. Thromb. 2021;19:1064–1070. doi:10.1111/jth.15267.
- Kuri-Cervantes L/ et al. Comprehensive mapping of immune perturbations associated with severe COVID-19. Sci Immunol 2020;5.
- Zhao J. et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease Clin Infect Dis 2020.
- Zhou Y. et al. Pathogenic T cells and inflammatory monocytes incite inflammatory storm in severe COVID-19 patients. Natl Sci Rev 2020:
- Guo C. et al. Single-cell analysis of two severe COVID-19 patients reveals a monocyte- associated and tocilizumab-responding cytokine Nat Commun 2020;11(1):3924.
- Maucourant C et al. Natural killer cell immunotypes related to COVID-19 disease severity. Sci Immunol 2020;5(50).
- Garvin M.R. et al. A mechanistic model and therapeutic interventions for COVID-19 involving a RAS-mediated bradykinin storm. Elife 2020;9.
- Vabret N. et al. Immunology of COVID-19: current state of the science. immunity 2020;52(6):910–41.
- Woodruff M., et al. Critically ill SARS-CoV-2 patients display lupus-like hallmarks of extrafollicular B cell activation. medRxiv 2020.
- Chen G et al. Clinical and immunological features of severe and moderate coronavirus disease J Clin Invest 2020;130(5):2620–2629.
- Gruber C.N. et al. Mapping systemic inflammation and antibody responses in multisystem inflammatory syndrome in children (MIS-C). Cell 2020.
- Zhou Y. et al. Pathogenic T cells and inflammatory monocytes incite inflammatory storm in severe COVID-19 patients. Natl Sci Rev 2020:
- Diorio C. et al. Multisystem inflammatory syndrome in children and COVID-19 are distinct presentations of SARS-CoV-2. J Clin Invest 2020.
- Patel P., DeCuir J., Abrams J. et al. Clinical Characteristics of Multisystem Inflammatory Syndrome in Adults. A Systematic Review. JAMA Network Open. 2021; 4(9): e2126456. doi:10.1001/jamanetworkopen.2021.26456.
- Vogel T.P., Top K.A., Karatzios C. et al. Multisystem inflammatory syndrome in children and adults (MIS-C/A): Case definition & guidelines for data collection, analysis, and presentation of immunization safety data Vaccine. 2021; 39(22): 3037–3049. doi:10.1016/j.vaccine.2021.01.054.
- Behzadi F., Ulloa N.A., Danckers M. Multisystem infammatory syndrome in adults: a case report and review of the literature. Journal of Medical Case Reports. 2022; 16: 102. doi.org/10.1186/s13256-022-03295-w.
1.7 Критерии бактериальной коинфекции при COVID-19 (С.А. Рачина, А.И. Синопальников)
Бактерии в редких случаях являются копатогенами при COVID-19. В двух метаанализах частота обнаружения бактериальных возбудителей среди госпитализи-рованных взрослых составила 3,5 и 7% соответственно [1,2]. Клинические симптомы и признаки не позволяют с достаточной точностью дифференцировать бактериальную пневмонию и поражение легких, вызываемое SARS-CoV-2, или выявлять случаи коинфекции. Лучевые исследования, в том числе и КТ, не позволяют разграничивать бактериальные и вирусные поражения легких. Отсутствие типичных признаков коронавирусного поражения легких в период пандемии, нетипичная для COVID 19 РГ и КТ картина, увеличивает вероятность бактериальной инфекции. При локальных изменениях в пределах одной доли легкого, в случаях преобладания консолидации над матовым стеклом, наличии очаговой диссеминации, признаков гиперсекреции в бронхах или плеврального выпота следует предположить другую этиологию заболевания, отличную от COVID 19. Однако ни один из этих признаков или их сочетание не является характерным для вирусного или бактериального процесса. Информативность рентгенологических исследований в дифференциации поражения легких бактериальной и вирусной этиологии зависит от метода: она выше при КТ ОГК, использовании искусственного интеллекта и машинного обучения [3-6].
Исследования лабораторных показателей для дифференциальной диагностики COVID-19 и бактериальной пневмонии демонстрируют более высокие значения стандартных маркеров лабораторно-воспалительного синдрома, таких как прокальцитонин (ПКТ), С-реактивный белок (СРБ) в группе бактериальной инфекции [7,8]. Однако повышение ПКТ и СРБ также ассоциируется с тяжелым течением и неблагоприятным прогнозом COVID-19, поэтому существует проблема в установлении пороговых значений показателей, которые обладали бы приемлемыми чувствительностью и специфичностью в разграничении COVID-19 и случаев бактериальной коинфекции [9,10].
По данным исследований, COVID-19 характеризуется развитием лейкопении и эозинопении, а бактериальная пневмония - лейкоцитозом и нейтрофилезом [8,11-13]. Нейтрофилез и наличие токсической зернистости нейтрофилов являлись чувствительными маркерами бактериальной инфекции в исследованиях, выполнявшихся до пандемии COVID-19 [14]. Ценным для дифференциации COVID-19 и бактериальной коинфекции может быть одновременное определение ферритина и ПКТ (соотношение существенно ниже при бактериальной пневмонии), однако этот показатель требует дополнительного изучения [15].
Рекомендации:
Всем пациентам с подозрением на бактериальную коинфекцию при СOVID-19 рекомендуется выполнение КТ ОГК как более чувствительного и специфичного метода лучевой диагностики; наличие ограниченного одностороннего поражения в виде участка консолидации легочной ткани повышает вероятность бактериальной пневмонии.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Всем пациентам с подозрением на бактериальную коинфекцию при СOVID-19 рекомендуется выполнение развернутого клинического анализа крови; вероятность бактериальной инфекции существенно возрастает при наличии лейкоцитоза и/или нейтрофилеза и/или токсической зернистости нейтрофилов.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Всем госпитализированным пациентам с подозрением на бактериальную коинфекцию при СOVID-19 рекомендуется определение уровня ПКТ (количественный тест); бактериальная инфекция маловероятна при уровне ПКТ < 0,25 нг/мл, возможна при уровне ПКТ ≥ 0,5 нг/мл, а при уровне ПКТ > 10 нг/мл ее риск существенно возрастает.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Всем госпитализированным пациентам с подозрением на бактериальную пневмонию при СOVID-19 показано использование рутинных микробиологических исследований: культурального исследования мокроты, а при тяжелом течении заболевания – культурального исследования респираторного образца (мокрота, трахеальный аспират, БАЛ), двух образцов венозной крови и экспресс-тестов на пневмококковую и легионеллезную антигенурию.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Наличие положительных экспресс-тестов на пневмококковую и легионеллезную антигенурию, бактериемия с выявлением типичных возбудителей пневмонии при СOVID- 19 подтверждает наличие бактериальной коинфекции, выявление типичных возбудителей в респираторных образцах в диагностическом титре существенно повышает вероятность бактериальной инфекции.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Литература
- Langford BJ, So M, Raybardhan S, et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol Infect. 2020;26(12):1622-1629.
- Lansbury L, Lim B, Baskaran V, Lim WS. Co-infections in people with COVID-19: a systematic review and meta-analysis. J Infect. 2020;81(2):266-275.
- Sähn M-J.,Yuksel C., Keil S., et al. Accuracy of Chest CT for Differentiating COVID-19 from COVID-19 Rofo 2021; 193 (9): 1081–1091.
- Jain G., Mittal D., Thakur D., et al. A deep learning approach to detect Covid-19 coronavirus with X-Ray Biocybernetics and Biomedical Engineering 2020; 40 (4): 1391–1405.
- Kang M., Hong K.S., Chikontwe P., et al. Quantitative Assessment of Chest CT Patterns in COVID-19 and Bacterial Pneumonia Patients: a Deep Learning Perspective. J Korean Med Sci 2021; 36(5):
- Zheng F., Li L., Zhang X., et al. Accurately discriminating COVID-19 from viral and bacterial pneumonia according to CT images via deep Interdiscip Sci. 2021; 13(2): 273–285.
- Mason C.Y., Kanitkar T., Richardson C.J., et al. Exclusion of bacterial co-infection in COVID-19 using baseline inflammatory markers and their response to antibiotics. J Antimicrob Chemother 2021; 76(5): 1323–1331.
- Zhou Y., Guo S., He Y., et al. COVID-19 Is Distinct From SARS-CoV-2-Negative Community-Acquired Front Cell Infect Microbiol 2020; 10, 322.
- Tong-Minh K., van der Does Y., Engelen S., et al. High procalcitonin levels associated with increased intensive care unit admission and mortality in patients with a COVID-19 infection in the emergency department. BMC Infectious Diseases 2022; 22(1): 1-9.
- Dolci A., Robbiano C., Aloisio E., et al. Searching for a role of procalcitonin determination in COVID-19: a study on a selected cohort of hospitalized patients. Clin Chem Lab Med 2020; 59 (2): 433–440.
- Song L., Liang E-Y., Wang H-M., et al. Differential diagnosis and prospective grading of COVID-19 at the early stage with simple hematological and biochemical variables. Diagn Microbiol Infect Dis 2021; 99(2):
- Al-Gwaiz L.A., Babay H.H. The diagnostic value of absolute neutrophil count, band count and morphologic changes of neutrophils in predicting bacterial infections. Med Princ Pract 2007; 16 (5): 344–347.
- Gharamti A., Mei F., Jankousky K.C., et al. Diagnostic utility of a Ferritin-to-Procalcitonin Ratio to differentiate patients with COVID-19 from those with Bacterial Pneumonia: A multicenter Open Forum Infect Dis 2021; 8 (6): ofab124.
1.8 Маршрутизация пациентов в остром периоде (И.В. Демко)
Условия оказания медицинской помощи
Медицинская помощь пациентам с COVID-19 осуществляется в соответствии с приказом
Минздрава России от 19.03.2020 N 198н «О временном порядке организации работы медицинских организаций в целях реализации мер по профилактике и снижению рисков распространения новой коронавирусной инфекции COVID-19» в виде скорой, в том числе скорой специализированной, первичной медико-санитарной и специализированной медицинской помощи в медицинских организациях и их структурных подразделениях, а также в амбулаторных условиях (на дому).
В зависимости от степени тяжести состояния при подтверждении диагноза коронавирусной инфекции лечение осуществляют:
- медицинские работники амбулаторных медицинских организаций на дому;
- в отделении для лечения инфекционных больных медицинской организации;
- в ОРИТ медицинской организации (при наличии показаний).
Маршрутизация пациентов с подозрением на COVID-19 в амбулаторных условиях При получении положительного результата лабораторных исследований биологического материала пациента на наличие возбудителя новой коронавирусной инфекции COVID-19 методом полимеразной цепной реакции или на наличие антигена возбудителя новой коронавирусной инфекции, уполномоченное лицо медицинской организации: уведомляет пациента о положительном результате теста на COVID-19; направляет экстренное извещение о случае заболевания новой коронавирусной инфекцией (COVID-19) в территориальные органы Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека; осуществляет опрос пациента с целью уточнения его состояния: сбор и анализ жалоб пациента, данных анамнеза; принимает решение о необходимости проведения очного приема врача (фельдшера) (осмотра, консультации); в случае отсутствия необходимости очного приема врача (фельдшера) (при отсутствии симптомов или легком течении новой коронавирусной инфекции COVID-19) дистанционно формирует листок нетрудоспособности в форме электронного документа сроком не менее чем на 7 календарных дней; оповещает о положительном результате теста на COVID-19 руководителя медицинской организации; организует осмотр работников медицинской организации, контактировавших с заболевшим пациентом, и, в случае выявления симптомов острой респираторной вирусной инфекции, отбор у них биологического материала (мазки из носо- и ротоглотки) для лабораторного исследования на наличие новой коронавирусной инфекции COVID-19; осуществляет информирование медицинского работника, направляемого для оказания медицинской помощи пациенту, о положительном результате теста на COVID-19; осуществляет предоставление информации о пациенте и контактировавших с ним лицах (со слов пациента) в информационный ресурс учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19) в соответствии с Временными правилами учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19), утвержденными постановлением Правительства Российской Федерации от 31 марта 2020 г. N 373
Условия оказания медицинской помощи на дому:
а) пациент не проживает в общежитии, коммунальной квартире, учреждении социального обслуживания с круглосуточным пребыванием и средствах размещения, предоставляющих гостиничные услуги, с лицами старше 65 лет, с лицами, страдающими хроническими заболеваниями бронхолегочной, сердечно-сосудистой и эндокринной системы;
б) у пациента имеется возможность находиться в отдельной комнате;
в) соблюдение пациентом врачебных назначений и санитарных предписаний в течение всего срока лечения.
При самостоятельном проведении пациентом теста на COVID-19 пациент обращается в медицинскую организацию, в том числе дистанционным способом, или по единому телефонному номеру "122" и получает рекомендации по лечению. Госпитализации в медицинскую организацию подлежат те пациенты, которые соответствуют критериям, установленными приложением 12, приказа N 198Н
Госпитализация пациентов с установленным диагнозом в медицинские организации в зависимости от степени тяжести
Согласно Приложению № 12 к приказу Министерства здравоохранения Российской Федерации от 19 марта 2020 г. N 198н, госпитализации в медицинские организации и их структурные подразделения, оказывающие медицинскую помощь пациентам с установленным диагнозом новой коронавирусной инфекции COVID-19 в стационарных условиях, подлежат пациенты с установленным диагнозом новой коронавирусной инфекции COVID-19.
Пациенты, находящиеся в тяжелом и крайне тяжелом состоянии, а также пациенты пациенты, относящиеся к группе риска (возраст старше 65 лет, наличие сопутствующих заболеваний и состояний: артериальной гипертензии, хронической сердечной недостаточности, онкологических заболеваний, гиперкоагуляции, ДВС-синдрома, острого коронарного синдрома, сахарного диабета, цирроза печени, длительный прием стероидов и биологической терапии по поводу воспалительных заболеваний кишечника, ревматоидного артрита, пациенты, получающие сеансы гемодиализа или перитонеальный диализ, наличие иммунодефицитных состояний, в том числе у пациентов с ВИЧ- инфекцией без антиретровирусной терапии и пациентов, получающих химиотерапию) госпитализируются в структурное подразделение медицинской организации для лечения COVID-19 I типа, имеющее койки для пациентов, находящихся в тяжелом состоянии, не требующих искусственной вентиляции легких, койки для пациентов, находящихся в тяжелом состоянии, требующих проведения неинвазивной вентиляции легких, и койки для пациентов, находящихся в крайне тяжелом состоянии, требующих проведения инвазивной искусственной вентиляции легких, койки для пациентов, находящихся в состоянии средней тяжести.
Пациенты, относящиеся к группе риска и находящиеся в состоянии легкой степени тяжести, госпитализируются в структурное подразделение медицинской организации для лечения COVID-19 I типа на койки для пациентов, находящихся в состоянии средней тяжести, исходя из наличия двух из следующих критериев:
а) насыщение крови кислородом по данным пульсоксиметрии (далее - SpO2) ≥95% (обязательный критерий);
б) температура тела (далее - T) <38 °C;
в) частота дыхательных движений (далее - ЧДД) ≤22.
Пациенты, находящиеся в состоянии средней тяжести, госпитализируются в структурное подразделение медицинской организации для лечения COVID-19 I типа на койки для пациентов, находящихся в тяжелом состоянии, не требующих искусственной вентиляции легких, исходя из наличия двух из следующих критериев:
а) SpO2 <95%; б) T ≥38 °C; в) ЧДД >22;
г) наличие признаков поражения легких с распространенностью изменений в обоих легких более 25% (при наличии результатов компьютерной томографии легких).
Пациенты, находящиеся в тяжелом состоянии, госпитализируются в структурное подразделение медицинской организации для лечения COVID-19 I типа на койки для пациентов, находящихся в тяжелом состоянии, требующих проведения неинвазивной вентиляции легких, исходя из наличия двух из следующих критериев:
а) SpO2 ≤93%; б) T ≥39 °C; в) ЧДД ≥30.
Дополнительными признаками нахождения пациента в тяжелом состоянии являются снижение уровня сознания, ажитация, нестабильные гемодинамические показатели (систолическое артериальное давление < 90 мм рт. ст., диастолическое артериальное давление <60 мм рт. ст.).
Пациенты, находящиеся в крайне тяжелом состоянии, госпитализируются в структурное подразделение медицинской организации для лечения COVID-19 I типа на койки для пациентов, находящихся в крайне тяжелом состоянии, требующих проведения инвазивной искусственной вентиляции легких, исходя из наличия двух из следующих критериев:
а) нарушение сознания;
б) SpO2 <92% (на фоне кислородотерапии); в) ЧДД >35.
Кроме того, при наличии медицинских показаний госпитализации подлежат пациенты, проживающие в общежитии, коммунальной квартире, учреждениях социального обслуживания с круглосуточным пребыванием и средствах размещения, предоставляющих гостиничные услуги, с лицами старше 65 лет, с лицами, страдающими хроническими заболеваниями бронхолегочной, сердечно-сосудистой и эндокринной систем, не имеющие возможности находиться в отдельной комнате по месту пребывания, иногородние пациенты, проходящие стационарное лечение в иных медицинских организациях при положительном результате теста на COVID-19.
Госпитализация пациентов моложе 18 лет с установленным диагнозом в медицинские организации в зависимости от степени тяжести
Пациенты в возрасте до 18 лет госпитализируются в структурное подразделение медицинской организации для лечения COVID-19 I типа при наличии одного из следующих критериев:
а) T > 39,0 °C в день обращения или T > 38 °C в течение 5 календарных дней и больше;
б) дыхательная недостаточность (наличие любого признака из нижеперечисленных симптомов респираторного дистресса):
тахипноэ: частота дыхания у детей в возрасте до 1 года - более 50, от 1 до 5 лет - более 40, старше 5 лет - более 30 в минуту;
одышка в покое или при беспокойстве ребенка; участие вспомогательной мускулатуры в акте дыхания;
втяжения уступчивых мест грудной клетки при дыхании; раздувание крыльев носа при дыхании;
кряхтящее или стонущее дыхание; эпизоды апноэ;
кивательные движения головы, синхронные со вдохом; дистанционные хрипы;
невозможность сосать/пить вследствие дыхательных нарушений; акроцианоз или центральный цианоз;
SpO2 < 95%;
в) тахикардия у детей в возрасте до 1 года - более 140, от 1 до 5 лет - более 130, старше 5 лет - более 120 ударов в минуту; г) наличие геморрагической сыпи;
д) наличие любого из следующих экстренных и неотложных признаков: судороги;
шок;
тяжелая дыхательная недостаточность; тяжелое обезвоживание;
угнетение сознания (сонливость) или возбуждение;
е) наличие одного из следующих тяжелых фоновых заболеваний независимо от уровня повышения T и степени выраженности дыхательной недостаточности:
иммунодефицитное состояние, в том числе на фоне лечения иммуносупрессивными препаратами;
онкологические и онкогематологические заболевания; болезни с нарушениями системы свертывания крови;
врожденные и приобретенные пороки и заболевания сердца, в том числе нарушения ритма, кардиомиопатия;
врожденные и приобретенные хронические заболевания легких; болезни эндокринной системы (сахарный диабет, ожирение);
хронические тяжелые болезни печени, почек, желудочно-кишечного тракта;
ж) невозможность изоляции при проживании с лицами, относящимися к группе риска
з) отсутствие условий для лечения на дому или гарантий выполнения рекомендаций (общежитие, учреждения социального обслуживания, пункт временного размещения, социально неблагополучная семья, неблагоприятные социально-бытовые условия).
Особенности транспортировки больных COVID-19
Перевозка больных и лиц с подозрением на COVID-19 в стационар осуществляется на специально выделенном транспорте. Все перевозимые лица обеспечиваются медицинской маской. Сопровождающий персонал, включая водителей, должен использовать СИЗ, исключающие риски инфицирования. После доставки автотранспорт подвергается дезинфекции в специально оборудованном месте на территории медицинской организации, принимающей больных (подозрительных) COVID-19.
Алгоритм действия при выявлении коронавирусной инфекции у пациентов, находящихся в непрофильных медицинских организациях
При выявлении лиц с подтвержденным диагнозом COVID-19 и лиц с подозрением на заболевание в непрофильных медицинских организациях проводятся:
перевод больного COVID-19 в специализированную медицинскую организацию; установление лиц, контактировавших с больными COVID-19, среди работников медицинских организаций и больных, их изоляция в домашних условиях или госпитализация в том числе по эпидемиологическим показаниям, лабораторное обследование на COVID-19 и установление медицинского наблюдения на срок 7 календарных дней со дня последнего контакта с больным, назначение средств экстренной профилактики (профилактического лечения); закрытие отделения на «прием», максимальная выписка пациентов из отделения, заключительная дезинфекция; в зависимости от эпидемиологических рисков закрытие стационара на «прием» с обсервацией больных и работников медицинских организаций.
Маршрутизация пациентов, нуждающихся в экстренной хирургической помощи Пациентам, находящимся на стационарном лечении, специализированная экстренная хирургическая помощь оказывается в многопрофильной инфекционной больнице или перепрофилированном многопрофильном стационаре для оказания помощи больным с COVID-19 (в операционном блоке, оборудованном для проведения операций у пациентов с COVID-19). При необходимости в инфекционный стационар может быть вызвана специализированная хирургическая бригада из другого учреждения, если профильных специалистов нет на месте.
В ряде случаев решение о переводе пациента с COVID-19 для экстренной хирургической помощи в иной специализированный инфекционный стационар или перепрофилированный многопрофильный стационар может быть принято в индивидуальном порядке с учетом возможности безопасной транспортировки при отсутствии обусловленной транспортировкой угрозы для жизни. Специализированные хирургические бригады могут быть использованы в тех случаях, когда в лечебном учреждении нет специалистов соответствующего профиля или квалификации.
Пациента, находящемся на домашнем лечении, госпитализируют для оказания экстренной хирургической помощи в многопрофильную инфекционную больницу или перепрофилированный многопрофильный стационар для оказания помощи больным с COVID-19. При необходимости в стационар может быть вызвана специализированная хирургическая бригада. Специализированные хирургические бригады могут быть использованы в тех случаях, когда в лечебном учреждении нет специалистов соответствующего профиля или квалификации. В остальных случаях экстренная хирургическая помощь оказывается специалистами многопрофильной инфекционной больницы.
Пациентам, находящимся на карантине, экстренная хирургическая помощь оказывается на базе специализированной хирургической больницы, имеющей возможность изолировать подозрительных (условно инфицированных) пациентов с дальнейшим переводом в инфекционное отделение для пациентов с внебольничной пневмонией. Экстренную хирургическую помощь оказывают в специализированном хирургическом стационаре (имеющем в своем составе мельцеровские боксы или инфекционное отделение для пациентов с внебольничной пневмонией). Оказание медицинской помощи проводится медицинским персоналом, не контактирующим с пациентами с COVID-19, если пациент был на карантине более 7 дней или у него отрицательный тест на COVID-19. При выявлении внебольничной пневмонии или положительном тесте наCOVID-19 экстренную хирургическую помощь оказывают в многопрофильной инфекционной больнице или перепрофилированном многопрофильном стационаре для оказания помощи больным с COVID-19.
Условия перевода пациентов в структурное подразделение медицинскои□ организации для лечения COVID-19 II типа
Пациенты с установленным диагнозом новой коронавирусной инфекции COVID-19 в возрасте 18 лет и старше, поступившие в структурное подразделение медицинской организации для лечения COVID-19 I типа, созданного для госпитализации пациентов, находящихся в тяжелом и крайне тяжелом состоянии, а также пациентов, относящихся к группе риска переводятся для продолжения лечения в стационарных условиях на койки для пациентов, находящихся на долечивании в медицинских организациях для лечения COVID-19 II типа при наличии следующих критериев:
а) стойкое улучшение клинической картины;
б) уровень насыщения крови кислородом на воздухе ≥93%; в) температура тела <37,5 °C;
г) уровень C-реактивного белка <30 мг/л; д) уровень лимфоцитов крови >1×109/л.
Условия выписки пациентов на амбулаторный этап оказания медицинской помощи Пациенты, поступившие в структурное подразделение медицинской организации для лечения COVID-19 I типа, выписываются для продолжения лечения в амбулаторных условиях исходя из наличия следующих критериев:
а) стойкое улучшение клинической картины;
б) уровень насыщения крови кислородом на воздухе ≥95%; в) температура тела <37,5 °C;
г) уровень C-реактивного белка <10 мг/л; д) уровень лимфоцитов крови > 1,2×109/л.
Выписка пациентов к занятию трудовой деятельностью (обучению), допуск в организованные коллективы после проведения лечения (как в стационарных, так и в амбулаторных условиях) и выздоровления осуществляется без лабораторного обследования на COVID-19, если время лечения составляет 7 и более календарных дней. В случае, если время лечения (наблюдения) пациента с лабораторно подтвержденным инфицированием возбудителем COVID-19 составляет менее 7 календарных дней, то выписка к занятию трудовой деятельностью (обучению), допуск в организованные коллективы осуществляются после получения одного отрицательного результата лабораторного обследования на COVID-19, проведенного не ранее чем через 3 календарных дня после получения положительного результата лабораторного обследования на COVID-19.
Литература
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 15 (22.02.2022) (утв. Минздравом России) (вместе с «Инструкцией по проведению диагностики COVID-19 с применением методов амплификации нуклеиновых кислот», «Инструкцией по проведению диагностики COVID-19 с применением иммунохимических методов», «Рекомендованными схемами лечения в амбулаторных условиях», «Рекомендованными схемами лечения в условиях стационара», «Инструкцией по соблюдению мер инфекционной безопасности для выездных бригад скорой медицинской помощи»).
- Приказ Минздрава России от 19.03.2020 №198н (ред. от 04.02.2022) «О временном порядке организации работы медицинских организаций в целях реализации мер по профилактике и снижению рисков распространения новой коронавирусной инфекции COVID-19».
- Приложение № 8 к приказу Министерства здравоохранения Российской Федерации от 19 марта 2020 г. №198н «Основные принципы оказания медицинской помощи в амбулаторных условия (на дому) пациентам с установленным диагнозом новой коронавирусной инфекции COVID-19».
- Приложение № 12 к приказу Министерства здравоохранения Российской Федерации от 19 марта 2020 г. № 198н «Порядок госпитализации в медицинские организации пациентов с установленным диагнозом новой коронавирусной инфекции COVID-19 в зависимости от тяжести заболевания».
- Постановление Главного государственного санитарного врача РФ от 22.05.2020 № 15 (ред. от 04.02.2022) «Об утверждении санитарно-эпидемиологических правил СП 1.3597-20 "Профилактика новой коронавирусной инфекции (COVID-19)».
- СП 1.3597-20 «Профилактика новой коронавирусной инфекции (COVID-19)».
1.9 Лечебная тактика
1.9.1 Препараты прямого противовирусного действия (С.Н. Авдеев)
К препаратам прямого противовирусного действия, которые могут быть использованы при лечении COVID-19 отностся: фавипиравир, ремдесивир, молнупиравир и нирматрелвир + ритонавир.
Фавипиравир
Фавипиравир – синтетический противовирусный препарат, селективный ингибитор РНК- полимеразы, активный в отношении РНК-содержащих вирусов. Фавипиравир в таблетированной форме может применяться как в амбулаторных, так и в стационарных условиях. Фавипиравир в формах для парентерального применения может использоваться только в стационарных условиях.
В Российском РКИ Фавипиравир продемонстрировал быстрый противовирусный ответ против SARSCoV-2 [1]. Доля пациентов с отрицательной ПЦР на 5-й день при терапии фавипиравиром была в два раза выше, чем в контрольной группе (р <0,05). Новых проблем безопасности, связанных с фавипиравиром, не возникало, поскольку все побочные реакции были легкой и средней степени тяжести [1].
В клинических исследованиях был продемонстрирован благоприятный профиль безопасности фавипиравира для парентерального введения (частота нежелательных явлений у пациентов, получавших фавипиравир в клинических исследованиях, не отличалась от таковой в группе стандартной терапии) и высокая эффективность в отношении улучшения клинического статуса, в том числе у пациентов имеющих высокий риск тяжелого течения заболевания: пациенты старше 65 лет, пациенты с сопутствующими заболеваниями (сахарный диабет, ожирение, хронические заболевания сердечно-сосудистой системы) [2].
Ремдесивир
Активный метаболит ремдесивира выступает в качестве аналога аденозинтрифосфата (АТФ) и конкурирует с природным АТФ-субстратом за включение в формирующиеся РНК-цепи с помощью РНК-зависимой РНК-полимеразы вируса SARS-CoV-2, что приводит к задержанному обрыву цепи во время репликации вирусной РНК. Применение препарата возможно только в медицинской организации, оказывающей медицинскую помощь в стационарных условиях (препарат вводится только внутривенно).
В стационарных условиях рекомендуется применение ремдесивира в виде пятидневного общего курса по 200 мг внутривенно в первый день, затем по 100 мг внутривенно в каждый последующий день перед выпиской в течение максимум четырех дополнительных дней [3]. В исследовании CATCOtrial ремдесивир ассоциировался с небольшим, но значимым снижением частоты перехода на искусственную вентиляцию легких (ИВЛ): 8,0% пациентов, получавших ремдесивир, нуждались в ИВЛ во время госпитализации по сравнению с 15% пациентов, получавших стандартную помощь в то время [4].
Исследование SOLIDARITY показало небольшое, но статистически значимое замедление прогрессирования заболевания и снижение смертности у пациентов, которым не проводилась ИВЛ; те, которым требовалась ИВЛ, не показали различий при лечении ремдесивиром или плацебо [5].
Учитывая благоприятный профиль безопасности препарата (частота нежелательных явлений у пациентов, получавших ремдесивир в клинических исследованиях, не отличалась от таковой в группе стандартной терапии), а также данные по его эффективности, ремдесивир может рассматриваться как препарат выбора для пациентов с повышенной активностью трансаминаз на начало лечения)
Молнупиравир
Молнупиравир является низкомолекулярным рибонуклеозидным пролекарством N- гидроксицитидина (NHC). После приема молнупиравира NHC фосфорилируется до трифосфата NHC, который встраивается в вирусную РНК с помощью РНК-полимеразы, создавая ошибки в вирусном геноме путем включения гуанозина или аденозина в цепь РНК. С каждым циклом репликации вируса мутации накапливаются, что в конечном итоге делает вирус SARS-CoV-2 неинфекционным и неспособным к репликации.
В исследовании 3-й фазы (NCT04575597) с участием 1433 пациентов было установлено, что у пациентов в группе, получавших молнупиравир (n=716) в дозе 800 мг (четыре капсулы по 200 мг) каждые 12 часов в течение 5 дней, достоверно установлено снижение риска госпитализации или смерти по сравнению с группой плацебо [6]. Препарат продемонстрировал благоприятный профиль безопасности: соотношение пациентов, которые имели хотя бы одно нежелательное явление, было сходным в двух группах (30,4% в группе молнупиравира и 33,0% в группе плацебо).
В Российской Федерации молнупиравир зарегистрирован для лечения новой коронавирусной инфекции (COVID-19) легкого или среднетяжелого течения у взрослых, в том числе с повышенным риском прогрессирования заболевания до тяжелого течения и не требующих дополнительной оксигенотерапии. Лечение молнупиравиром должно быть начато как можно раньше после постановки диагноза новой коронавирусной инфекции (COVID-19) и/или в течение 5 дней после появления первых симптомов заболевания.
Нирматрелвир + ритонавир
В основе механизма действия препарата нирматрелвира лежит блокирование активности протеазы SARS-CoV-2-3CL и предотвращение репликации вируса. Ритонавир выступает в качестве фармакокинетического бустера, помогает замедлить метаболизм или распад нирматрелвира с целью сохранения его активности в течение более длительного времени и в более высоких концентрациях.
Финальные данные клинического исследования фазы 2/3 у пациентов высокого риска показали, что нирматрелвир + ритонавир снижает риск госпитализации и смерти на 89% (в течение 3 дней от появления симптомов) и на 88% (в течение 5 дней от появления симптомов) по сравнению с плацебо [7]. Не было зарегистрировано случаев смерти по сравнению с плацебо у не госпитализированных пациентов высокого риска с COVID-19. Препарат одобрен для экстренного применения Европейским медицинским агентством и FDA у пациентов с COVID-19 начиная с возраста 12 лет и массой тела не менее 40 кг.
В Российской Федерации нирматрелвир + ритонавир показан для лечения COVID-19 легкого и среднетяжелого течения у взрослых, в том числе с повышенным риском прогрессирования заболевания до более тяжелого течения и не требующих дополнительной оксигенотерапии. Лечение лекарственным препаратом, содержащим нирматрелвир+ритонавир, должно быть начато как можно раньше после постановки диагноза новой коронавирусной инфекции (COVID-19) и/или в течение 5 дней после появления первых симптомов заболевания.
Рекомендации:
Пациентам с инфекцией СOVID-19 в течение 5 дней после появления первых симптомов заболевания рекомендуется назначение терапии фавипиравиром.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Госпитализированным пациентам с инфекцией СOVID-19, не нуждающимся в ИВЛ, в течение 5 дней после появления первых симптомов заболевания рекомендуется назначение терапии ремдесивиром
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Пациентам с инфекцией СOVID-19 в течение 5 дней после появления первых симптомов заболевания рекомендуется назначение терапии молнупиравиром
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Пациентам с инфекцией СOVID-19 в течение 5 дней после появления первых симптомов заболевания рекомендуется назначение терапии нирматрелвиром + ритонавиром
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Литература
- Ivashchenko AA, Dmitriev KA, Vostokova NV et al. AVIFAVIR for Treatment of Patients With Moderate Coronavirus Disease 2019 (COVID-19): Interim Results of a Phase II/III Multicenter Randomized Clinical Trial. Clin Infect Dis 2021;73(3):531-534. doi: 1093/cid/ciaa1176.
- Балыкова Л.А., Заславская К.Я., Павелкина В.Ф. с соавт. Эффективность и безопасность инфузионного введения фавипиравира у пациентов, госпитализированных с COVID-19. Фармация и фармакология 2022;10(1):113-126. doi: 19163/2307-9266-2022-10-1-113-126.
- COVID-19 Treatment Guidelines. Published 24 February 2022. Available online: https://www.covid19treatmentguidelines.nih.gov/therapies/antiviral-therapy/remdesivir/ (accessed on 5 May 2022).
- Ali K, Azher T, Baqi M et al. Remdesivir for the treatment of patients in hospital with COVID-19 in Canada: A randomized controlled Can Med Assoc J 2022; 194: E242–E251.
- WHO Solidarity Trial Consortium. Remdesivir and three other drugs for hospitalised patients with COVID-19: Final results of the WHO Solidarity randomised trial and updated meta- Lancet 2022, 399: 1941–1953.
- Jayk Bernal A, Gomes da Silva MM, Musungaie DB et al. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. N Engl J Med 2021, 386.
- Hammond J, Leister-Tebbe H, Gardner A et al. EPIC-HR Investigators. Oral nirmatrelvir for high-risk, nonhospitalized adults with covid-19. N Engl J Med 2022; 386: 1397-408. doi: 1056/NEJMoa2118542. pmid: 35172054.
1.9.2 Глюкокортикостероиды (А.А. Зайцев)
Рекомендовано назначение системных глюкокортикостероидов (дексаметазон, метилпреднизолон) пациентам с новой коронавирусной инфекцией с поражением легких с явлениями острой дыхательной недостаточности.
Уровень убедительности рекомендации□ С (уровень достоверности доказательств – 5)
Комментарий. Глюкокортикостероиды (ГКС) являются препаратами первого выбора для лечения больных с цитокиновым штормом, они угнетают все фазы воспаления, синтез широкого спектра провоспалительных медиаторов, увеличение концентрации которых в рамках цитокинового шторма ассоциируется с неблагоприятным прогнозом при COVID- 19 и риском развития ОРДС.
Не рекомендуется пероральное и внутривенное применение ГКС при лечении легких форм COVID-19, в том числе в амбулаторно-поликлинических и стационарных условиях. Профилактическое применение ГКС, равно как и раннее назначение (в первые 5 суток заболевания при отсутствии показаний), также не рекомендовано.
Для терапии среднетяжелой и тяжелой форм COVID-19 с поражением легких и дыхательной недостаточностью могут применяться различные схемы введения ГКС: дексаметазон в дозе 6-20 мг/сутки внутривенно в зависимости от тяжести состояния пациента за 1-2 введения; метилпреднизолон в 125 мг мг/введение/внутривенно каждые 12 ч. или 250-500 мг/введение/внутривенно одномоментно.
Максимальная доза ГКС применяется в течение 3-4 суток, а затем снижается при стабилизации состояния (купирование лихорадки, стабильное снижение уровня СРБ, активности АЛТ и/или АСТ, ЛДГ сыворотки крови) на 20-25% на введение/сутки в первые 2 суток, далее – на 50% каждые 1-2 суток до полной отмены. Терапия ГКС более 10 суток не рекомендована.
Пациенты, получающие ГКС, должны находиться под наблюдением на предмет возникновения побочных эффектов. К ним относятся: гипергликемия, артериальная гипертензия, эрозивно-язвенное поражение верхних отделов ЖКТ.
ГКС необходимо применять с осторожностью при:
сахарном диабете; гипертонической болезни;
язвенной болезни желудка и 12-перстной кишки; ожирении;
признаках активной бактериальной инфекции; тромботических нарушениях.
Литература
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции COVID-19». Версия 15 (22.02.2022).
- Johnson R., Vinetz J. Dexamethasone in the management of COVID-19. ВMJ. 2020; 370: doi: 10.1136/bmj.m2648.
- Munch M., Myatra S. et al. Effect of 12 mg vs 6 mg of Dexamethasone on the Number of Days Alive Without Life Support in Adults With COVID-19 and Severe Hypoxemia: The COVID STEROID 2 Randomized Trial. JAMA. 2021; 326 (18): 1807-1817. doi: 1001/jama.2021.18295.
- Papamanoli A., Yoo J., Grewal P. et al. High-dose methylprednisolone in nonintubated patients with severe COVID-19 pneumonia. Eur J Clin Invest. 2021; 51(2):e13458. doi: 1111/eci.13458.
- Зайцев А.А., Голухова Е.З., Мамалыга М.Л., с соавт. Эффективность пульс-терапии метилпреднизолоном у пациентов с COVID-19. КМАХ.2020, Т. 22, №2: 88 – 91. doi: 36488/cmac.2020.2.88¬91
- Webb S., Higgins A., McArthur C. Glucocorticoid Dose in COVID-19: Lessons for Clinical Trials During a JAMA 2021; 326 (18): 1801-1802. doi: 10.1001/jama.2021.16438.
1.9.3 Применение антикоагулянтных и антиагрегантных препаратов в терапии коронавирусной инфекции (И.В. Демко)
Важной особенностью COVID-19, которая широко обсуждается медицинским и научным сообществом, является вовлеченность в инфекционный процесс механизмов тромбообразования.
По данным метаанализа (42 исследования, суммарное количество пациентов – 8271), опубликованного в Lancet в декабре 2020 года, частота тромбоэмболии легочной артерии (ТЭЛА) в сочетании с тромбозом глубоких вен (ТГВ) составила 21% среди всех госпитализированных пациентов с COVID-19, а в отделениях реанимации и интенсивной терапии (ОРИТ) достигала 31%. Исключительно ТГВ наблюдался в 20% случаев (28% в ОРИТ), исключительно ТЭЛА – в 13% случаев (19% в ОРИТ), а по данным аутопсий у умерших пациентов – в 22% случаев. В этом же метаанализе проанализированы случаи артериальных тромбозов, частота встречаемости которых в отделении ОРИТ составила 5%, общая – 2%, а структура представлена инсультом в 1% случаев, инфарктом миокарда в 0,5% случаев, тромбозами периферических и мезентериальных артерий в 0,4% случаев [Malas et al., 2020].
Патогенез гиперкоагуляции и тромбообразования при COVID-19
При тяжелом течении заболевания, как правило, присутствуют все три компонента триады Вирхова:
- Повреждение сосудов, по некоторым данным, может быть обусловлено инвазией вируса в клетки эндотелия (системный эндотелиит играет центральную роль в патогенезе острого респираторного дистресс-синдрома и органной недостаточности у пациентов с тяжелой формой), цитокинами (в частности, ИЛ-6), а также внутрисосудистыми катетерами.
- Стаз связан с длительной иммобилизацией пациентов с тяжелым течением заболевания, особенно при госпитализации в ОРИТ.
- Гиперкоагуляция у пациентов с тяжелой формой заболевания объясняется концентрацией протромботических факторов: увеличение концентрации фактора VIII и фибриногена, повышенная вязкость крови, нейтрофильные внеклеточные ловушки. Высокий уровень Д-димера, по данным многих наблюдений, коррелирует с тяжестью заболевания. Повышенный уровень этого показателя свидетельствует об активности распада фибрина под действием плазминогена, что происходит практически одновременно с образованием тромбов. Повышенное образование тромбина закономерно инициирует активацию тромбоцитов, их агрегацию и, как следствие, секрецию ими провоспалительных и прочих агентов (например, тромбоксана А2), которые дополнительно стимулируют процессы тромбообразования. Важные для гемостаза в норме, в патологических обстоятельствах эти реакции тромбоцитов могут способствовать процессам тромбовоспаления.
|
Таблица. Антикоагулянты для лечения COVID-19 у взрослых. |
|||
|
Препарат |
Профилактическа я доза |
Промежуточная доза |
Лечебная доза |
|
Антикоагулянты для парентерального введения |
|||
|
Нефракционированный гепарин |
|||
|
Нефракционирова нныи□ гепарин |
Подкожно 5000 ЕД 2-3 раза/сут |
Подкожно 7500 ЕД 2-3 раза/сут |
В/в инфузия оптимально под контролем анти-Ха активности (АЧТВ может повышаться при COVID-19, поэтому может быть ненадежным). Начальная доза при венозных тромбоэмболических осложнениях – внутривенно болюсом 80 ЕД/кг (максимально 5000 ЕД) и инфузия с начальнои□ скоростью 18 ЕД/кг/ч. |
|
Низкомолекулярные гепарины |
|||
|
Далтепарин натрия |
Подкожно 5000 анти-Ха МЕ 1 раз/сут |
Подкожно 5000 анти- Ха МЕ 2 раза/сут |
Подкожно 100 анти-Ха МЕ/кг 2 раза/сут |
|
Надропарин кальция |
Подкожно 3800 анти-Ха МЕ (0,4 мл) 1 раз/сут при массе тела ≤70 кг или 5700 анти-Ха МЕ (0,6 мл) 1 раз/сут при массе тела >70 кг |
Подкожно 5700 анти- Ха МЕ (0,6 мл) 2 раза/сут |
Подкожно 86 анти-Ха МЕ/кг 2 раза/сут |
|
Эноксапарин натрия |
Подкожно 4000 анти-Ха МЕ (40 мг) 1 раз/сут |
Подкожно 4000 анти- Ха МЕ (40 мг) 2 раза/сут; возможно увеличение до 50 МЕ (0,5 мг)/кг 2 раза/сут |
Подкожно 100 анти-Ха МЕ (1 мг)/кг 2 раза/сут, при клиренсе креатинина 15-30 мл/мин 100 анти-Ха МЕ (1 мг)/кг 1 раз/сут |
|
Парнапарин натрия |
Подкожно 0,3 мл (3200 анти-Ха МЕ) или 0,4 мг (4250 анти-Ха МЕ) 1 раз/сут |
Подкожно 0,3 мл (3200 анти-Ха МЕ) 2 раза/сут |
Подкожно 0,6 мл (6400 анти-Ха МЕ) 2 раза/сут |
|
Бемипарин натрия |
Подкожно 2500 анти-Ха МЕ 1 раз/сут |
Подкожно 3500 анти- Ха МЕ 1 раз/сут |
|
|
Синтетические антикоагулянты |
|||
|
Фондапаринукс натрия |
Подкожно 2,5 мг 1 раз/сут При клиренсе креатинина 20-50 мл/мин – 1,5 мг 1раз/сут |
|
Лечение ТГВ/ТЭЛА: 5 мг 1 раз/сут при массе тела до 50 кг; 7,5 мг 1 раз/сут при массе тела 50-100 кг; 10 мг 1 раз/сут при массе тела выше 100 кг |
|
Пероральные антикоагулянты |
|||
|
Ривароксабан |
10 мг 1 раз /сут |
|
Лечение ТГВ/ТЭЛА: 15 мг 2 раза/сут 21 сутки, затем 20 мг 1 раз/сут не менее 3 месяцев |
|
Апиксабан |
2,5 мг 2 раза/сут |
|
Лечение ТГВ/ТЭЛА: 10 мг 2 раза/сут 7 суток, затем 5 мг 2 раза/сут как минимум 3 месяца |
|
Дабигатрана этексилат |
110 мг 2 раза/сут; 75 мг 2 раза/сут у больных с клиренсом креатинина 30-49 мл/мин |
|
Лечение ТГВ/ТЭЛА: после как минимум 5 суток введения лечебных доз парентеральных антикоагулянтов 150 мг 2 раза/сут не менее 3 месяцев |
Антитромботическая терапия у пациентов на амбулаторном этапе
Профилактика ТГВ нижних конечностей/ТЭЛА с использованием профилактических доз низкомолекулярного гепарина (НМГ)/фондапаринукса натрия рекомендуется пациентам со среднетяжелой формой COVID-19, которые в условиях карантина лечатся дома и имеют высокий риск венозных тромбоэмболических осложнений, низкий риск кровотечений и не получают антикоагулянтного лечения по другим показаниям. Это относится прежде всего к больным с сильно ограниченной подвижностью, ТГВ/ТЭЛА в анамнезе, активным злокачественным новообразованием, крупной операцией или травмой в предшествующий месяц, носителям ряда тромбофилий (дефициты антитромбина, протеинов С или S, антифосфолипидный синдром, фактор V Лейден, мутация гена протромбина G-20210A), а также при сочетании дополнительных факторов риска ТГВ/ТЭЛА (возраст старше 70 лет, сердечная/дыхательная недостаточность, ожирение, системные заболевания соединительной ткани, гормональная заместительная терапия/прием оральных контрацептивов).
При отсутствии НМГ/НФГ/фондапаринукса натрия можно рассмотреть вопрос о применении профилактических доз прямых пероральных антикоагулянтов: ривароксабан в дозе 10 мг 1 раз в сутки, апиксабан в дозе 2,5 мг 2 раза в сутки, дабигатрана этексилат в дозе 110 мг 2 раза в сутки (для больных с клиренсом креатинина 30-49 мл/мин – 75 мг 2 раза в сутки).
Предложенная доза дабигатрана этексилата основана на опыте его применения для профилактики ТГВ/ТЭЛА в ортопедической хирургии, а также для профилактики сосудистых осложнений после несердечных хирургических вмешательств у больных с синусовым ритмом и повышенным уровнем тропонина.
При амбулаторном назначении антикоагулянтов следует уделять особое внимание наличию противопоказаний (прежде всего выраженной почечной недостаточности), во время их использования необходимо повторно оценивать риск и активно искать признаки кровотечений. Длительность применения антикоагулянтов при амбулаторном лечении COVID-19 не ясна и, по-видимому, может продолжаться вплоть до 30 суток в зависимости от динамики клинического состояния пациента и сроков восстановления двигательной активности.
Алгоритм применения антикоагулянтов для лечения COVID-19 у взрослых пациентов в амбулаторных условиях
При лёгком течении заболевания, отсутствии факторов риска ТВГ/ТЭЛА и показаний для приема ПОАК рутинное их назначение не показано. При течении COVID-19 среднейстепени тяжести и наличии факторов риска ТВГ/ТЭЛА рекомендован прием ПОАК в профилактических дозах.
Амбулаторным пациентам при наличии показаний к приему ПОАК (фибрилляция предсердий, протезирование клапанов сердца и др.) рекомендовано продолжение терапии ПОАК в назначенных дозах. При наличии лекарственного взаимодействия необходима отмена ПОАК и перевод на НМГ/НФГ в лечебных дозах. После выздоровления необходимо продолжить прием ПОАК в рекомендованных дозах.
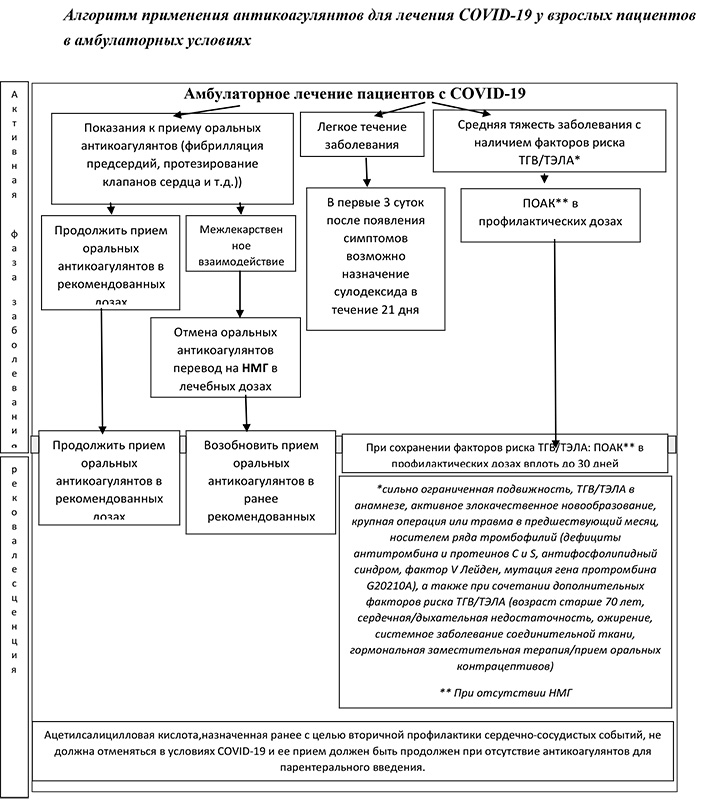
Антитромботическая терапия у пациентов в условиях стационара
Назначение НМГ/фондапаринукса натрия, как минимум, в профилактических дозах показано ВСЕМ госпитализированным пациентам и должно продолжаться до выписки. Нет доказанных преимуществ какого-либо одного НМГ по сравнению с другими. При недоступности НМГ/фондапаринукса натрия или противопоказаниях к ним возможно использование НФГ.
У больных с ожирением (индекс массы тела >30 кг/м2) следует рассмотреть увеличение профилактической дозы на 50%.
По опубликованным результатам рандомизированных контролируемых исследований, у больных, находящихся в ОРИТ, рутинное увеличение дозы НМГ/НФГ до промежуточной или лечебной не улучшает клинических исходов заболевания. Данные трех рандомизированных контролируемых исследований указывают на преимущество применения лечебных доз НМГ/НФГ только у госпитализированных больных, не нуждающихся в пребывании в ОРИТ.
Алгоритм применения антикоагулянтов для лечения COVID-19 у взрослых пациентов в условиях стационара
Госпитализированным пациентам с COVID-19 со средней тяжестью заболевания при наличии показаний к приему ПОАК (фибрилляция предсердий, протезирование клапанов сердца и др.) рекомендован переход на лечебные дозы НМГ/НФГ или продолжение терапии ПОАК в рекомендованных дозах. После выписки необходимо продолжить прием ПОАК в рекомендованных дозах.
Пациентам с тяжелым течением коронавирусной инфекции и наличии показаний к приему ПОАК (фибрилляция предсердий, протезирование клапанов сердца) рекомендована отмена ПОАК и переход на лечебные дозы НМГ/НФГ. После выписки необходимо возобновить прием ПОАК в рекомендованных дозах.
У госпитализированных пациентов с COVID-19 при подтверждении диагноза ТЭЛА/ТГВ необходимо начать терапию НМГ/НФГ в лечебных дозах. После выписки рекомендован прием ПОАК в течение не менее 3 месяцев с соответсвии с актуальными схемами лечения.
Пациентам со средней тяжестью течения COVID-19 и клинико-лабораторно- инструментальных признаков ТЭЛА/ТВГ рекомендовано введение НМГ/НФГ в лечебных дозах. При тяжелом течении заболевания рекомендовано введение НМГ/НФГ в профилактических дозах. После выписки и наличии факторов риска развития ТВГ/ТЭЛА рекомендован прием ПОАК в течение 30-45 дней или НМГ в профилактических дозах
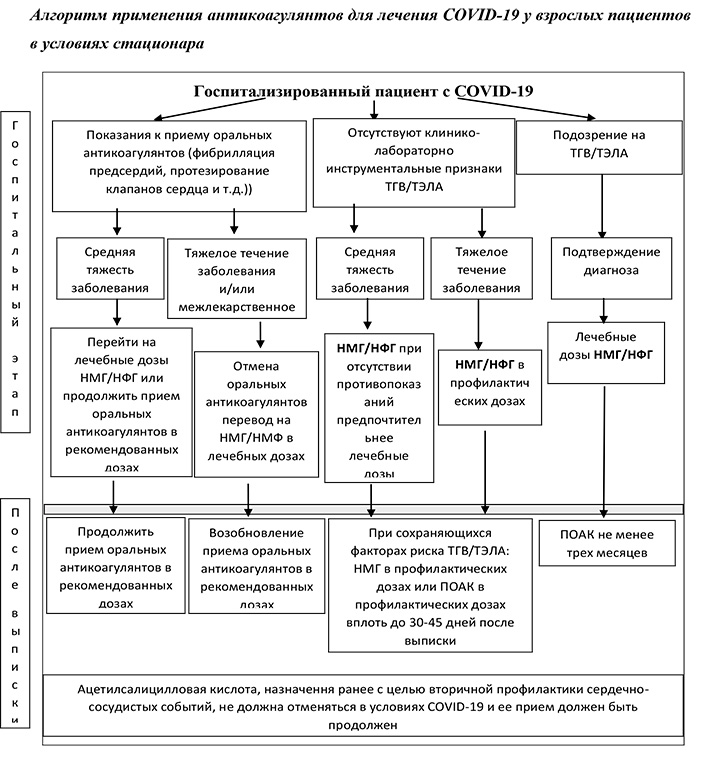
Профилактика тромбоэмболических осложнений у больных с показаниями к длительной антикоагулянтной терапии
Пациенты с показаниями к длительной антикоагулянтной терапии (фибрилляция предсердий, механические протезы клапанов сердца и др.) после выписки из стационара по поводу перенесенной COVID-19 должны продолжать прием ранее назначавшихся препаратов. В случае использования прямых пероральных антикоагулянтов необходима оценка адекватности рекомендованных ранее доз, учитывая потенциальную возможность ухудшения функции почек после COVID-19. Для больных, получающих антагонисты витамина К, следует предусмотреть более частый контроль МНО (по крайней мере, до получения двух близких значений в целевом диапазоне).
Продленная профилактика ТГВ/ТЭЛА
Продленная профилактика у больных с COVID-19 после выписки рекомендуется при сохраняющемся повышенном риске венозных тромбоэмболических осложнений и низком риске кровотечений в случаях, когда не требуются лечебные дозы антикоагулянта по другим показаниям.
При продленной профилактике ТГВ/ТЭЛА у терапевтических больных в исследованиях, выполненных до начала пандемии COVID-19, есть свидтельства пользы профилактической дозы эноксапарина (40 мг 1 раз в сутки) и ривароксабана в дозе 10 мг 1 раз в сутки. Тенденция к преимуществу продленной профилактики ТГВ/ТЭЛА отмечалась также при использовании апиксабана в дозе 2,5 мг 2 раза в сутки.
В единственном к настоящему времени рандомизированном контролируемом исследовании продемонстрирована возможность продления профилактики ТГВ/ТЭЛА у больных с COVID-19 при применении ривароксабана в дозе 10 мг 1 раз в сутки в течение 35 дней после выписки. Для отбора больных для продленного использования профилактических доз антикоагулянтов разумно использовать модифицированную шкалу IMPROVE VTE с учетом уровня D-димера во время госпитализации (таблица 1)
Лечение ТГВ/ТЭЛА
В случае развития ТГВ/ТЭЛА у пациента с COVID-19 следует использовать лечебные дозы НМГ/НФГ/фондапаринукса натрия. Применение лечебных доз НМГ/НФГ/фондапаринукса натрия может рассматриваться также у больных с клиническим подозрением на тромботические осложнения, когда нет возможности верифицировать диагноз. Лечение ТГВ/ТЭЛА, ассоциированных с COVID-19, антикоагулянтами следует продолжать не менее 3 месяцев; после выписки предпочтительно использовать прямые пероральные антикоагулянты в общепринятых дозах, если к ним нет противопоказаний.
Противопоказания для использования антикоагулянтов
Продолжающееся кровотечение, уровень тромбоцитов в крови ниже 25×109/л, гепарин- индуцированная тромбоцитопения в анамнезе, выраженная почечная недостаточность (для НМГ и фондапаринукса натрия). Повышенное протромбиновое время и АЧТВ не относятся к противопоказаниям к назначению антикоагулянтов. Если антикоагулянты противопоказаны, следует использовать механические способы профилактики ТГВ нижних конечностей (предпочтительно перемежающуюся пневматическую компрессию). Применение механических способов профилактики ТГВ нижних конечностей в дополнение к антикоагулянтам можно рассмотреть также у больных, находящихся в отделениях реанимации и интенсивной терапии.
|
Таблица 1. Оценка риска венозных тромбоэмболических осложнений у больных с COVID-19 после выписки из стационара |
|
|
Фактор риска |
Балл |
|
ТГВ/ТЭЛА в анамнезе |
3 |
|
Известная врожденная или приобретенная тромбофилия, приводящая к повышению риска венозных тромбозов (дефицит протеина С или S, фактор V Лейден, волчаночный антикоагулянт) |
2 |
|
Парез или паралич нижних конечностей |
2 |
|
Злокачественное новообразование (кроме карциномы кожи – не меланомы) в любое время последние 5 лет в состоянии ремиссии более 6 месяцев, не требующее активной химиотерапии или дополнительного лечения |
2 |
|
Пребывание в отделении (блоке) интенсивной терапии |
1 |
|
Полная иммобилизация ≥1 дня (нахождение в кровати или на стуле с выходом в туалет или без него) |
1 |
|
Возраст старше 60 лет |
1 |
|
Примечание: продленная профилактика после выписки может быть рассмотрена у пациентов с суммой баллов от 4 баллов и более или при сочетании суммы баллов 2-3 с концентрацией D-димера в крови во время госпитализации выше верхней референсной границы. |
|
Антитромботическое и противовоспалительное действие антиагрегантов Согласно временным клиническим рекомендациям (версия 16), нет доказательств целесообразности широкого применения антиагрегантов для лечения COVID-19.
Когда требуется лечение в ОРИТ, данные одного рандомизированного контролируемоно исследования указывают на возможную пользу от добавления антиагреганта (ацетилсалициловой кислоты или клопидогрела) к профилактической дозе гепарина.
У пациентов с сердечно-сосудистыми заболеваниями антиагреганты следует использовать при наличии соотвествующих показаний. В частности, ацетилсалициловая кислота, назначенная ранее с целью вторичной профилактики сердечно-сосудистых событий, не должна отменяться в условиях COVID-19 и ее прием должен быть продолжен. Если пациент получает два антиагреганта, решение о составе антитромботической терапии должно приниматься индивидуально с учетом риска тромботических осложнений и кровотечений, особенно во время использования высоких доз антикоагулянтов.
Имеются доказательства косвенной противовоспалительной роли антиагрегантов, блокирующих P2Y12 рецепторы тромбоцитов. Есть данные о том, что терапия клопидогрелом может улучшить исходы у пациентов, госпитализированных с поражением легких.
Следуя тенденциям, описанным в современных клинических руководствах, пациенты с COVID-19, которые получают антикоагулянтную или антиагрегантную терапию по причине сердечно-сосудистого заболевания, должны продолжать прежнюю терапию. Этот же постулат может относиться и к пациентам с ОКС, развившимся после начала COVID- 19, а также к тем, у кого COVID-19 развился на фоне приема двойной антиагрегантной терапии (ДАТ).
Пациенты с ОКС с подъемом ST в дополнение к АСК должны получать мощный ингибитор P2Y12 рецепторов (тикагрелор или прасугрел), а если препараты этой группы недоступны или противопоказаны, то клопидогрел до (или, в крайнем случае, во время) ЧКВ, при этом лечение должно быть продолжено в течение 12 мес., если нет противопоказаний, таких как избыточный риск кровотечения. Прасугрел должен быть назначен в нагрузочной дозе 60 мг с последующим приемом10 мг 1раз в сутки.
Пациенты с ОКС без подъема ST в дополнение к АСК должны получать ингибитор P2Y12 рецепторов на 12 мес., если нет противопоказаний или избыточного риска кровотечения. Это должен быть прасугрел у пациентов, которые не получали ранее ингибитор P2Y12 и которым выполняется ЧКВ, или тикагрелор независимо от планируемой стратегии лечения, или клопидогрел в том случае, когда прасугрел или тикарелор недоступны или противопоказаны.
У пациентов с ОКС без подъемов ST прасугрел следует использовать во время или сразу после результатов диагностической коронарографии и коронарного стентирования.
Условия COVID-19 не предполагают значительного изменения традиционной тактики в отношении двойной антиагрегантной терапии при ОКС.
Вопрос о необходимости использования профилактических антикоагулянтов у госпитализированных пациентов на фоне ДАТ остается открытым и должен быть решен в индивидуальном порядке с учетом соотношения риска ВТЭ и кровотечений.
Замена любого компонента ДАТ на профилактический антикоагулянт (пероральный или парентеральный) у амбулаторных пациентов с COVID-19 может считаться нецелесообразной, особенно в первые месяцы после проведения коронарного стентирования.
Литература
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 16 (18.08.2022).
- Шляхто Е.В., Арутюнов Г.П., Беленков Ю.Н., Тарловская Е.И., Конради А.О., Панченко Е.П., Явелов И.С., Терещенко С.Н., Ардашев А.В., Арутюнов А.Г., Григорьева Н.Ю., Джунусбекова Г.А., Драпкина О.М., Козиолова Н.А., Комаров А.Л., Кропачева Е.С., Мальчикова С.В., Митьковская Н.П., Орлова Я.А., Петрова М.М., Ребров А.П., Сисакян А.С., Скибицкий В.В., Сугралиев А.Б., Фомин И.В., Чесникова А.И., Шапошник И.И., Желяков Е.Г., Канорский С.Г., Колоцей Л.В., Снежицкий В.А. Применение статинов, антикоагулянтов, антиагрегантов и антиаритмических препаратов у пациентов с COVID- Кардиология. 2020;60(6):4–14.
- Role of combining anticoagulant and antiplatelet agents in COVID-19 treatment: a rapid review Kamal Matli,1 Raymond Farah, Mario Maalouf, Nibal Chamoun, Christy Costanian , Georges Ghanem
- Эрлих А.Д. Антикоагулянты и антиагреганты в эпоху COVID-19. Атеротромбоз. 2021;11(1):58–66. https://doi.org/ 21518/2307-1109-2021-11-1-58-66.
- В.А. Отделенов, А.В. Матвеев, К.Б. Мирзаев, Д.А. Сычев Научное обоснование и предпосылки применения прямых пероральных антикоагулянтов для профилактики тромбоэмболических осложнений у пациентов с COVID-19 Архив журнала Фарматека 2020, №14.
- Bikdeli B, Madhavan MV, Jimenez D, Chuich T, Dreyfus I, et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow- up, Journal of the American College of Cardiology (2020), doi: https://doi.org/10.1016/ jacc.2020.04.031
- American Society of Hematology. COVID-19 and coagulopathy: frequently asked questions. From the ASH website. (Version 0; last updated September 24, 2020).
- Becattini C., Agnelli G., Schenone A., Eichinger S., Bucherini E., Silingardi M. et al. Aspirin for prevent- ing the recurrence of venous thromboembolism. N Engl J Med. 2012;366(21):1959– https://doi. org/10.1056/NEJMoa1114238.
1.9.4 Нестероидные противовоспалительные препараты и парацетамол (А.А. Зайцев, А.Г. Малявин)
Рекомендовано назначение нестероидных противовоспалительных препаратов пациентам с гипертермией выше 38 °С, мышечными и суставными болями с жаропонижающей, болеутоляющей и противовоспалительной целью.
Уровень убедительности рекомендации□ С (уровень достоверности доказательств – 5)
Комментарий: применение НПВП может быть рекомендовано только с симптоматической целью для достижения жаропонижающего и анальгетического эффектов. Назначение их длительным курсом нецелесообразно. Кроме того, с практической точки зрения следует помнить о том, что назначение НПВП может дезориентировать врача в оценке эффективности проводимой терапии. Рекомендованы к применению - парацетамол 325–500 мг 3 - 4 раза в сутки (максимальная суточная доза - 1500 мг), ибупрофен 400 мг 3 раза в сутки (максимальная суточная доза - 1200 мг), комбинированные лекарственные формы, содержащие парацетамол/ибупрофен, парацетамол и ибупрофен [1-4].
Данные препараты лишены ряда побочных эффектов, свойственных остальным НПВП (эрозивно-язвенные поражения желудочно-кишечного тракта, бронхоспазм, нарушение картины периферической крови и пр.).
Не рекомендуется назначение селективных НПВП вследствие возможных побочных явлении□.
В целом ряде клинических ситуаций применение одного жаропонижающего средства не всегда ведет к удовлетворительному снижению температуры тела и достаточному купированию болевого синдрома. Поэтому нередко используются комбинации анальгетиков-антипиретиков. При этом следует учитывать, что комбинированное использование двух лекарственных средств из группы НПВП не является рациональным в связи с увеличенным риском развития нежелательных реакций со стороны желудочно– кишечного тракта. Вместе с тем, совместное применение парацетамола, являющегося ненаркотическим анальгезирующим средством, с НПВП (ибупрофен) показывает хорошую эффективность в связи с лучшим жаропонижающим и обезболивающим эффектом при отсутствии увеличения частоты побочных явлений [2].
Рекомендовано назначение парацетамола в комбинации с другими препаратами, кроме психолептиков, пациентам с лихорадочно-интоксикационным и респираторным синдромами для купирования этих симптомов (парацетамол + фенилэфрин + фенирамин + аскорбиновая кислота, парацетамол + фенилэфрин + фенирамин).
Комментарии: Симптоматическое лечение проводится с анальгезирующей, жаропонижающей, противоаллергической, антиконгестивной целью и улучшения самочувствия пациентов.
Внутрь. Содержимое 1 пакетика растворяют в 1 стакане кипяченой горячей воды. Принимают в горячем виде. Повторную дозу можно принимать через каждые 4 часа при необходимости (не более 3 доз в течение 24 часа) [6-7].
Литература
- Зайцев А.А. Вопросы профилактики и симптоматической терапии острых респираторных вирусных инфекций // Медицинский совет. -2013. - № - С. 66-71.
- Дворецкий Л.И. Лихорадящий больной. Место и польза антипиретиков // Русский медицинский журнал. – 2011. – Т.19. – № 18. – C. 1166-1171.
- Малышев Н.А., Эсауленко Е.В., Яковлев А.А. и др. Рекомендации по диагностике и лечению гриппа у взрослых пациентов (с моделями пациентов). Современная медицина; 2015: С. 2–56.;
- Инфекционные болезни. Национальное руководство. Под ред. акад. РАМ Н.Д. Ющука, акад. РАЕН Ю.Я. Венгерова. – 2-е изд., перераб. и доп. М.: Издательство ГЭОТАР-Медиа, –1004 с.;
- Львов Д.К., Чучалин А.Г., Шестакова И.В. и др. Методические рекомендации«Диагностика и лечение гриппа у взрослых пациентов в эпидемический сезон 2016- 2017гг.» http://iia-rf.ru/upload/iblock/1f2/1f2bd1205d716438f32c1ab9f11e9e1c.PDF
- De Sutter, A. I., van Driel, M. L., Kumar, A. A., Lesslar, O. & Skrt, A. Oral antihistamine- decongestant-analgesic combinations for the common cold. Cochrane Database Syst. Rev. (2012). doi: 10.1002/14651858.CD004976.pub3.
- Мартынов А.И., Малявин А.Г., Журавлëва, М.В. и др. Консенсус экспертного совета РНМОТ «Улучшение результатов лечения инфекций дыхательных путей» Профилактическая медицина, 2019, 22(4); 144-151.
1.9.5 Ингибиторы ИЛ-6 рецепторов (А.А. Зайцев)
Новая коронавирусная инфекция, вызванная вирусом SARS-CoV-2, характеризуется системной гипервоспалительной реакцией с выраженным повышением содержания в крови провоспалительных цитокинов, получившей название «цитокиновый шторм». По современным представлениям, этот процесс является ведущей причиной развития тяжелых поражений легких с прогрессирующей дыхательной недостаточностью.
Важная роль в развитии патологического воспаления при коронавирусной инфекции принадлежит интерлейкину-6 (ИЛ-6) – это плейотропный цитокин, который является одним из лабораторных маркеров активности воспалительной реакции при COVID-19. Учитывая это, препараты, воздействующие на систему ИЛ-6, рядом авторов указываются как ключевые в терапии тяжелых и среднетяжелых форм коронавирусной инфекции.
В настоящее время известны результаты многочисленных сравнительных исследований, которые продемонстрировали, что применение ингибитора рецепторов ИЛ-6 - тоцилизумаба сопровождается снижением потребности в ИВЛ и лучшей выживаемостью больных с тяжелым течением COVID-19 [1-4]. В исследовании STOP-COVID [4] изучалась эффективность тоцилизумаба (3924 пациентов с COVID-19 в ОРИТ, из которых 433 получили тоцилизумаб в течение первых 2 дней после госпитализации), отмечено, что общая летальность во всех группах составила 39,3%, 28,9% в группе тоцилизумаба и 40,6% в группе сравнения. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти по сравнению с контролем. В плацебо-контролируемом исследовании EMPACTA, включившем 379 больных с тяжелым течением COVID-19, отмечено снижение риска перевода пациентов на ИВЛ или смерти на 44% по сравнению с группой плацебо. В тоже время, летальность через 28 дней существенно не отличалась между группами (10,4% и 8,6%, соответственно) [5]. Таким образом, это исследование показало, что тоцилизумаб позволяет избежать перевода на ИВЛ у определенной части больных с COVID-19, но не снижает летальность.
Таким образом, ориентируясь в первую очередь на результаты сравнительных исследований и реальную клиническую практику можно рекомендовать использование ингибитора рецепторов к ИЛ-6 тоцилизумаба при ведении пациентов со средне-тяжелым и тяжелым течением COVID-19 с целью купирования явлений «цитокинового шторма». Другим представителем данной группы является левилимаб - рекомбинантное оригинальное моноклональное антитело к a-субъединице рецептора ИЛ-6. Препарат блокирует как растворимые, так и мембранные рецепторы ИЛ-6, что позволяет купировать развитие провоспалительного каскада, препятствуя активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, избыточной продукции других провоспалительных цитокинов и острофазовых белков.
В многоцентровом двойном слепом рандомизированном исследовании CORONA была доказана эффективность и безопасность левилимаба у тяжелобольных пациентов с COVID-19, не требующих ИВЛ. По данным исследования было зафиксировано достижение клинического улучшения на 14-й день наблюдения у 63,1% пациентов с диагнозом коронавирусного поражения легких тяжелого течения, получавших левилимаб однократно подкожно в дозе 324 мг в комбинации с СТ (n=103), по сравнению с 42,7% пациентов в группе СТ и плацебо (n=103). Кроме того, у пациентов из группы левилимаба начиная с 13-го дня отметили более высокую частоту выписки из стационара, составившую 53,9% по сравнению с 39,1% в группе плацебо. При этом частота нежелательных явлений статистически значимо не различалась между группами [6].
Таким образом, использование моноклональных антител ингибиторов рецептора интерлейкина-6 рассматривается как потенциальный метод лечения и предупреждения осложнений новой коронавирусной инфекции COVID-19.
При консолидированном анализе применений левилимаба в реальной практике целого ряда учреждений разных регионов РФ у 438 пациентов со среднетяжелым и тяжелым COVID-19, которым введение препарата осуществлялось в дозе 324 мг п/к или в/в, процент выписанных пациентов варьировал от 93,8 до 100%. Выявлено, что внутривенное введение оказывает более быстрый и выраженный клинический эффект. По мере применения препарата наблюдалось снижение потребности в оксигенотерапии и переводе в ОРИТ и сокращение длительности госпитализации при раннем введении вне зависимости от степени поражения легких. Продемонстрирован благоприятный профиль безопасности левилимаба в/в и п/к. Для пациентов, у которых имеются ограничения по применению ГКС, важны выводы, что монотерапия левилимабом по эффективности сопоставима с комбинацией левилимаб + ГКС, но имеет лучшую переносимость и безопасность. Отмечено, что при раннем применении левилимаба у пациентов с КТ 1-3, получивших терапию в первые 2-е суток госпитализации наблюдалось снижение риска неблагоприятного исхода (перевод в ОРИТ/летальный исход/поздняя выписка из стационара) более чем на 80% [7]. Таким образом, в актуальные схемы патогенетической терапии коронавирусной инфекции у пациентов, госпитализированных со среднетяжелым течением COVID-19 и имеющих факторы риска тяжелого течения, при наличии патологических изменений в легких по результатам КТ возможно включение блокатора рецептора ИЛ-6 [7-8].
Рекомендации:
Госпитализированным пациентам со среднетяжелой и тяжелой инфекцией СOVID-19, с признаками дыхательной недостаточности требующей оксигенотерапии и/или иных методов респираторной поддержки в дополнение к противовоспалительной терапии (ГКС), рекомендуется введение ингибитора рецепторов к ИЛ-6 – левилимаба или тоцилизумаба.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Госпитализированным пациентам со среднетяжелой инфекцией СOVID-19, с лихорадкой выше 38°С более 5 суток, в случае наличия факторов риска прогрессирующего течения, уровнем С-реактивного белка более 30 мг/л, и/или уровнем ИЛ-6 более 30 пк/мл рекомендуется введение ингибитора рецепторов к ИЛ-6 –левилимаба.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Литература
- Guaraldi G, Meschiari M, Cozzi-Lepri A, et al. Tocilizumab in patients with severe COVID- 19: a retrospective cohort Lancet Rheumatol 2020;2: e474–8.
- Menzella F, Fontana M, Salvarani C, et al. Efficacy of tocilizumab in patients with COVID-19 ARDS undergoing noninvasive Crit Care 2020;24: 589.
- Potere N, Di Nisio M, Cibelli D, et al Interleukin-6 receptor blockade with sub- cutaneous tocilizumab in severe COVID-19 pneumonia and hyperinflammation: a case–control study Ann Rheum Dis 2020; 09 July. doi: 10.1136/annrheumdis- 2020-218243.
- Gupta S, Wang W, Hayek SS, et al. Association between early treatment with tocilizumab and mortality among critically ill patients with COVID-19. JAMA Intern Med Oct 20. 2020;10.1001/jamainternmed.2020.6252.
- F Hoffman-La Roche Ltd. Roche’s phase III EMPACTA study showed Actemra/RoActemra reduced the likelihood of needing mechanical ventilation in hospitalised patients with COVID-19 associated pneumonia. Published September 18, 2020. Accessed September 19, 2020. https://roche.com/investors/upda- tes/inv-update-2020-09-18.htm.
- Lomakin NV, Bakirov BA, Protsenko DN, et al. The efficacy and safety of levilimab in severely ill COVID-19 patients not requiring mechanical ventilation: results of a multicenter randomized double-blind placebo-controlled phase III CORONA clinical study. Inflamm Res. 2021;70(10-12):1233-46. doi: 10.1007/s00011-021-01507-5
- Gorodin V.N., Moisova D.L., Zotov S.V., Vanyukov A.A., Chumakova Yu.E. Особенности упреждающеи□ противовоспалительнои□ терапии левилимабом при COVID-19. Infectious 2021; 19(3): 14–23. DOI: 10.20953/1729-9225-2021-3-14-23
- Tavlueva E.V., Ivanov I.G., Lytkina K.A., Plesovsky P.A., Bezuglaya T.V., Fridman S.R. et Применение левилимаба у пациентов с новой коронавирусной инфекцией (C0VID-19) в реальной клинической практике. Clinical pharmacology and therapy, 2021, 30 (3): 7-13. DOI 10.32756/0869-5490-2021-3-31-37.
1.9.6 Ингибиторы янус-киназ (С.Н. Авдеев)
Ингибиторы янус киназ (JAK-ингибиторы) часто используются в онкологии, чтобы попытаться контролировать быстро делящиеся раковые клетки. Точно так же JAK- ингибиторы были испытаны для лечения COVID-19 с обоснованием того, что они могут ингибировать чрезмерную активацию иммунной системы [1]. Интересно, что из ингибиторов JAK только барицитиниб и тофацитиниб продемонстрировали эффективность при лечении COVID-19. Ингибиторы янус киназ могут использоваться в терапии новой коронавирусной инфекции при легком течении при наличии факторов риска, среднетяжелом течении, а также доказана их эффективность при тяжелом течении COVID-19, в том числе у пациентов, требующих проведения ИВЛ и ЭКМО. Сроки использования 10-14 дней.
В исследовании ACTT-2 было показано, что барицитиниб с ремдесивиром увеличивает скорость выздоровления на 1 день (7 дней по сравнению с 8 днями) по сравнению с одним ремдесивиром [2]; исследование также показало небольшое улучшение результатов в целом на 15-й день, хотя оно не было статистически значимым.
Последующее исследование COV-BARRIER также установило пользу барицитиниба при использовании в сочетании со стандартной терапией, особенно кортикостероидами.
Исследование COV-BARRIER показало, что, хотя барицитиб не влиял на общее прогрессирование заболевания, определяемое как увеличение потребности в кислородотерапии и ИВЛ, он снижало смертность от всех причин на 28-й день [3]. Основным ограничением применения барицитиниба является нарушение функции почек, и его явно не рекомендуется использовать у пациентов с СКФ < 15. Рекомендуемая дозировка основана на почечном клиренсе (4 мг в день для пациентов с СКФ > 60, 2 мг в день для пациентов с СКФ 30–60, 1 мг в день при СКФ 15–30), а продолжительность лечения – до 14 дней или до выписки из стационара. Наиболее вероятно, что барицитиниб принесет пользу пациентам с потребностью в кислородотерапии, НИВЛ или ВПО [3].
В РКИ, проведенном в 15 центрах Бразилии и включавшем 289 госпитализированных пациентов с пневмонией COVID-19, тофацитиниб приводил к более низкому риску смерти или дыхательной недостаточности в течение 28 дней, чем плацебо [4].
Рекомендации:
Госпитализированным пациентам с инфекцией СOVID-19, в дополнение к этиотропной и противовоспалительной терапии (ГКС), рекомендуется назначение терапии барицитинибом в течение 10-14 дней.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Литература
- Stebbing J, Phelan A, Griffin I, Tucker C, Oechsle O, Smith D, Richardson P. COVID-19: Combining antiviral and anti-inflammatory Lancet Infect Dis 2020; 20: 400–402.
- Kalil AC, Patterson TF, Mehta AK, Tomashek KM, Wolfe CR, Ghazaryan V, Marconi VC, Ruiz-Palacios GM, Hsieh L, Kline S, et al. Baricitinib plus Remdesivir for Hospitalized Adults with Covid-19. N Engl J Med 2021; 384: 795–807.
- Marconi VC, Ramanan AV, de Bono S, Kartman CE, Krishnan V, Liao R, Piruzeli MLB, Goldman JD, Alatorre-Alexander J, de Cassia Pellegrini R, et al. Efficacy and safety of baricitinib for the treatment of hospitalised adults with COVID-19 (COV-BARRIER): A randomised, double-blind, parallel-group, placebo-controlled phase 3 trial. Lancet Respir Med 2021; 9: 1407–1418.
- Guimarães PO, Quirk D, Furtado RH, Maia LN, Saraiva JF, Antunes MO, Kalil Filho R, Junior VM, Soeiro AM, Tognon AP, Veiga VC, Martins PA, Moia DDF, Sampaio BS, Assis SRL, Soares RVP, Piano LPA, Castilho K, Momesso RGRAP, Monfardini F, Guimarães HP, Ponce de Leon D, Dulcine M, Pinheiro MRT, Gunay LM, Deuring JJ, Rizzo LV, Koncz T, Berwanger O; STOP-COVID Trial Investigators. Tofacitinib in Patients Hospitalized with Covid-19 Pneumonia. N Engl J Med. 2021 Jul 29;385(5):406-415. doi: 1056/NEJMoa2101643.
1.9.7 Использование антибиотиков при COVID-19 (С.А. Рачина, А.И. Синопальников)
Бактериальные коинфекции не характерны для COVID-19. Частота обнаружения бактериальных возбудителей среди госпитализированных взрослых с COVID-19 в первые 48 ч с момента поступления в стационар не превышает 4-7% (чаще регистрируются среди пациентов, нуждающихся в госпитализации в ОРИТ) [1,2]. Соответственно, рутинное назначение антибиотиков (АБ) пациентам с инфекцией SARS-CoV-2 не показано.
Структура бактериальных возбудителей при коинфекции, видимо, не отличается от таковой в случае «обычной» внебольничной пневмонии [1-4]. Однако этот вопрос требует дополнительного изучения, т.к. в опубликованных исследованиях и метаанализах использовались разные методы идентификации возбудителей и не всегда четко разграничивались случаи коинфекции и суперинфекции1 [5].
Частота суперинфекций представляет существенно более серьезную проблему среди больных COVID-19 в стационаре. По данным исследований доля пациентов с бактериальными нозокомиальными инфекциями (НИ) варьируется от 5 до 21%, а в ОРИТ может превышать 40% [3, 6-9].
В структуре НИ у госпитализированных больных COVID-19 превалируют инфекции кровотока и пневмонии [7,8]. COVID-19 является фактором риска развития ИВЛ- ассоциированной пневмонии, что, вероятно, может быть связано как с особенностями самого вируса, так и широким использованием в лечении глюкокортикостероидов (ГКС) и иммунобиологических препаратов [10].
Высокий риск развития бактериальных НИ при COVID-19 в стационаре, особенно среди больных ОРИТ, определяет необходимость клинической настороженности и дополнительных обследований для ее верификации.
Необходимо отметить, что диагностика НИ при COVID-19 представляет сложности, так как новые инфильтративные изменения плохо визуализируются при КТ ОГК у больных с ОРДС и распространенным поражением легких, лейкоцитоз, нейтрофилез могут быть отражением хорошо известного эффекта системных ГКС, применение дексаметазона и/или антагонистов ИЛ-6 ассоциируется со значительным снижением СРБ и ПКТ и/или отсутствием их прироста в ответ на бактериальную суперинфекцию, что значительно снижает их диагностическую ценность [11,12].
Спектр бактериальных возбудителей и профиль их чувствительности к АБ при НИ, развивающихся у больных COVID-19, соответствует профилю ранее циркулировавших в конкретном стационаре/отделении возбудителей с типичными механизмами антибиотикорезистентности [9,13,14].
Рекомендации:
При верифицированной инфекции СOVID-19 и отсутствии маркеров бактериальной коинфекции/верифицированной коинфекции рутинное назначение АБ не рекомендуется независимо от тяжести течения заболевания.
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
В случае выявления бактериальной коинфекции при COVID-19 выбор препаратов и тактика антибактериальной терапии (АБТ) должна соответствовать утвержденным национальным клиническим рекомендациям по внебольничной пневмонии у взрослых [15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Универсальных правил диагностики бактериальной суперинфекции у больных COVID-19 не разработано, при подозрении на НИ рекомендуется проводить комплексную оценку состояния больного и результатов лабораторных и инструментальных тестов; вероятность НИ возрастает при необъяснимом прогрессировании дыхательной недостаточности и/или появлении маркеров бактериальной инфекции и/или “свежих” инфильтратов на КТ ОГК (см. раздел бактериальные коинфекции).
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
При развитии бактериальной НИ у больных COVID-19 рекомендуется как можно более ранее начало эмпирической АБТ и пересмотр патогенетической терапии со снижением дозы или полной отменой системных ГКС
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Выбор АБ для эмпирической терапии верифицированной бактериальной НИ должен быть основан на локальных данных мониторинга структуры возбудителей НИ и распространенных механизмов антибиотикорезистентности, а при их отсутствии опираться на национальные клинические и методические рекомендации лечения инфекций, вызванных поли и экстремально резистентными возбудителями и доступные системы мониторинга [16,17,18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
При установлении этиологии НИ целесообразен как можно более ранний переход от эмпирической к этиотропной АБТ согласно общеизвестным принципам с целью повышения эффективности, безопасности и снижения негативных популяционных последствий избыточной антибиотикотерапии [16,17,18].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Литература
- Langford BJ, So M, Raybardhan S, et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol Infect. 2020;26(12):1622-1629.
- Lansbury L, Lim B, Baskaran V, Lim WS. Co-infections in people with COVID-19: a systematic review and meta-analysis. J Infect. 2020;81(2):266-275.
- Garcia-Vidal C., Sanjuan G., Moreno-Garcia E., et al. Incidence of co-infections and superinfections in hospitalized patients with COVID-19: a retrospective cohort study. Clin Microbiol 2021; 27 (1): 83-88.
- Bolker A., Coe K., Smith J., et al. Predictors of respiratory bacterial co-infection in hospitalized COVID-19 Diagn Microbiol Infect Dis. 2022; 102(1): 115558.
- Pakzad R., Malekifar P., Shateri Z., et al. Worldwide prevalence of microbial agents' coinfection among COVID-19 patients: A comprehensive updated systematic review and meta- J Clin Lab Anal. 2022;36(1):e24151.
- Pickens C.O., Gao C.A., Cuttica M.J., et al. Bacterial Superinfection Pneumonia in Patients Mechanically Ventilated for COVID-19 Pneumonia Am J Respir Crit Care Med. 2021; 204(8): 921-932.
- Pipa M., Galli L., Poli A., et al. Secondary infections in patients hospitalized with COVID-19: incidence and predictive Clin Microbiol Infect. 2021; 27(3): 451-457.
- Bardi T., Pintado V., Gomez-Rojo M., et al. Nosocomial infections associated to COVID-19 in the intensive care unit: clinical characteristics and outcome. Eur J Clin Microbiol Infect Dis. 2021;40(3):495-502.
- Карноух К.И., и соавт. Карноух К.И., Дроздов В.Н., Савинцева Д.Д., и соавт. Этиология и антибиотикорезистентность возбудителей вторичных бактериальных инфекций у пациентов, госпитализированных с COVID-19 в стационар Москвы. Клин микробиол антимикроб химиотер 2021; 23 (Прил 1): 18-19.
- Llitjos J.-F., Bredin S., Lascarrou J.B., et al. Increased susceptibility to intensive care unit- acquired pneumonia in severe COVID-19 patients: a multicentre retrospective cohort study. Ann Intensive Care 2021; 11(1):20.
- Naranje P., Bhalla A.S., Jana M., et al. Imaging of Pulmonary Superinfections and Co- Infections in COVID-19. Curr Probl Diagn 2021; S0363-0188(21)00162-6.
- Kooistra E.J., van Berkel M., van Kempen N.F., et al. Dexamethasone and tocilizumab treatment considerably reduces the value of C-reactive protein and procalcitonin to detect secondary bacterial infections in COVID-19 patients. Crit Care. 2021; 25:
- Maes M., Higginson E, Pereira-Dias J, et al. Ventilator-associated pneumonia in critically ill patients with COVID-19. Crit Care. 2021; 25 (1):25.
- Стрелкова Д.А., Рачина С.А., Бурмистрова Е.Н., и соавт. Бактериемии у пациентов с COVID-19, проходящих лечение в ОРИТ. Клин микробиол антимикроб химиотер 2022; 24 (Прил 1):
- Клинические рекомендации «Внебольничная пневмония у взрослых», 2021г. Доступно на сайте: https://minzdrav.midural.ru/uploads/clin_recomend%20РФ.pdf?ysclid=l4pwdev7fa945490772.
- Белобородов В.Б., Голощапов О.В., Гусаров В.Г., и соавт. Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов (обновление 2022 г.). Доступно на сайте: https://antimicrob.net/1231241- 2/.
- Нозокомиальная пневмония у взрослых: России□ские национальные рекомендации / Под ред. Б.Р. Гельфанда; отв. ред. Д.Н. Проценко, Б.З. Белоцерковский. - 2-е изд., перераб. и доп. - М.: ООО «Издательство «Медицинское информационное агентство», - 176 с.
- Paul M., Carrara E., Retamar P., et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug- resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clinical Microbiology and Infection. 2022; 28(4):521-547.
1.9.8 Вентиляционная поддержка (С.Н. Авдеев, С.Л. Бабак, А.Г. Малявин)
Выполненные многоцентровые исследования показали, что от 5 до 32% пациентов, госпитализированных по поводу COVID-19, нуждаются в переводе в отделения реанимации и интенсивной терапии (ОРИТ) [1,2] при развитии у них гипоксемической острой дыхательной недостаточности (ОДН). Более того, острый респираторный дистресс-синдром (ОРДС) диагностируется у 40–96% пациентов ОРИТ [3,4] и большинство из них (от 30 до 88%) будут нуждаться в инвазивной искусственной вентиляции легких (ИВЛ) [1,2]. Важно, что смертность пациентов ОРИТ, получающих ИВЛ, стабильно высока и достигает порога в 88% [5]. С учетом неблагоприятного прогноза при ИВЛ у пациентов COVID-19, в настоящее время все большее внимание уделяют методам неинвазивной респираторной поддержки (НРП), к которым относят высокопоточную кислородотерапию (ВПКТ) и неинвазивную вентиляцию легких (НВЛ).
Кислородотерапия (О2-терапия)
Основные показания к О2-терапии :
уровень SРО2 ≤92% или PAО2 ≤65 мм рт.ст.
При проведении кислородотерапии необходимо учитывать:
- необходимым условием для проведения О2-терапии является сохранение проходимости дыхательных путей;
- О2-терапия не должна использоваться вместо респираторной поддержки, если имеются очевидные показания к применению последней!;
- оптимальным считается поддержание SрO2 в диапазоне 92-96% и PaO2 в диапазоне 65- 80 мм рт.ст. (для пациентов ХОБЛ и другими хроническими респираторными заболеваниями – SрO2 в диапазоне 88-92% и PaO2 в диапазоне 55-80 мм рт. ст.) [6];
- высокие концентрации О2 во вдыхаемой смеси (инспираторная фракция О2 [FiO2] более 60%) могут быть ассоциированы с токсическими эффектами.
При мониторинге кислородотерапии необходимо выполнять [7]:
- повторный газовый анализ артериальной крови должен быть выполнен через 30-60 минут после начала О2-терапии или изменения FiO2;
- у больных с гипоксемией и высоким риском развития аритмии или ОДН должно постоянно проводиться мониторирование насыщение крови кислородом (SpO2) посредством пульсоксиметрии;
- у лиц с гиперкапнией требуется проведение анализа газов артериальной крови для определения значений PaO2 и PaСO2 и постоянное мониторирование SpO2;
- при назначении неотложной O2-терапии ежедневно должны проводиться газовый анализ артериальной крови и пульсоксиметрия с последующей коррекцией FiO2 [6,8].
Методы доставки кислорода
Все системы для доставки кислорода в дыхательные пути пациента условно можно разделить на низкопоточные (носовые канюли, носовые катетеры, простые маски) и высокопоточные системы (маски Вентури и маски с резервуаром, или маски без возвратного дыхания) [6,8]. Оба типа доставки способны обеспечить различные значения FiО2; термины «низко-» и «высокопоточные системы» отражают не величину FiО2, а объем потока О2-воздушной смеси, проходящего через систему.
Носовые канюли – удобны, хорошо переносятся большинством больных. Примерное значение FiO2 при использовании носовых канюль высчитывается по формуле: FiO2 = 20% + 4× поток О2.
Простая маска обычно имеет объем мертвого пространства от 40 до 100 мл. Для обеспечения «вымывания» СО2 рекомендуется устанавливать минимальный поток О2 более 5 л/мин. Достоинством маски Вентури является способность обеспечивать достаточно точные значения FiO2, не зависящие от минутной вентиляции и инспираторного потока больного. Маска Вентури признана наиболее безопасным и эффективным способом доставки О2 в дыхательные пути у больных с риском О2- индуцированной гиперкапнии]. Маска с резервуаром (маска без возвратного дыхания) создает более высокие концентрации О2 – в среднем, 60–70%. Обычно используют поток О2 более 10–15 л/мин, т.е. поток О2 должен превышать мунитную вентиляцию больного и резервуар маски всегда должен быть наполнен перед вдохом пациента.
Выбор системы доставки [9,10]:
- у пациентов с гипоксемией без гиперкапнии O2-терапию проводят при помощи масок (начальный поток О2 5-6 л/мин);
- необходимо увеличивать поток (FiО2) до уровня SpO2 в диапазоне 92-96% (для пациентов ХОБЛ и другими хроническими заболеваниями легких – 88-92%);
- при выраженной гипоксемии (SpO2 < 75% на воздухе) рекомендовано начинать O2- терапию с помощью маски с резервуаром (начальный поток О2 – 10 л/мин (резервуар должен быть в наполненном состоянии!);
- у пациентов с гипоксемией и гиперкапнией O2-терапию следует начинать с низких концентраций O2 при помощи носовых канюль (поток 1-4 л/мин) или маски Вентури (FiO2 24 или 28%).
Неинвазивная вентиляция легких
НВЛ является методом респираторной поддержки, при котором основной интерфейс – маска или шлем − может быть легко наложен и также легко отсоединен от дыхательных путей пациента [11]. НВЛ обладает значимыми достоинствами перед традиционной ИВЛ
- не требуется наложения искусственных дыхательных путей (интубационная трубка, трахеостомы), что существенно снижает риск развития прямых повреждений дыхательных путей и нозокомиальных инфекций [11,12].
К настоящему времени опубликовано более 50 исследований, посвященных эффективности НВЛ при гипоксемической ОДН у пациентов с COVID-19 [13-15], подавляющее большинство исследований – открытые, наблюдательные (обзервационные), и лишь несколько – рандомизированные контролируемые исследования (РКИ) [16]. Во все приведенные исследования были включены пациенты с COVID-19 с тяжелой гипоксемической ОДН, которые соответствовали тяжелому или среднетяжелому ОРДС по Берлинской классификации: средние исходные значения соотношения PaO2/FiO2 варьировали от 75 до 200 мм рт. ст., то есть согласно классическим канонам, данные пациенты имели показания для проведения ИВЛ [17]. Об эффективности НВЛ при гипоксемической ОДН у пациентов с COVID-19, позволяют судить данные о доле интубированных и умерших пациентов. Безусловно, представленные результаты довольно неоднородны – летальность пациентов варьировала от 0% до 74%, а потребность в интубации трахеи – от 22% до 38% [17]. В целом, в большинстве исследований потребность в интубации трахеи и показатели госпитальной летальности, в среднем, составили 20-30%, что позволяет говорить о достаточно высокой эффективности НВЛ при ОДН у пациентов с COVID-19 [17].
НВЛ показана при неэффективности низкопоточной и высокопоточной оксигенотерапии (если ее применяли).
Применение НВЛ рекомендовано только при следующих условиях:
- сохранность сознания, стабильная гемодинамика;
- возможность сотрудничать с персоналом;
- отсутствие клаустрофобии (при применении шлемов);
- сохранность механизма откашливания мокроты.
НВЛ не рекомендуется при:
- отсутствии самостоятельного дыхания (апноэ);
- нестабильной гемодинамике (гипотензия, ишемия или инфаркт миокарда, жизнеугрожающая аритмия, неконтролируемая артериальная гипертензия);
- невозможности обеспечить защиту дыхательных путей (нарушение кашля и глотания) и высокий риск аспирации;
- избыточной бронхиальной секреции;
- признаках нарушения сознания (возбуждение или угнетение сознания), неспособности пациента к сотрудничеству;
- травме или ожоге лица, анатомических дефектах, препятствующих установке маски;
- неспособности пациента убрать маску с лица в случае рвоты;
- активном кровотечении из желудочно-кишечного тракта;
- обструкции верхних дыхательных путей;
- дискомфорте от маски.
НВЛ можно проводить как специальными аппаратами для неинвазивной ИВЛ (включая аппараты для домашней НИВЛ), так и универсальными аппаратами ИВЛ с режимом НИВЛ. Следует отметить, что эффективность использования специализированных аппаратов НВЛ выше.
Для НВЛ могут быть использованы специальные маски для НВЛ (ороназальные и полнолицевые), а также шлемы (для СРАР и для ИВЛ, в зависимости от выбранного режима и типа контура аппарата).
При использовании ороназальных и полнолицевых масок НВЛ следует обратить внимание на следующие моменты:
- если применен аппарат ИВЛ с двухшланговым контуром и наличием клапана выдоха (стандартный аппарат ИВЛ), то следует использовать невентилируемые маски (без утечки в «колене» маски);
- если применен специализированный аппарат для НВЛ с одношланговым контуром, то при наличии порта выдоха в контуре используют маски с невентилируемым «коленом», а при отсутствии такого порта - маски с вентилируемым «коленом»;
- оптимальная утечка составляет около 30 л/мин, при снижении утечки до менее 7 л/мин следует ослабить маску, при утечке 30-60 л/мин - плотно прикрепить маску, при утечке более 60 л/мин – сменить маску;
- следует подбирать оптимальный размер маски в соответствии с размером лица пациента, большинству взрослых пациентов подойдут маски размера М;
- при развитии пролежней от маски следует сменить маску на другой тип (ротация маски), например, ороназальную на полнолицевую, для профилактики пролежней рекомендовано использовать ротацию масок и специальные гелевые адгезивные пластыри (протекторы).
- при использовании шлемов для НВЛ следует обращать внимание на соответствие между типом шлема, типом контура, выбранным режимом ИВЛ и типом аппарата ИВЛ.
Стартовым режимом НВЛ является СРАР 8-10 см вод.ст. и инспираторной фракцией кислорода 0,6. При сохранении на этом фоне выраженной работы дыхательных мышц шеи следует переключить аппарат на режим с поддержкой давлением (S, S/T, Pressure Support, BIPAP) с уровнем давления IPAP 14-22 см вод.ст., подбирая минимальное инспираторное давление, при котором сохраняется комфорт пациента и нет видимой работы дыхания пациента. Уровень FiO2 следует подбирать на основе целевого значения оксигенации.
Более поздние ретроспективные когортные исследования, в которых использовалась многовариантная поправка на риск, показали, что НВЛ безопасна [18] и потенциально превосходит стратегию ранней интубации [19-20]. Поскольку пороги для интубации и клинического наблюдения за течением болезни не были стандартизированы априори, трудно сделать однозначные выводы из этих обсервационных исследований.
Высокопоточная кислородотерапия через назальные канюли (HFNC)
Терапия HFNC относится к доставке увлажненного и подогретого кислорода с высокой скоростью, обычно 20-60 л/мин, которая титруется до точной доли вдыхаемого кислорода (FiO2). Преимущества доставки кислорода таким образом включают улучшенный комфорт за счет удовлетворения потребности пациента в потоке [21], создание кислородного резервуара в верхних дыхательных путях, тем самым уменьшая физиологическое мертвое пространство (уменьшение повторного вдыхания CO2) [22], и обеспечение умеренного РЕЕР, которое может помочь рекрутировать спавшиеся альвеолы [23] с последующее снижение работы дыхания.
Недавние мета-анализы показывают, что применение HFNC при острой гипоксической дыхательной недостаточности может снизить риск интубации и инвазивной ИВЛ на 15% по сравнению с традиционной оксигенотерапией, не влияя на смертность [24]. Однако использование HFNC требует тщательного наблюдения за признаками надвигающейся дыхательной недостаточности. Roca et al. разработали и валидизировали индекс ROX (отношение насыщения кислородом/FiO2 к частоте дыхания) в качестве прикроватного инструмента для прогнозирования неуспеха HFNC в условиях пневмонии и гипоксемической ОДН [25]. Соответственно, пациенты с индексом ROX ≥ 4,88 через 2, 6 и 12 часов лечения имели низкий риск интубации, тогда как ROX-индекс <3,85 в эти же временные точки ассоциировался с высоким риском неудачи. Откладывание интубации до возникновения явной десатурации, гипотензии, частоты дыхания >35 вдохов/мин с респираторным дистресс-синдромом или ацидоза было связано с неблагоприятными клиническими исходами [26].
Доказательства использования HFNC при пневмонии, вызванной COVID-19, состоят из отчетов о случаях и серий случаев [27-29]. Они свидетельствуют о возможности использования HFNC в этих условиях; однако твердые выводы относительно эффективности сделать трудно из-за отсутствия контрольных групп. У пациентов в этих сериях была ОДН с PaO2/FiO2 в диапазоне от 68 до 209 мм рт.ст. Средняя продолжительность HFNC составляла от трех до шести дней; однако пациенты, нуждавшиеся в усилении помощи, сделали это раньше в ходе лечения. HFNC был связан с успешными результатами (т. е. без эскалации помощи) в 34-70% случаев. Индекс ROX, определенный через 4-6 часов лечения, предсказывал эскалацию помощи [27]. Пациенты с PaO2/FiO2 >200 мм рт.ст. до начала HFNC и у которых было снижение частоты дыхания в течение первых нескольких часов, имели наилучшие результаты [30].
HFNC не приводит к повышенному риску образованию вирус-содержащих аэрозолей [31] а распространение аэрозолей можно ограничить, если пациенты использовать медицинские маски поверх канули [32].
Инвазивная искусственная вентиляция легких
Инвазивная ИВЛ при терапии COVID-19-ассоциированной ОДН применяется в случае неэффективности неинвазивной ИВЛ или недоступности последней.
Показания для интубации трахеи (достаточно одного критерия):
- гипоксемия (SpO2 <92%), несмотря на высокопоточную оксигенотерапию или НИВЛ в положении лежа на животе с FiO2 100%;
- усталость пациента на фоне HFNC или НВЛ в прон-позиции с FiO2 1,0;
- нарастание видимых экскурсий грудной клетки и/или участие вспомогательных дыхательных мышц, несмотря на HFNC или НВЛ в положении лежа на животе с FiO2 1,0;
- угнетение сознания или возбуждение;
- остановка дыхания;
- нестабильная гемодинамика.
ИВЛ направлена не только на обеспечение адекватного газообмена, стабилизацию коллабированных альвеол, но и минимизацию потенциального индуцированного пациентом или ятрогенного повреждения легких. В случае применения инвазивной ИВЛ при неэффективности неинвазивной ИВЛ следует иметь в ввиду, что в большинстве случаев применение вспомогательных режимов ИВЛ на фоне ясного сознания или умеренной седации после интубации трахеи может усиливать повреждение лёгких, поэтому в первые несколько часов после интубации трахеи следует использовать полностью управляемые режимы ИВЛ на фоне глубокой седации и/или миоплегии.
При ИВЛ у пациентов с COVID-19 рекомендован дыхательный объем 6 мл/кг идеальной массы тела. Применение дыхательного объёма более 6 мл/кг ИМТ ведет к росту осложнений и летальности.
Проведение «безопасной» ИВЛ возможно в режимах как с управляемым давлением (PC), так и с управляемым объемом (VC). При этом в последних желательно использовать нисходящую форму инспираторного потока, обеспечивающую лучшее распределение газа в легких и меньшее давление в дыхательных путях.
У пациентов с PaO2/FiO2 выше 150 мм рт.ст. при реверсии миоплегии рекомендовано, при технической возможности и отсутствии патологических ритмов дыхания, перейти на полностью вспомогательный режим вентиляции (в большинстве аппаратов – PSV) для улучшения распределения газа, профилактики ателектазирования и атрофии диафрагмы. У пациентов с COVID-19 при проведении ИВЛ рекомендовано использовать РЕЕР в зависимости от рекрутабельности альвеол и риска образования ателектазов. У пациентов с COVID-19 отмечена невысокая рекрутабельность альвеол, стартовая величина эффективного и безопасного РЕЕР составляет 8-10 см вод.ст.
Для оценки рекрутабельности рекомендовано оценивать разницу между давлением плато и РЕЕР («движущее давление») или статическую податливость респираторной системы: уменьшение величины «движущего давления» в ответ на увеличение РЕЕР свидетельствует о рекрутировании коллабированных альвеол, а увеличение его – о перераздувании уже открытых альвеол.
Первые исследования сообщали о высоких показателях смертности среди пациентов, получавших ИВЛ по поводу пневмонии, вызванной COVID-19, но эти исследования были проведены в стационарах, которые были переполнены пациентами с COVID-19 [5]. В последующих более крупных и полных сериях сообщалось о показателях смертности, соответствующих классическому ОРДС, при соблюдении основных принципов ведения ОРДС [33,34]. По сравнению с наблюдениями в исследовании LUNG SAFE, продолжительность ИВЛ в серии случаев COVID-19-ОРДС может быть немного больше [33,34] с более высокими показателями использования миорелаксантов и положения лежа на животе [33,34].
Проспективное исследование, сравнивавщее последовательных пациентов с типичным ОРДС и COVID-19-ОРДС, подтвердило аналогичную механику дыхательной системы и продемонстрировало высокую способность к рекрутированию (отношение R/I > 0,5) как у пациентов с COVID-19-ОРДС (73%), так и у пациентов с классическим ОРДС (57%) [35]. Отношение R/I обратно коррелировало с реакцией PaCO2 на титрование PEEP, предполагая гиперинфляцию и увеличение мертвого пространства, когда рекрутируемость была низкой. Исследование 301 пациента с COVID-19-ОРДС выявило сходную механику дыхательной системы и массу легких, определенные с помощью компьютерной томографии, по сравнению с ретроспективной когортой пациентов с классическим ОРДС [36]. Исследователи определили, что у лиц с более низкой растяжимостью дыхательной системы (<41 мл/см H2O) и высоким уровнем D-димера смертность была выше по сравнению с другими подгруппами. Вентиляционное отношение (произведение дыхательного объема, частоты дыхания и PaCO2, индексированное по прогнозируемой массе тела), которое является маркером мертвого пространства, также коррелирует с уровнями D-димера, вызывая подозрение на внутрисосудистый тромбоз легких [36].
Спорным вопросом тактики ИВЛ является то, когда интубировать пациентов с COVID-19- ОРДС. В двух ретроспективных когортных исследованиях пациентов с COVID-19 были сделаны разные выводы: в одном из них предпочтение отдавалось более ранней интубации [37], а в другом не было обнаружено связи смертности со временем до интубации или использованием HFNC [38].
Прональная позиция у неинтубированных пациентов
До пандемии COVID-19 с момента первого описания в 1970-х годах [39], прональная позиция (положение лежа на животе) использовалось только при тяжелой гипоксемической ОДН, требующей ИВЛ. Предлагаемые механизмы улучшения оксигенации включают лучшее V/Q соответствие [40], перераспределение кровотока, изменения объемов легких и комплайенса грудной стенки [40].
Пандемия COVID-19 дала мощный толчок к повсеместному широкому использованию прональной позиции у неинтубированных пациентов с ОДН на фоне COVID-19. Согласно данным международный опроса (проведен в 40 странах, участвовали 502 респондента), прональная позиция у неинтубированных пациентов с ОДН на фоне COVID-19 использовалась в 46,2% центров [41].
Сегодня известно, что прональная позиция может эффективно улучшить оксигенацию и снизить инспираторное усилие у неинтубированных пациентов с ОДН без каких-либо дополнительных ресурсов. В проспективное, априорно спланированное мета- исследование 6 открытых РКИ были включены 1126 пациентов с гипоксемической ОДН на фоне COVID-19, которым потребовалась респираторная поддержка с помощью ВПКТ, были случайным образом распределены на 2 группы: положение в положении лежа на животе или стандартный уход [42]. Неэффективность лечения наблюдалась у 223 (40%) из 564 пациентов, которым было назначено положение лежа на животе в бодрствующем состоянии, и у 257 (46%) из 557 пациентов, которым было назначено стандартное лечение (ОР 0,86 [95%ДИ 0,75–0,98]). Таким образом, самое масштабное на сегодня исследование продемонстрировало, что у пациентов с гипоксемической ОДН вследствие COVID-19 положении лежа на животе снижает частоту неудач лечения и потребность в интубации.
Проблемой прональной позиции является то, что прональная позиция эффективна не во всех случаях, а также очень сложно предсказать ее стойкий эффект на оксигенацию.
Изменение аэрации легких по данным УЗИ легких во время прональной позиции позволяет предсказать такой ответ [43,44]. Таким образом, у пациентов с тяжелым течением COVID-19 ответ на прональную позицию, вероятно, зависит от степени и локализации изменений легочной ткани.
Пока нет единого мнения о выборе подходящего пациента для прональной позиции. В большинстве исследований позиционирование в состоянии бодрствования применялось к пациентам с гипоксической ОДН от легкой до умеренной степени тяжести. Пациенты, которым требовалась срочная интубация, или пациенты с измененным психическим статусом, гемодинамической нестабильностью, травмой или внутрибрюшной гипертензией не соответствовали критериям для применения прональной позиции [45].
Точно так же нет единого мнения о нужной продолжительности и частоте сеансов процедуры. Продолжительность прональной позиции для каждого сеанса варьировала от <1 часа [46] до > 18 часов [47], и сеансы прональной позиции применялись повторно в течение дня.
Рекомендации:
У пациентов с ОРДС оптимальным считается поддержание SрO2 в диапазоне 92-96% и PaO2 в диапазоне 65-80 мм рт.ст. (для пациентов ХОБЛ и другими хроническими респираторными заболеваниями – SрO2 в диапазоне 88-92% и PaO2 в диапазоне 55-80 мм рт. ст.).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
У пациентов с ОРДС рекомендовано использовать пошаговый подход в выборе методов респираторной терапии для улучшения результатов лечения: при ОРДС легкой степени возможно использование высокопоточной оксигенации (ВПО) и неинвазивной ИВЛ (НИВЛ), при ОРДС средней и тяжелой степени показана интубация трахеи и инвазивная ИВЛ (схема 1).
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
У пациентов при ОРДС лёгкой степени тяжести возможно применение НВЛ в качестве терапии первой линии; не рекомендовано задерживать интубацию трахеи при неэффективности НВЛ, так как это приводит к увеличению летальности.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Литература
- Grasselli G, Zangrillo A, Zanella A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy Region, Italy. JAMA 2020; 323: https:// doi. org/ 10. 1001/jama. 2020. 5394
- Grasselli G, Greco M, Zanella A, et al. Risk factors associated with mortality among patients with COVID-19 in Intensive Care Units in Lombardy, Italy. JAMA Intern Med 2020; 180: 1345–1355. https:// doi. org/ 1001/jamai ntern med. 2020. 3539
- Guan W, Ni Z, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 2020; 382: 1708–1720. https:// doi. org/ 1056/ NEJMo a2002 032
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395: 497–506. https:// doi. org/ 10. 1016/ S0140- 6736(20) 30183-5
- Richardson S, Hirsch JS, Narasimhan M, et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA 2020: https:// doi. org/ 1001/ jama. 2020. 6775
- Siemieniuk RAC, Cu DK, Kim LH, et al. Oxygen therapy for acutely ill medical patients: a clinical practice BMJ 2018; 363: k4169. DOI: 10.1136/bmj.k4169.
- Schacter EN, Littner MR, Luddy P, et al. Monitoring of oxygen delivery systems in clinical Crit Care Med 1980; 8: 405-409.
- O′Driscoll BR, Howard LS, Earis J, et al. BTS guideline for oxygen use in adults in healthcare and emergency settings. Thorax 2017; 72(Suppl 1): ii1-ii90.
- Авдеев С.Н. Ургентная кислородотерапия. Вестник анестезиологии и реаниматологии 2011; №3: 42-51.
- Авдеев С.Н. Современные рекомендации по неотложной кислородотерапии. Терапевтический архив 2012; 84(№12): 108-114.
- Rochwerg B, Brochard L, Elliott MW, Hess D, Hill NS et al Official ERS/ATS Clinical Practice Guidelines: Noninvasive ventilation for acute respiratory failure. Eur Respir J 2017 Aug 31; 50: doi: 10.1183/13993003.02426-2016.
- Авдеев С.Н. Неинвазивная вентиляция легких при острой дыхательной недостаточности: от клинических рекомендаций – к реальной клинической практике. Пульмонология 2018; 28(1): 32-35. DOI:10.18093/0869-0189-2018-28-1-32-35
- Avdeev S, Yaroshetskiy A, Tsareva N, Merzhoeva Z, Trushenko N, Nekludova G, Chikina
- Noninvasive ventilation for acute hypoxemic respiratory failure in patients with COVID-19. Amer J Emerg Med 2021; 39: 154–157. DOI: https://doi.org/10.1016/j.ajem.2020.09.075.
- Vaschetto R, Barone-Adesi F, Racca F, Pissaia C, et al. Outcomes of COVID-19 patients treated with continuous positive airway pressure outside ICU. ERJ Open Res 2021; 7(1): 00541- doi: 10.1183/23120541.00541-2020.
- Bellani G, Grasselli G, Cecconi M, Antolini L, Borelli M, et al. Noninvasive Ventilatory Support of COVID-19 Patients Outside the Intensive Care Units. Ann Am Thorac Soc 2021; 18: 1020-1026. doi: 10.1513/AnnalsATS.202008-1080OC.
- Grieco DL, Menga LS, Cesarano M, Rosa` T, Spadaro S, Bitondo MM, et Effect of helmet noninvasive ventilation vs high-flow nasal oxygen on days free of respiratory support in patients with COVID-19 and moderate to severe hypoxemic respiratory failure: the HENIVOT randomized clinical trial. JAMA 2021;325(17):1731–43. https://doi.org/10.1001/jama.2021.4682
- Авдеев С.Н., Царева Н.А., Мержоева З.М., Трушенко Н.В., Ярошецкий А.И. Практические рекомендации по кислородотерапии и респираторной поддержке пациентов с COVID-19 на дореанимационном этапе. Пульмонология 2020; 30(2): 151–163. DOI: 18093/0869-0189-2020-30-2-151-163
- Potalivo A, Montomoli J, Facondini F, et al. Sixty-day mortality among 520 Italian hospitalized COVID-19 patients according to the adopted ventilatory strategy in the context of an integrated multidisciplinary clinical organization: a population-based cohort study. Clin Epidemiol 2020; 12: 1421-31.
- Dupuis C, Bouadma L, de Montmollin E, et al. Association between early invasive mechanical ventilation and day-60 mortality in acute hypoxemic respiratory failure related to coronavirus disease-2019 pneumonia. Crit Care Explor 2021;3:e0329.
- Daniel P, Mecklenburg M, Massiah C, et al. Non-invasive positive pressure ventilation versus endotracheal intubation in treatment of COVID-19 patients requiring ventilatory support. Am J Emerg Med 2021; 43: 103-8.
- Spoletini G, Alotaibi M, Blasi F, Hill NS. Heated humidified highflow nasal oxygen in adults: mechanisms of action and clinical implications. Chest 2015; 148: 253-61. doi:10.1378/chest.14-2871
- Moller W, Feng S, Domanski U, et al. Nasal high flow reduces dead space. J Appl Physiol (1985) 2017; 122: 191-7. doi:10.1152/japplphysiol.00584.2016
- Parke RL, McGuinness SP. Pressures delivered by nasal high flow oxygen during all phases of the respiratory Respir Care 2013; 58: 1621-4. doi:10.4187/respcare.02358
- Rochwerg B, Granton D, Wang DX, et al. High flow nasal cannula compared with conventional oxygen therapy for acute hypoxemic respiratory failure: a systematic review and meta-analysis. Intensive Care Med 2019; 45: 563-72. doi:10.1007/s00134-019-05658-2
- Roca O, Caralt B, Messika J, et al. An index combining respiratory rate and oxygenation to predict outcome of nasal high-flow therapy. Am J Respir Crit Care Med 2019; 199: 1368-76. doi:10.1164/rccm.201803-0589OC
- Kang BJ, Koh Y, Lim C-M, et al. Failure of high-flow nasal cannula therapy may delay intubation and increase mortality. Intensive Care Med 2015; 41: 623-32. doi:10.1007/s00134- 015-3693-5
- Calligaro GL, Lalla U, Audley G, et al. The utility of high-flow nasal oxygen for severe COVID-19 pneumonia in a resource constrained setting: A multi-centre prospective observational EClinicalMedicine 2020; 28: 100570. doi:10.1016/j.eclinm.2020.100570
- Vianello A, Arcaro G, Molena B, et al. High-flow nasal cannula oxygen therapy to treat patients with hypoxemic acute respiratory failure consequent to SARS-CoV-2 infection. Thorax 2020; 75: 998-1000.doi:10.1136/thoraxjnl-2020-214993
- Demoule A, Vieillard Baron A, Darmon M, et al. High-flow nasal cannula in critically iII patients with severe covid-19. Am J Respir Crit Care Med 2020; 202: 1039-42.
- Wang K, Zhao W, Li J, Shu W, Duan J. The experience of high-flow nasal cannula in hospitalized patients with 2019 novel coronavirus infected pneumonia in two hospitals of Chongqing, Ann Intensive Care 2020; 10: 37. doi:10.1186/s13613-020-00653-z
- Dhand R, Li J. Coughs and sneezes: their role in transmission of respiratory viral infections, including SARS-CoV-2. Am J Respir Crit Care Med 2020; 202: 651-9. doi:10.1164/rccm.202004-1263PP
- Hui DS, Chow BK, Lo T, et al. Exhaled air dispersion during high-flow nasal cannula therapy versus CPAP via different masks. Eur Respir J 2019; 53: 1802339. doi:10.1183/13993003.02339-2018
- Ferrando C, Suarez-Sipmann F, Mellado-Artigas R, et al, COVID-19 Spanish ICU Network. Clinical features, ventilatory management, and outcome of ARDS caused by COVID-19 are similar to other causes of ARDS. Intensive Care Med 2020; 46: 2200-11. doi:10.1007/s00134- 020-06192-2
- Auld SC, Caridi-Scheible M, Blum JM, et al, Emory COVID-19 Quality and Clinical Research Collaborative. ICU and ventilator mortality among critically ill adults with coronavirus disease Crit Care Med 2020; 48: e799-804. doi:10.1097/CCM.0000000000004687
- Grieco DL, Bongiovanni F, Chen L, et al. Respiratory physiology of COVID-19-induced respiratory failure compared to ARDS of other etiologies. Crit Care 2020; 24: 529. doi:10.1186/s13054-020-03253-2
- Grasselli G, Tonetti T, Protti A, et al. Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicenter prospective observational study. Lancet Respir Med 2020;8:1201-8.
- Hyman JB, Leibner ES, Tandon P, et al. Timing of intubation and in-hospital mortality in patients with coronavirus disease 2019. Crit Care Explor 2020; 2: e0254. doi:10.1097/CCE.0000000000000254
- Hernandez-Romieu AC, Adelman MW, Hockstein MA, et al, Emory COVID-19 Quality and Clinical Research Collaborative. Timing of intubation and mortality among critically ill coronavirus disease 2019 patients: a single-center cohort study. Crit Care Med 2020; 48: e1045- doi:10.1097/CCM.0000000000004600
- Douglas WW, Rehder K, Beynen FM, Sessler AD, Marsh HM. Improved oxygenation in patients with acute respiratory failure: the prone position. Am Rev Respir Dis 1977; 115(4): 559–66.
- Pelosi P, Tubiolo D, Mascheroni D, Vicardi P, Crotti S, Valenza F, et al. Effects of the prone position on respiratory mechanics and gas exchange during acute lung injury. Am J Respir Crit Care Med 1998; 157(2): 387–93.
- Alqahtani JS, Mendes RG, Aldhahir A, Rowley D, AlAhmari MD, Ntoumeno-poulos G, et Global current practices of ventilatory support management in COVID-19 patients: an international survey. J Multidiscip Healthc 2020; 13: 1635–48.
- Ehrmann S, Li J, Ibarra-Estrada M, Perez Y, Pavlov I, McNicholas B, Roca O, Mirza S, Vines D, Garcia-Salcido R, Aguirre-Avalos G, Trump MW, Nay MA, Dellamonica J, Nseir S, Mogri I, Cosgrave D, Jayaraman D, Masclans JR, Laffey JG, Tavernier E; Awake Prone Positioning Meta-Trial Group. Awake prone positioning for COVID-19 acute hypoxaemic respiratory failure: a randomised, controlled, multinational, open-label meta-trial. Lancet Respir Med 2021; 9(12): 1387-1395. doi: 10.1016/S2213-2600(21)00356-8.
- Avdeev SN, Nekludova GV, Trushenko NV, Tsareva NA, Yaroshetskiy AI, Kosanovic D. Lung ultrasound can predict response to the prone position in awake non-intubated patients with COVID 19 associated acute respiratory distress syndrome. Crit Care 2021; 25(1): 35. doi: 1186/s13054-021-03472-1.
- Ibarra-Estrada M, Gamero-Rodríguez MJ, García-de-Acilu M, Roca O, Sandoval-Plascencia L, Aguirre-Avalos G, García-Salcido R, Aguirre-Díaz SA, Vines DL, Mirza S, Kaur R, Weiss T, Guerin C, Li J. Lung ultrasound response to awake prone positioning predicts the need for intubation in patients with COVID-19 induced acute hypoxemic respiratory failure: an observational Crit Care 2022; 26(1): 189. doi: 10.1186/s13054-022-04064-3.
- Weatherald J, Solverson K, Zuege DJ, Loroff N, Fiest KM, Parhar KKS. Awake prone positioning for COVID-19 hypoxemic respiratory failure: a rapid review. J Crit Care 2021; 61: 63–70.
- Solverson K, Weatherald J, Parhar KKS. Tolerability and safety of awake prone positioning COVID-19 patients with severe hypoxemic respiratory failure. Can J Anaesth 2021; 68(1): 64–70
- Whittemore P, Macfarlane L, Herbert A, Farrant J. Use of awake proning to avoid invasive ventilation in a patient with severe COVID-19 pneumonitis. BMJ Case Rep 2020; 13(8).
1.9.9 Экстракорпоральная мембранная оксигенация (С.Н. Авдеев)
В наиболее тяжелых случаях рефрактерной гипоксемии может быть рассмотрена экстракорпоральная мембранная оксигенация (ЭКМО) в соответствии с рекомендациями Всемирной организации здравоохранения для тяжелого течения COVID-19 [1]. ЭКМО может быть эффективна у некоторых пациентов с дыхательной недостаточностью, связанной с COVID-19, хотя результаты, вероятно, будут сильно зависеть от выбора пациента и времени начала ЭКМО [2]. Многоцентровое французское исследование 83 пациентов с ОРДС, связанным с COVID-19, получавших лечение с помощью ЭКМО, выявило предполагаемую 90-дневную смертность 37% [3]. В обсервационном исследовании, включавшем 1531 пациента из 177 центров в Европе и Израиле, сообщалось о смертности в 45% [4].
ЭКМО проводится в отделениях с опытом использования данной технологии и специалистами, владеющими техникой канюляции магистральных сосудов и настройкой ЭКМО. Решение о применении ЭКМО должно приниматься только после неэффективного использования всего арсенала стандартной терапии, в том числе ИВЛ и прон-позиции [5]. Успех применения методики во многом определяет эффективная патогенетическая терапия, профилактика и лечение бактериальных и/или грибковых осложнений, оценка перспектив восстановления функции легких, а также определение противопоказаний.
Большинство противопоказаний не являются абсолютными, и, несомненно, использование ЭКМО у пациента даже в критическом состоянии с наличием некоторых противопоказаний устраняет гипоксию и дает шанс на выздоровление [5].
Показанием к вено-венозной ЭКМО является результат в 3 балла и более при суммировании ниже перечисленных показателей:
Полисегментарная пневмония КТ 3-4 (1 балл);
РаO2/FiO2 <100 мм рт.ст. более 12 часов (1 балл);
РаO2/FiO2 <80 мм рт.ст. более 6 часов (2 балла);
РаCO2 >60 мм рт. ст. более 12 часов (2 балла).
При условии протективной вентиляции легких – РЕЕР >10 см вод. ст., ДО 4-6 мл/кг, пиковое давление в дыхательных путях <32 см вод.ст., использовано положение пациента лежа на животе, а также устранены другие причины гипоксемии и/или гиперкапнии.
Противопоказания к ЭКМО:
Возраст ≥65 лет;
Индекс массы тела ≥40 кг/м2;
Искусственная вентиляция легких более 5 суток;
Полиорганная недостаточность (оценка по шкале SOFA >12 баллов); Геморрагический инсульт;
Активное кровотечение, невозможность проведения антикоагулянтной терапии; Невозможность осуществить сосудистый доступ;
Тяжелое повреждение центральной нервной системы (оценка по шкале Глазго <5 баллов).
Рекомендации:
У пациентов с сочетанием ОРДС тяжёлой степени, малорекрутабельных легких и острого лёгочного сердца (или высокого риска острого лёгочного сердца) рекомендовано начинать применение экстракорпоральной мембранной оксигенации в первые 7 суток от начала развития ОРДС, так как это приводит к снижению летальности.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
У пациентов с ОРДС применение экстракорпорального удаления углекислоты при ОРДС не рекомендовано, так как не получено убедительных данных улучшения газообмена и улучшения исходов.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Литература
- WHO Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected: interim guidance. 2020. Available from: https://apps.who.int/iris/bitstream/handle/10665/33 0854/WHO-nCoV-Clinical-2020.2- pdf?sequence=1&isAllowed=yWHO/nCoV/Clinical/2020.2.
- Savarimuthu S, BinSaeid J, Harky A. The role of ECMO in COVID-19: can it provide rescue therapy in those who are critically ill? J Card Surg. 2020; 35(6):1298–301.
- Schmidt M, Hajage D, Lebreton G, et al; Groupe de Recherche Clinique en REanimation et Soins intensifs du Patient en Insuffisance Respiratoire aiguE (GRC-RESPIRE) Sorbonne Université; Paris-Sorbonne ECMO-COVID investigators: Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome associated with COVID-19: A retrospective cohort Lancet Respir Med 8: 1121–1131, 2020.
- Lorusso R, Combes A, Lo Coco V, De Piero ME, Belohlavek J; EuroECMO COVID-19 WorkingGroup; Euro-ELSO Steering Committee: ECMO for COVID-19 patients in Europe and Israel [published online ahead of print January 9, 2021]. Intensive Care Med 2021; doi: 1007/s00134-020-06272-3.
- Диагностика и интенсивная терапия острого респираторного дистресс-синдрома: клинические рекомендации Федерациии анестезиологов и реаниматологов России [Электрон. ресурс]. А.И. Ярошецкий, А.И. Грицан, С.Н. Авдеев [и др.] – 2020. – Режим доступа: http://www.far.org.ru/recomendation.
1.9.10 Ингаляции сурфактанта (С.Н. Авдеев)
Легочный сурфактант представляет собой липопротеидный комплекс, покрывающий поверхность альвеолярного эпителия и располагающийся на границе раздела фаз воздух- гликокаликс [1,2]. Его основными компонентами являются липиды, более 80% из которых
- фосфолипиды, а также холестерин, его эфиры, триглицериды, свободные жирные кислоты. Около 10% массы сурфактанта представлено сурфактант-ассоциированными белками [3]. Легочный сурфактант Легочный сурфактант синтезируется альвеолоцитами 2-го типа (А-II), хранится в ламеллярных тельцах и секретируется в альвеолярное пространство.
Обнаруженные существенные изменения в качественном составе и функциональной активности эндогенного сурфактанта при остром респираторном дистресс-синдроме (ОРДС) различной этиологии, а также положительные результаты сурфактант-терапии респираторного дистресс-синдрома новорожденных стали серьезными предпосылками для начала клинического изучения эффективности применения препаратов сурфактанта при терапии ОРДС у взрослых пациентов. Следующие положения являются патогенетическим обоснованием эффективности сурфактант-терапии ОРДС [4]:
- препараты сурфактанта восстанавливают содержание фосфолипидов, что предотвращает коллапс альвеол и микроателектазирование.
- благодаря этим препаратам происходит удаление вместе с мокротой токсических веществ и микроорганизмов из альвеолярного пространства путем сорбции на поверхности везикулярных частиц сурфактанта.
- препараты, содержащие сурфактант-ассоциированные белки, повышают активность альвеолярных макрофагов.
- многократное введение экзогенного сурфактанта стимулирует синтез эндогенного сурфактанта альвеолоцитами II типа.
При инфекции SARS-CoV-2 возникает дефицит сурфактанта, вызванный гибелью альвеолоцитов II типа, приводит к микроателектазированию, шунтированию крови и снижению комплайнса легких [5,6].
Наличие в России препарата сурфактанта, разрешенного для применения у взрослых, и достаточный опыт сурфактант-терапии различных критических состояний, включая тяжелые вирусные пневмонии, позволили уже весной 2020 г. начать применение Сурфактанта-БЛ для лечения пациентов с COVID-19. Можно также подчеркнуть, что ЛС способствует коррекции эндотелиальной дисфункции в экспериментах на животных [7], имеющей непосредственное отношение к повышенному тромбообразованию при инфекции SARS-CoV-2.
Особенности патогенеза тяжелого ОРДС при COVID-19 и крайне неудовлетворительные результаты лечения пациентов на поздних стадиях пневмонии, переведенных на ИВЛ, требовали изменения тактики сурфактант-терапии. Исследователи в России пришли к выводу о необходимости более раннего применения Сурфактанта-БЛ, на тех стадиях заболевания, когда пациенты получают низкопоточную или высокопоточную оксигенотерапию (ВПО), или неинвазивную вентиляцию легких (НИВЛ) [4,8]. Реализация этого подхода потребовала использования ингаляционного пути введения Сурфактанта- БЛ, легко реализуемого при сохраненном спонтанном дыхании пациентов как в условиях ОРИТ, так и в инфекционных отделениях.
К настоящему времени в России проведены несколько обзервационных иследований по оценке эффективности и безопасности ингаляционного сурфактанта [8-11]. На основе этих данных можно сделать выводы, что сурфактант-терапия позволяет предупредить дальнейшее повреждение легких, сократить риск перевода больных на инвазивную ИВЛ, смертность при которой больных COVID-19 пневмонией чрезвычайно высока.
Применение ингаляции Сурфактанта БЛ для терапии тяжелого течения инфекции SARS- CoV-2 у пациентов, нуждавшихся в неинвазивной респираторной поддержке, привело к значимому снижению летальности. В настоящее время проводится ряд более крупных испытаний ингаляционной терапии сурфактантом при COVID-19-ассоциированным ОРДС (NCT04362059, NCT04568018).
Методика приготовления эмульсии сурфактанта для ингаляций [4]
Для ингаляционной терапии используют эмульсию с содержанием Сурфактанта-БЛ от 5 до 15 мг в 1 мл физиологического раствора (содержимое флакона (75 мг) разводят в 5–10 мл физиологического раствора). В зависимости от тяжести повреждения легких и выраженности гипоксемии используют от 2 до 4 ингаляций 75–150 мг Сурфактанта-БЛ в сутки, обычно на протяжении 5 дней и более. Для ингаляции Сурфактанта-БЛ могут быть использованы струйные небулайзеры (аэрозоль образуется под воздействием потока воздуха) и так называемые меш-небулайзеры (аэрозоль образуется в результате колебаний сетки-мембраны). Меш-небулайзеры имеют некоторые преимущества перед струйными из-за более высокой производительности (до 0,5 мл в минуту). Меш-небулайзеры могут использоваться при спонтанном дыхании пациентов, а также встраиваться в дыхательный контур аппаратов во время проведения НИВЛ, ВПО и ИВЛ [4].
Рекомендации:
Госпитализированным пациентам с прогрессирующей тяжелой инфекцией СOVID-19 при условии назначения этиотропной (противовирусной) и патогенетической терапии (сГКС, ингибиторы IL-6 и/или ингибиторы JAC-киназы) рекомендуется назначение ингаляционной терапии сурфактантом
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Начинать терапию экзогенным сурфактаном следует как можно раньше, желательно не позднее 24 часов от момента стойкого снижения PaO2/FiO2 менее 200 мм рт. ст. при условии проведения низкопоточной или высокопоточной оксигенотерапии, или неинвазивной вентиляции легких
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Для ингаляции Сурфактанта-БЛ могут быть использованы струйные небулайзеры или меш-небулайзеры; используют от 2 до 4 ингаляций 75–150 мг Сурфактанта-БЛ в сутки, обычно на протяжении 5-7 дней.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Литература
- Розенберг О.А. Препараты легочного сурфактанта и сурфактант-терапия ОРДС в условиях хирургической реанимации (обзор литературы). Креативная хирургия и онкология 2019; 9(1): 55–65 https://doi.org/10.24060/2076-3093-2019-9-1-50-65.
- Clements J.A. Surface tension of lung extracts. Proc. Soc. Exp. Biol. Med. 1957; 95(1): 170– http://dx.doi.org/10.3181/00379727 95 23156. PMID: 13432025.
- King R.J., Clements J.A. Surface active materials from dog lung: composition andphysiological Am. J. Physiol 1972; 223(3): 715–726. PMID: 506862.
- Баутин А.Е. Применение препарата сурфактанта в комплексной терапии острого респираторного дистресс-синдрома. Методические рекомендации. 2021: 42с.
- Takano H. Pulmonary surfactant itself must be a strong defender against SARS-CoV-2. Med 2020; 144: 110020.
- Schousboe P., Wiese L., Heiring C., et al. Assessment of pulmonary surfactant in COVID-19 Crit Care. 2020;24(1):552.
- Кириллов Ю.А., Чернов И.А., Малышева Е.М., Тимофеев С.Е., Кукушкин В.И., Жарков Н.В., Розенберг О.А. Оксидативный стресс и эндотелиальная дисфункция в развитии экспериментального радиоиндуцированного повреждения легких и их коррекция препаратом легочного сурфактанта. Журнал анатомии и гистопатологии 2020; 9 (1): 35–
- Баутин АЕ, Авдеев СН., Сейлиев А.А., Швечкова М.В., Мержоева З.М., Трушенко Н.В., Семенов А.П., Лапшин К.Б., Розенберг О.А. Ингаляционная терапия сурфактантом в комплексном лечении тяжелой формы COVID-19-пневмонии. Туберкулёз и болезни лёгких 2020; 98(№9): 6-12. http://doi.org/10.21292/2075-1230-2020-98-9-6-12.
- Аверьянов А.В., Клыпа Т.В., Балионис О.И., Бычинин М.В, Черняк А.В., Троицкий А.В. Ингаляционный сурфактант при высокопоточной кислородотерапии у больных COVID- 19: результаты ретроспективного анализа. Ремедиум 2020; (7-8): 84-88. doi: 10.21518/1561- 5936-2020-7-8-84-88.
- Avdeev SN, Trushenko NV, Chikina SY, Tsareva NA, Merzhoeva ZM, Yaroshetskiy AI, Sopova VI, Sopova MI, Rosenberg OA, Schermuly RT, Kosanovic D. Beneficial effects of inhaled surfactant in patients with COVID-19-associated acute respiratory distress syndrome. Respir Med 2021; 185: doi: 10.1016/j.rmed.2021.106489.
- Швечкова М.В., Кукарская И.И., Марченко Р.Н., Ахматгараев В.В., Кукарская Е.А., Швечкова А.С. Опыт применения сурфактант-терапии при пневмонии, ассоциированной с COVID-19, у пациенток акушерского профиля. Ремедиум 2020; №11-12: 42-47.
1.9.11 Симптоматическая терапия (А.А. Зайцев, А.Г. Малявин)
Противокашлевые препараты
У больных с новой коронавирусной инфекцией COVID-19 с жалобами на непродуктивный (сухой) мучительный кашель, значительно нарушающий качество жизни (болевой синдром, нарушение сна) рекомендовано назначение противокашлевого средства с симптоматической целью (бутамират, леводропропизин, ренгалин).
Уровень убедительности рекомендации□ С (уровень достоверности доказательств – 5)
Комментарии: Кашель у пациентов с COVID-19 60% встречается более чем в 60% случаев [1-2]. Кашель, как правило, непродуктивный (сухой), причем, как у больных с легким течением, так и у пациентов с поражением легких и дыхательной недостаточностью. У пациентов с тяжелым течением COVID-19 кашель приводил к серьезным, а порой и фатальным последствиям. Нередкими являлись случаи развития пневмоторакса, эпизодов десатурации на фоне кашля. В настоящее время мы известно, что развитие кашля при SARS-CoV-2 инфекции обусловлено поражением эпителиоцитов легких, которое, как правило, не приводит к развитию выраженного экссудативного воспаления [2-6]. Под воздействием повреждающего действия вируса эпителиальные клетки дыхательных путей синтезируют и высвобождают множество факторов роста, цитокинов, медиаторов воспаления, включая брадикинин и гистамин. Они в свою очередь могут действовать на рецепторы и ионные каналы на окончаниях чувствительных нервов в дыхательных путях, вызывая формирование потенциала действия и повышая возбудимость этих нервов к последующему действию раздражителя [2-5]. Учитывая, что большое количество сенсорных окончаний блуждающего нерва начинаются в эпителии и субэпителиальной слизистой оболочке дыхательных путей, их раздражение приводит к появлению сухого кашля [4-6].
Это крайне важный вопрос, так данные о реальной практике, изобилуют назначением мукоактивных средств, тогда как, учитывая механизм их действия целесообразность применения мукоактивных средств при COVID-19, представляется сомнительной, ввиду практически полного отсутствия продукции бронхиального секрета, что подтверждается морфологическими изменениями в бронхолегочной системе при данной инфекции. И только лишь при тяжелом течении COVID-19, при развитии геморрагических инфарктов легких и тромбозов легочных сосудов при минимальных десквамативных поражениях трахеи и бронхов; иногда может возникать выделение серозно-гнойного экссудата, обусловленное в подавляющем числе случаев присоединением внутрибольничной инфекции у пациентов, находящихся на инвазивной ИВЛ [2, 6].
В этой связи для лечения сухого кашля при COVID-19 должны использоваться противокашлевые препараты [1-2, 6-8] - бутамират, леводропропизин, комбинация антител к брадикинину, морфину и гистамину), а в значительно более редких случаях при наличии мокроты (присоединение бактериальной инфекции) - мукоактивные средства.
Литература
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции COVID-19». Версия 15 (22.02.2022).
- Оковитый С. В., Суханов Д. С., Зайцев А. А. Кашель при новой коронавирусной инфекции (COVID-19): рациональные подходы к фармакотерапии (обзор) // Пульмонология. - 2022. - Т. 32. № 2. - С.232-238.
- Zaccone E.J., Lieu T., Muroi Y. et al. Parainfluenza 3-induced cough hypersensitivity in the guinea pig PLoS One. 2016; 11(5): e0155526. DOI: 10.1371/journal.pone.0155526
- Deng Z., Zhou W., Sun J. et al IFN-γ enhances the cough reflex sensitivity via calcium influx in vagal sensory neurons. Am J Respir Crit Care Med. 2018; 198(7): 868-879. DOI: 1164/rccm.201709-1813OC
- Patil M.J., Ru F., Sun H. et al Acute activation of bronchopulmonary vagal nociceptors by type I interferons. J Physiol. 2020; 598(23): 5541-5554. DOI: 1113/JP280276
- Зайцев А.А., Оковитый С.В., Мирошниченко Н.А., Крюков Е.В. Кашель: Методические рекомендации для врачей // М.: ГВКГ им. Н.Н.Бурденко. - 2021.
- Зайцев А.А. Кашель: проблемы и решения // Практическая пульмонология. – -№2. - С.78-86.
- Будневский А.В., Овсянников Е.С., Фейгельман С.Н. Исследование эффективности левопронта в лечении непродуктивного кашля // Практическая пульмонология. -2021. -№2. – С.65-74.
1.9.12 Методы немедикаментозной терапии (А.Г. Малявин)
- Инспираторный тренинг
Дыхательные упражнения при коронавирусном поражении легких, вследствие повреждения альвеол для улучшения вентиляционной способности легких, улучшения механики дыхания, работы дыхательной мускулатуры. Рационально использование объемных и потоковых мотивирующих вдох спирометров.
- Вибрационно-перкуссионная терапия
Метод сочетает механическое воздействие высокочастотной вибрацией и компрессией на грудную клетку.
- Интрапульмональная перкуссионная вентиляция
Метод сочетает неинвазивную вентиляцию легких, методику рекрутирования плохо вентилируемых отделов легких с последующим улучшением равномерности вентиляции и нормализацией вентиляционно-перфузионных отношений и мобилизацию бронхиального секрета.
- Осцилляторные РЕР-тренажеры
Сочетание предупреждения формирования воздушных ловушек на выдохе и мобилизации мокроты.
Комментарий: Параметры использования респираторных тренажеров и устройств подробно изложены в следующих рекомендациях: Малявин А.Г., Бабак С.Л. и др.
Физиотерапия и кислородотерапия пациентов с дыхательными расстройствами и нарушением мукоцилиарного клиренса. Клинические рекомендации РНМОТ. Терапия.2019;5; Приложение; Малявин А.Г., Адашева Т.В., Бабак С.Л., Губернаторова. Е.Е., Уварова О.В. Медицинская реабилитация больных, перенесших COVID-19 инфекцию. Методические рекомендации. Терапия.2020;5,1-48.
1.10 Формулировка заключительного клинического и патологоанатомического диагнозов (О.В. Зайратьянц, М.В. Самонова, А.Л. Черняев)
Примеры.
Заключительный клинический диагноз:
ОСНОВНОЕ ЗАБОЛЕВАНИЕ. U07.1. Короновирусная инфекция, вызванная вирусом SARS-Cov-2 (ПЦР +, номер, … от 6.04.2020 г): тяжелого течения, двустороннее вирусное поражение легких (КТ4, …, %).
ОСЛОЖНЕНИЯ. ОРДС, ДН 3. Тромбы в глубоких венах нижних конечностей. Реанимационные мероприятия и интенсивная терапия: ИВЛ с 10.04.2020 г. Трахеостомия от 16.04.2020 г.
СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ. Гипертоническая болезнь 2 ст., 2 степ.
Заключительный клинический диагноз:
ОСНОВНОЕ ЗАБОЛЕВАНИЕ. U07.1. Новая короновирусная инфекция, вызванная вирусом SARS-Cov-2 (ПЦР + номер, … от 30.04.2020 г) тяжелого течения: двустороннее вирусное поражение легких (КТ 3, …%).
ОСЛОЖНЕНИЯ. ОРДС. ДН 3. ПОН.
Реанимационные мероприятия и интенсивная терапия: ИВЛ с 3.05.2020 г. СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ. Гипертоническая болезнь 2 ст., 2 степени. Псориаз. Хронический гастрит.
Заключительный клинический диагноз:
ОСНОВНОЕ ЗАБОЛЕВАНИЕ. U07.1. Новая короновирусная инфекция, вызванная вирусом SARS-Cov-2 (ПЦР + номер, … от 30.04.2020 г), тяжелого течения: двустороннее вирусное поражение легких (КТ 3, …%).
СОЧЕТАННОЕ ЗАБОЛЕВАНИЕ. Гипертоническая болезнь 2 ст., 2 степени. ОСЛОЖНЕНИЯ. ОРДС. ДН 3. ДВС-синдром. Острый инфаркт миокарда 2 типа от 24.04.2020 г. Кардиогенный шок. ПОН.
Реанимационные мероприятия и интенсивная терапия: ИВЛ с 24.04.2020 г.
Патологоанатомический диагноз:
ОСНОВНОЕ ЗАБОЛЕВАНИЕ. U07.1. Новая короновирусная инфекция, вызванная вирусом SARS-Cov-2 (ПЦР + № …, от 01.06.2020 г.): экссудативная фаза диффузного альвеолярного повреждения или острая интерстициальная вирусная пневмония (клинически ОРДС).
ОСЛОЖНЕНИЯ. Острая дыхательная (или респираторная) недостаточность. Острое общее венозное полнокровие. Отек головного мозга.
Реанимационные мероприятия и интенсивная терапия: ИВЛ с 5.06.2020 г (4 суток). СОЧЕТАННОЕ ЗАБОЛЕВАНИЕ. Гипертоническая болезнь 3 ст. : ….. .
ОСЛОЖНЕНИЯ. Острая дыхательная (или респираторная) недостаточность. Хроническое общее венозное полнокровие: двусторонний гидроторакс (по 300 мл). Отек головного мозга.
Реанимационные мероприятия и интенсивная терапия: ИВЛ (дата).
СОПУТСТВУЮЩЕЕ ЗАБОЛЕВАНИЕ. Атеросклероз аорты (стадия, степень).
Литература
- Временные методические рекомендации по кодированию и выбору основного состояния в статистике заболеваемости и первоначальной причины в статистике смертности связанных с COVID-19 Минздрава России от 07.2021 (Версия 2).
- Забозлаев Ф.Г., Зайратьянц О.В., Кактурский Л.В. и соавт. Методическое руководство по сопоставлению заключительного клинического и патологоанатомического/судебно- медицинского диагнозов. Возрастная группа: дети/взрослые. МР 109. Минздрав России, 32.с.
- Клевно В.А., Зайратьянц О.В. и др. Правила формулировки судебно-медицинского и патологоанатомического диагнозов, выбора и кодирования причин смерти по МКБ-10: Руководство для врачей / под ред. В.А. Клевно, О.В. Зайратьянца – М.: ГЭОТАР-Медиа, 2022 - 656 с.: ил.



